Aβ1-42寡聚體對α-syn過表達SHSY5YA53T細胞自噬功能的影響☆
郭曼莉 高玉元 張晴曦 聶坤 王麗娟
帕金森病(Parkinson disease,PD)是最常見的神經退行性疾病之一,其主要的病理改變是黑質-紋狀體多巴胺能神經元的脫失。α-突觸核蛋白(alpha-synuclein,α-syn)異常聚集形成的的路易小體,與神經元的死亡密切相關[1]。α-突觸核蛋白基因(SNCA)A53T點突變是家族性PD常見致病突變類型[2-3]。β淀粉樣蛋白(Aβ)級學說是阿爾茲海默病(Alzheimer disease,AD)的主流學說,Aβ1-42是AD主要病理成分,有多種聚合形態,其中Aβ1-42寡聚體毒性最強。研究表明,Aβ1-42參與PD的病理發病過程,與PD患者認知損害和步態障礙相關[4-5]。Aβ1-42寡聚體可促進α-syn的聚集和神經元的死亡。自噬是神經元內重要的蛋白途徑,αsyn的自噬性降解障礙被認為是PD的重要病理過程。Aβ1-42對PD自噬功能的影響鮮有文獻報道。本研究將建立α-synA53T過表達的帕金森病體外模型,檢測Aβ1-42寡聚體處理前后細胞自噬相關蛋白 p62、LC3、Beclin-1的變化,以探究 Aβ1-42寡聚體在PD中對細胞自噬的影響。
1 材料與方法
1.1 細胞培養SHSY5Y細胞由廣州賽庫生物技術有限公司進行STR鑒定,以含體積分數0.10的胎牛血清、100 U/mL的青鏈霉素雙抗的DMEM/F-12培養基培養,置于37°C、含體積分數0.05的CO2培養箱中傳代培養,每2~3 d傳代1次。
1.2 細胞慢病毒轉染在轉染前1 d,將處于對數生長期的SHSY5Y細胞按每孔105個細胞接種于24孔板中,使其在轉染次日達到80%的融合度。24 h后吸去舊培養液,加入新的無血清培養液,在培養液中分別加入純化的攜帶SNCAA53T慢病毒液和攜帶空載體病毒液 (廣州復能基因有限公司),12 h更換為含 10%FBS的 DMEM/F12培養基繼續培養;慢病毒感染72 h后,細胞培養時加入終濃度為 1 μg/mL嘌呤霉素篩選 SNCAA53T穩定過表達的 SHSY5Y細胞(SHSY5YA53T組),以及空載體對照細胞(SHSY5YCON組),細胞繼續擴增培養。
1.3 熒光實時定量PCR(RT-qPCR)法檢測SNCA在SHSY5Y細胞中的表達細胞轉染慢病毒后嘌呤霉素篩選 7 d,將 SHSY5YA53T組,SHSY5YCON組,SHSY5Y正常細胞組細胞用Trizol法提取總RNA,進行逆轉錄和熒光實時定量PCR擴增,以檢測SNCAmRNA的表達情況。引物使用Primer-BLAST在線設計,華大基因科技有限公司合成。SNCA引物的上游序列為:5'-AA GAGGGTGTTCTCTATGTAGGC-3',下游序列為:5'-GCTCCTCCAACATTTGTCACTT-3';內參照ACTB引物的上游序列為:5'-GGCACCCAGCACAATGAAG-3',下游序列為:5'-CCGATCCACACGGAGTACTTG-3'。 qPCR 反應參數為:95°C 預變性 30 s,95°C 5 s、60°C 30 s,循環 40 次。
1.4 CCK-8法檢測細胞增殖將處于對數生長期的細胞按每孔105接種于96孔板中,加入不同濃度的 Aβ1-42寡聚體,置于 37°C、體積分數 0.05 CO2。培養箱中培養24 h后,每孔加入 10 μL CCK-8溶液,細胞培養箱內繼續避光孵育4 h;在酶標儀450 nm測定吸光度。
1.5 Aβ1-42寡聚體的制備[6-7]冰上用HFIF將Aβ1-42多肽(英國ABCAM)充分溶解至1mmol/L,室溫下于通風處內揮發過夜,制備得Aβ1-42肽膜。使用時用預冷的無水DMSO溶解肽膜至5 mmol/L,加入PBS獲得100 μmol/L的Aβ1-42單體母液。取適量的Aβ1-42單體母液于4℃放置24 h,制備得Aβ1-42寡聚體。
1.6 細胞接種與處理細胞吹打制成單細胞懸液,用DMEM/F-12培養液將細胞密度稀釋為1×106/L,每孔2000 μL接種至多聚-L-賴氨酸預處理的6孔板中,于37°C、含體積分數0.05的 CO2培養箱中培養。分組處理:A53T組:無血清培養基孵育SHSY5YA53T24 h;CON組:無血清培養基孵育SHSY5YNC24 h;A53T+Aβ 單組:10 μmol/L 的Aβ1-42單體孵育SHSY5YA53T24h;CON+Aβ單組: 用10 μmol/L的Aβ1-42單體孵育SHSY5YNC24 h。A53T+Aβ寡組:10 μmol/L 的 Aβ1-42寡聚體孵育SHSY5YA53T24 h;CON+Aβ 寡組:用 10 μmol/L 的Aβ1-42寡聚體孵育SHSY5YNC24 h。
1.7 Western blot法測定 p62、LC3、Beclin-1 表達變化 各組細胞處理后,使用RIPA(碧云天)裂解提取總蛋白,用BCA法進行蛋白定量后,按20 μg加樣量進行免疫沉淀。SDS-聚丙烯酰胺凝膠電泳分離蛋白,濕轉法電轉移到PVDF膜上,將PVDF膜用脫脂奶粉常溫封閉2 h,分別置于p62(1:1000,CST,兔多克隆抗體)、LC3 一抗(1∶1000,CST)、Beclin-1(1:1000,CST)、GAPDH 一抗(1:10000,CST)孵育,4°C搖床過夜,然后與 HRP標記的山羊抗兔二抗(1∶10000)室溫孵育1 h后,用 ECL化學發光試劑盒曝光顯色,條帶的強弱用ImageJ分析軟件進行灰度分析。以 Beclin-1、p62、LC3-Ⅱ與GAPDH的平均灰度的比值表示 Beclin-1、p62、LC3-Ⅱ蛋白的表達水平。
1.8 統計學方法采用GraphPad Prism6軟件進行統計分析,實驗結果以±s表示,兩組間比較采用單因素方差分析。檢驗水準α=0.05。
2 結果
2.1 外源SNCA在SHSY5Y細胞中的表達細胞轉染慢病毒后嘌呤霉素篩選7 d,SHSY5YA53T組mRNA和α-syn表達水平較SHSY5Y組明顯增高(P<0.05),基因過表達 41 倍。 SHSY5YCON組和SHSY5Y正常細胞比較無統計學意義 (P>0.05)。SNCAmRNA RT-qPCR結果和α-syn Western blot結果見圖1。
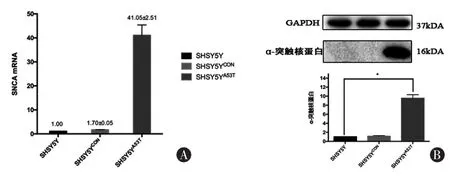
圖1 外源α-syn基因在SHSY5Y細胞中的表達 A為SNCA mRNA在各組細胞中的表達;B為α-syn在各組細胞中的表達量。 *P<0.05
2.2 SHSY5Y組、SHSY5YCON 組、SHSY5YA53T組細胞增殖不受抑制SHSY5Y組、SHSY5YCON組、SHSY5YA53T組細胞分別接種至 96孔板,1×104細胞/孔,相同條件下培養,CCK-8法連續5日檢測細胞活力,結果顯示,各組細胞生長狀況良好。各組細胞增殖速度無統計學差異(P>0.05)。
2.3 Aβ1-42寡聚體抑制細胞的增殖不同濃度的Aβ1-42寡聚體處理 SHSY5YCON組、SHSY5YA53T組細胞24 h,細胞的增殖均受抑制,隨著Aβ1-42寡聚體濃度的增加,細胞增殖的抑制效果更明顯。SHSY5YA53T組的抑制效果較SHSY5YCON組顯著。

圖2 不同濃度Aβ1-42寡聚體干預細胞24 h后細胞的活力檢測*:與 SHSY5YCON對照組相比,P<0.05;#:與 0 μmmol/LAβ1-42寡聚體處理組相比,P<0.05
2.4 細胞自噬相關蛋白的表達Western blot結果顯示,與SHSY5YCON對照組相比,Aβ1-42單體和寡聚體處理后,SHSY5YA53T組細胞Beclin-1和LC3-Ⅱ蛋白表達減少,差異有統計學意義(P<0.05)見圖3。兩組間P62蛋白表達均有增加趨勢,差異無統計學意義(P=0.489)。
3 討論
本研究通過構建α-synA53T過表達的SHSY5Y細胞模型模擬PD神經元的病理特點,結果提示,α-synA53T過表達的SHSY5Y細胞,增殖存活率無明顯下降,α-synA53T過表達對細胞無明顯的毒性作用,PAL、SCARLATA等[8-9]研究認為只有在特定的氧化應激或炎癥等誘發因素干擾下,過表達αsyn才有細胞毒性作用。
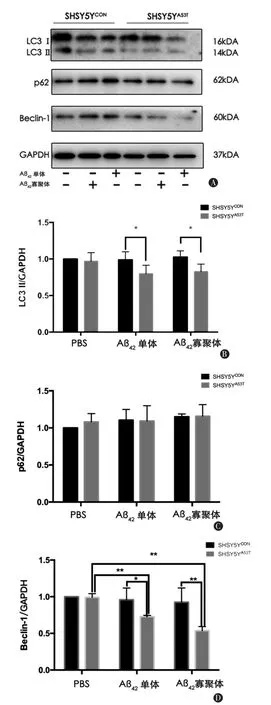
圖3 Western Blot法檢測自噬相關蛋白的表達 A:自噬相關蛋白的表達情況;B:LC3-Ⅱ的相對表達水平;C:p62蛋白的相對表達水平;D:Beclin-1蛋白的相對表達水平 *P<0.05,**P<0.001
相關臨床研究發現與健康對照相比,Aβ1-42在PD患者腦組織中沉積增多[4],且與PD患者認知損害和步態障礙相關[4-5]。GILBERT等[10]發現降低Aβ的表達可以延緩α-syn相關的神經退行性改變。本研究結果發現,Aβ1-42寡聚體處理后,αsynA53T過表達SHSY5Y細胞和對照組SHSY5Y細胞增殖受抑制,在兩組細胞中均具有明顯的細胞毒性,對α-synA53T過表達組細胞的毒性作用更顯著,與LIN等[11]研究結果相符。自噬是神經元清除異常折疊蛋白的重要途徑,在AD中,Aβ1-42可損害自噬功能引起tau蛋白的沉積[12-13]。本研究對比Aβ1-42寡聚體處理前后,SHSY5YA53T組和SHSY5YCON對照組自噬相關蛋白 LC3-Ⅱ,p62,Beclin-1的表達水平,SHSY5YA53T組LC3-Ⅱ蛋白和Beclin-1蛋白的表達相比對照組減少,p62蛋白表達未見統計學差異。 LC3-Ⅱ是目前最廣泛檢測的自噬指標,隨細胞內自噬功能激活增多,Beclin-1下調提示細胞自噬功能活性受抑制[14]。α-synA53T過表達的細胞中,Aβ1-42寡聚體可抑制細胞的自噬功能,在對照組細胞中,未觀察到自噬相關蛋白的改變。p62作為另一重要的自噬指標,可連接LC3-Ⅱ,介導泛素化底物的自噬性降解,本研究兩組細胞中,p62蛋白改變均不明顯,可能與p62蛋白變化的滯后性相關[15]。本研究設立Aβ1-42單體處理對照組,自噬蛋白變化趨勢與Aβ1-42寡聚體處理組相符,可能為細胞37℃孵育過程與寡聚化處理過程相似,Aβ1-42單體產生聚集[7]。
綜上所述,通過慢病毒轉染構建人α-synA53T過表達的SHSY5Y細胞模型,可以穩定模擬PD神經元α-syn過表達的病理表現,可作為PD發病機制研究的體外模型。Aβ1-42寡聚體抑制該細胞模型的存活和增殖,與對照組細胞相比,Aβ1-42寡聚體處理后,過表達組LC3-Ⅱ、Beclin-1自噬相關蛋白表達減少,提示Aβ1-42寡聚體通過抑制細胞的自噬功能在PD發病過程中促進神經元的死亡。本研究的不足之處是,Aβ1-42寡聚體在PD體外模型中抑制自噬相關蛋白Beclin-1、LC3-Ⅱ的表達,Aβ1-42寡聚體也可能是PD自噬功能受損的產物,后續研究仍需進一步探索Aβ1-42寡聚體在PD自噬損傷過程的具體機制。

