鈦摻雜鋰錳氧化物離子篩的制備及性能研究
張 欣,王 亮,馬來波,張 琦,黃西平
(自然資源部天津海水淡化與綜合利用研究所,天津 300192)
金屬鋰、鋰合金及其鹽類以其優異的性能,被稱為“工業味精”和“推動世界進步的能源金屬”,廣泛應用于電子、冶金、化工、醫藥、能源等領域,是國民
鹽湖鹵水中鋰的儲藏量極其豐富(1.0×1010kg),目前80%的鋰鹽產品均來自于鹽湖鹵水,因此,從鹽湖鹵水提鋰具有廣闊的應用前景,也是未來實現鋰工業化可持續發展的關鍵[3-4]。
目前,鹽湖鹵水提鋰方法主要有沉淀法、鹽析法、溶劑萃取法、膜分離法和吸附法等,其中,離子篩吸附法提鋰具有鋰收率高、選擇性高、循環利用率高、綠色環保等優點,是鹵水提鋰最具工業前景的工藝方法[5-6]。尖晶石型鋰錳氧化物離子篩具有高選擇性和高吸附量,是最典型的一類鋰離子篩吸附劑。目前研究最多的鋰錳氧化物離子篩前軀體有LiMn2O4、Li4Mn5O12和Li1.6Mn1.6O4,這3種前軀體經酸浸脫鋰后可分別制得鋰離子篩λ-MnO2、MnO2·0.31H2O和MnO2·0.5H2O,其中MnO2·0.5H2O離子篩的理論吸附容量最大、化學性質最穩定[7-9]。
鈦具有很強的結構穩定性,可以替代鋰錳氧化物中部分錳離子,從而增加尖晶石結構的穩定性[10]。文章通過共沉淀—水熱合成法合成出鈦摻雜的鋰錳氧化物離子篩前驅體Li1.6Mn1.6O4,對酸洗得到的MnO2·0.5H2O離子篩進行形貌和物相分析,研究不同的鈦摻雜量、酸浸洗脫時間對鋰的吸附容量及鈦和錳的溶損率,以及對不同離子的選擇吸附性能,從而研制開發出對鋰元素具有高選擇性、高吸附量的的鋰錳氧化物離子篩材料。
2 實驗部分
2.1 實驗原料及試劑
一水氫氧化鋰、硫酸錳、無水氯化鋰、雙氧水(30%)、氨水(25%~28%)、氫氧化鈉、硫酸銨、氯化鈉、氯化鉀、氯化鎂、無水乙醇、鹽酸(35%~38%)等,所用試劑均為分析純。
2.2 實驗儀器和設備
掃描電子顯微鏡(JSM-6360lv,日本電子株式會社)、X射線衍射儀(Rigaku D.max,日本理學)、原子吸收分光光度計(TAS-990F,北京普析通用儀器有限責任公司)、高壓反應釜(WDF,山東威海自控反應釜有限公司)、集熱式磁力攪拌器(DF-1,江蘇中大儀器廠)、pH計(PHS-3C,雷磁分析儀器廠)。
2.3 合成步驟及方法
將硫酸錳和硫酸鈦按一定配比加水溶解,在攪拌下滴加氨水和雙氧水,然后用氫氧化鈉溶液調節pH值至12,充分反應,得到錳鈦的共沉淀混合物。共沉淀混合物經洗滌后加入LiOH溶液中,混合均勻后進行水熱合成反應,最后再經焙燒制備出鈦摻雜錳氧化物鋰離子篩前驅體。
將鋰離子篩前驅體在鹽酸溶液中進行酸浸洗脫實驗,酸浸數小時后取上清液,分別用原子吸收分光光度計測量溶液中Li+和Mn2+的含量,用可見分光光度計測定Ti4+的含量,計算錳的溶損率。將經過酸浸的鋰離子篩浸入鋰溶液中,攪拌24 h后取上清液,測定其中Li+的濃度,計算公式(1)計算離子篩樣品對Li+的吸附量,考察該離子篩在不同條件下的吸附量。
(1)
式中:q——每克鋰吸附劑吸附Li+的量,mg/g;C0——Li+的起始濃度,mg/L;Ct——時間t時的Li+的濃度,mg/L;V——溶液的體積,L;m——吸附劑的質量,g。
由公式(2)計算鋰和錳的溶出率。
(2)
式中:Ri——金屬i的溶出率;Ci——i在上清液中的濃度,mg/L;V——上清液的體積,L;ms——前驅體的質量,g;mi——i在原始樣品的含量,mg/g。
3 實驗結果及討論
3.1 離子篩微觀形貌分析
考察鈦摻雜對錳氧化物鋰離子篩微觀形貌的影響,分別對鈦摻雜和未摻雜的離子篩樣品進行SEM分析,如圖1所示。

圖1 未摻雜(A)和鈦摻雜(B)的離子篩SEM圖Fig.1 SEM Charts of undoped(A) and Titanium doped(B) ion sieves
從圖1可以看出,通過共沉淀—水熱法合成出的未摻雜和鈦摻雜的鋰錳氧化物離子篩的微觀形貌均呈顆粒狀,且顆粒之間存在較多的空隙,這有利于離子的嵌入和遷出,這說明摻雜一定量的鈦對錳氧化物鋰離子篩的微觀形貌影響較小。
3.2 離子篩物相分析
考察鈦摻雜對錳氧化物鋰離子篩晶型的影響,分別對鈦摻雜和未摻雜的離子篩樣品進行XRD分析,如圖2所示。

圖2 未摻雜(A)和鈦摻雜(B和C)鋰錳氧化物離子篩的XRD圖譜Fig.2 XRD Spectra of undoped(A) and Titanium doped (B and C) Lithium Manganese Oxide ion sieves
從圖2可以看出,未摻雜的鋰錳氧化物離子篩(圖A)具有典型尖晶石型Li1.6Mn1.6O4的特征峰。與之相比,鈦摻雜的離子篩前驅體(圖B)未顯現其它特征衍射峰,說明少量鈦摻雜并未改變其晶型,仍呈典型尖晶石型結構;經過酸浸得到的離子篩(圖C)同樣具有相似的尖晶石型的特征衍射峰,峰強度略有降低,可能是在酸浸過程中錳的少量溶損所致。
3.3 鈦摻雜量對鋰錳氧化物離子篩性能的影響
考察鈦摻雜量對離子篩酸浸過程鈦和錳溶損率及對鋰吸附容量的影響,如圖3所示。
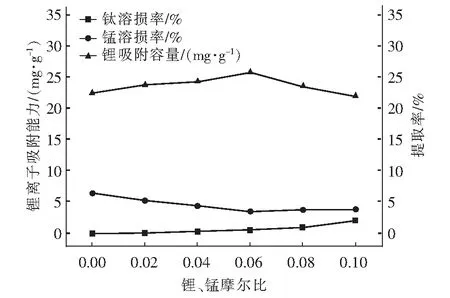
圖3 離子篩酸浸過程鈦和錳溶損率及吸附量與鈦的摻雜量的關系Fig.3 The relationship between the solubility and adsorption of titanium and manganese and the doping amount of titanium in the acid leaching process of ion sieve
從圖3可以看出,與未摻雜的離子篩相比,摻雜少量鈦的鋰錳氧化物離子篩可適當提高鋰的吸附容量,當n(Ti) ∶n(Mn)為0.06時,具有最佳的鋰吸附量25.8 mg/g。當n(Ti)∶n(Mn)<0.06時,酸浸過程離子篩中錳的溶損率隨鈦摻雜量的增大明顯降低;當n(Ti)∶n(Mn)>0.06時,錳溶損率變化較小,趨于穩定。而鈦Ti本身的溶損率隨摻雜量的增大逐漸增大。綜上可見,鋰錳氧化物離子篩中摻雜一定量的鈦,可有效降低錳的溶損率,最佳摻雜比例是n(Ti)∶n(Mn)為0.06。
3.4 酸浸洗脫時間對離子篩性能的影響
考察離子篩在酸浸洗脫過程中,酸浸時間對Li+的溶出率和離子篩的錳和鈦溶損率的影響,如圖4所示。
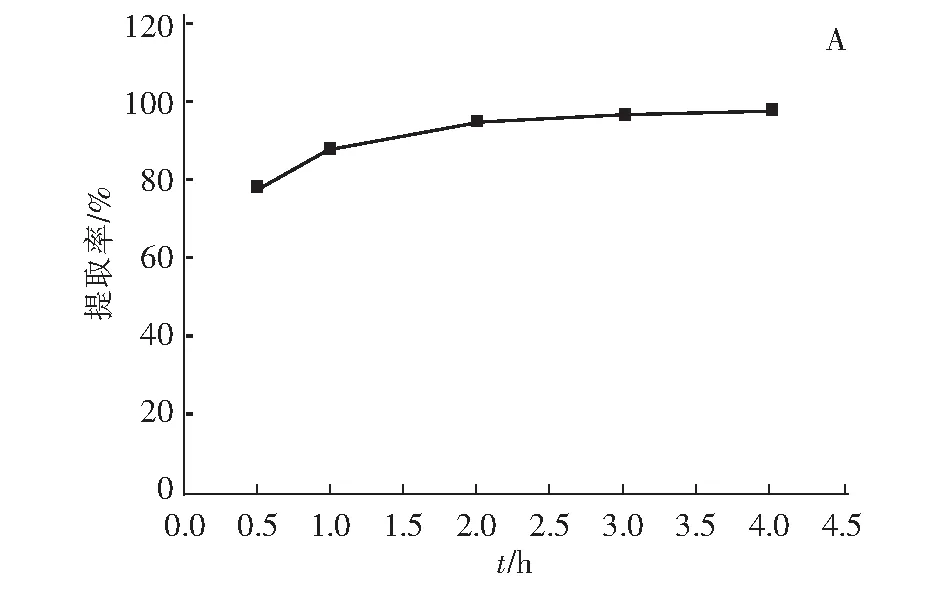
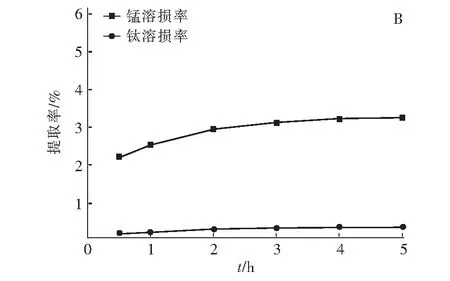
圖4 Li+的溶出率(A)、鈦和錳溶損率(B)與酸浸時間的關系Fig.4 The relationship between the dissolution rate of Li+(A), titanium and manganese(B) and acid leaching time
從圖4(A)可以看出,在酸浸2 h后鋰的溶出率已達到95%左右,隨著酸浸時間的延長,鋰的溶出率趨于穩定。從圖4(B)可以看出,酸浸2 h后,錳溶損率和鈦溶損率分別為3.0%和0.35%,隨著酸浸時間的延長,鈦的溶損率趨于穩定,錳的溶損率略有提高。由此可知,當酸浸時間為2 h時,具有相對最佳的鋰溶出率、鈦和錳的溶損率,可視為最佳的酸浸洗脫時間。
3.5 鈦摻雜鋰錳氧化物離子篩對不同離子的選擇吸附性能
分別取離子篩質量W=1.0 g放入體積V=1 L配制初始濃度C0=0.04 mol/L的Li+、Mg2+、Na+、K+溶液進行吸附實驗,檢測達到平衡后的濃度Ce,檢測飽和吸附量Qe,計算分配系數Kd,如表1所示。分配系數Kd=(C0-Ce)·V/(Ce·W)。

表1 對四種不同離子的吸附測試數據Tab.1 Adsorption test data for four different ions
由表1可以看出,鈦摻雜的鋰錳氧化物離子篩對相同濃度的Li+、Mg2+、Na+、K+四種離子的飽和吸附量可知對Li+具有最大的飽和吸附量。計算的四種離子Li+、Mg2+、Na+、K+的分配系數可知Li+>Mg2+>Na+>K+,由此可以看出鈦摻雜的鋰錳氧化物離子篩對Li+具有最優的選擇吸附性。
4 結論
1)采用共沉淀—水熱合成法制備出鈦摻雜的尖晶石型錳氧化物鋰離子篩。與未摻雜的鋰錳氧化物離子篩相比,少量鈦摻雜未改變其微觀形貌和物相結構。
2)對鋰錳氧化物離子篩中進行有效的鈦摻雜可降低洗脫過程中錳的溶損率。當摻雜比例為n(Ti) ∶n(Mn)=0.06,鈦摻雜的錳氧化物鋰離子篩具有最佳的吸附量(25.8 mg/g)。
3)當酸浸洗脫時間為2 h時,鈦摻雜錳氧化物鋰離子篩具有相對最佳的鋰溶出率、錳的溶損率和鈦的溶損率。
4)對于相同濃度的Li+、Mg2+、Na+、K+四種離子來說,鈦摻雜的鋰錳氧化物離子篩對Li+具有最優的選擇吸附性能,對Li+的最大飽和吸附量為19.65 mg/g和最佳分配系數可達2 352.90 mL/g。

