3種冷季型草坪草對四氯乙烯脅迫的抗性響應
晉 松, 金 杰, 吳 克
(合肥學院 生物與環境工程系 安徽省環境污染防治與生態修復協同創新中心, 合肥 230601)
四氯乙烯(Tetrachloroethylene,PCE,又名全氯乙烯),是一種常見的氯代烴類衍生物,因其具有優良的溶解力、良好的洗滌效果和優良熱穩定性等特點,被用作干洗劑、金屬脫脂溶劑、脫硫劑及有機合成中間體等[1-2],在精密機械、微電子、制藥、干洗、農藥等領域得到廣泛應用。自實現工業化生產以來,PCE的生產能力得到發展,截至2016年8月份,四氯乙烯全球年產量約70萬t,我國總產能約30.2萬t;其中約有10%~15%通過廢水進入土壤、地表水及地下水底層和包氣帶中形成羽狀污染帶[3-4],是地下水體中檢出率最高的有機污染物[5],其污染范圍已擴展到全球[6-7]。PCE易被人體和動物表皮、黏膜吸收[8],長期吸入該物質可產生致癌效應[9],因而被各個國家或地區普遍列入“優先控制污染物”中首要監控對象,對PCE污染水體和土壤的生態修復正逐步成為全球有機污染物環境研究的熱點。
目前,PCE污染的毒理研究主要集中于動物和人體[10-11],對植物的毒理效應研究尚處于起步階段,且多限于大豆、小麥等經濟作物,但實際受PCE直接影響的植物應多以野生地表植被為主。同時,采用植物修復法對PCE污染的水體和土壤進行生態恢復還具有成本低、侵入性低、促進碳隔離和環境穩定等優點,易于為大眾所接收。因此,本文選取高羊茅(Festucaelata)、黑麥草(Loliumperenne)、鴨茅(Dactylisglomerata)這3種耐旱、休眠期短、根系發達,且于自然生態環境和人工造景中均普遍栽培的冷季型草坪草為供試物種,通過模擬室內水培環境,研究水體中PCE污染對植物種子萌發、幼苗生理影響,以及對植株體內活性氧清除系統的毒理效應,從而篩選出對PCE敏感性和抗逆性較強的植株,以期為今后深入探討地表植被對PCE毒害的植物修復機制及指示生物角色等研究提供理論依據。
1 材料與方法
1.1 試驗材料與設計
供試植物:高羊茅(貝克Pixie)、黑麥草(啟明星 Morningstar)、鴨茅(阿索斯 Athos),購于安徽省畜牧技術推廣總站草業中心。供試溶液采用Hoagland營養液。
選取飽滿種子,以0.2%雙氧水浸泡15 min消毒,后蒸餾水淋洗、濾紙吸干。預處理后,將每品種50粒種子放于鋪墊2層濾紙的培養皿中。通過半致死試驗確定濃度范圍,以Hoagland營養液為稀釋液、10%乙醇為助溶劑,一次性施入PCE,配置成濃度梯度分別為4、8、12、16和20 mg/L的溶液,以原液為對照(CK)。將培養皿置于25 ℃±1 ℃環境下,設置光強不低于40 μmol/m2·s,每日光照15 h培養,濾紙保持濕潤。設置6個PCE濃度梯度及3個草坪草品種處理的正交試驗,每處理3個重復。
1.2 測試指標及方法
1.2.1 種子萌發情況測定
種子萌發24 h后,分別于第4天、第7天統計其發芽勢、發芽率,連續20 h觀察記錄其發芽情況,直至對照組發芽率不再變化為止并計算發芽指數。
發芽勢(%)=4 d發芽種子數/供試種子總數×100%
發芽率(%)=7 d發芽種子數/供試種子總數×100%
發芽指數Gi=Σ(Gt/Dt)
Gi為發芽指數,Gt為t時間內的發芽數,Dt為相應的發芽天數。
1.2.2 幼苗生理指標測定
20 d后,以電導儀(DDS-11D型)測得電導率,以相對電導率表征細胞膜透性。采用硫代巴比妥酸法測定MDA含量[12](μmol/g·FW) ;采用酸性茚三酮法測定脯氨酸含量(μg/g·FW) 。
1.2.3 幼苗葉片抗氧化酶活性測定
分別采用南京建成生物工程研究所出售的超氧化物歧化酶(SOD)、過氧化氫酶(CAT)、過氧化物酶(POD)活性測定試劑盒進行測定,測試方法分別為黃嘌呤氧化酶法、比色法及可見光法。酶活性單位以U/g·min(FW)表示。
1.3 數據分析
數據分析采用SPSS13.0統計軟件,用平均值和標準誤表示測定結果;對同一品種草坪不同PCE濃度處理進行組間差異顯著性分析(P<0.05,P<0.01,采用One-Way ANOVA過程) 和多重比較(采用SNK-q檢驗法)、Pearson相關系數計算。
2 結果與分析
2.1 PCE對草坪草種子萌發的影響
梯度濃度PCE處理下,3種草坪草種子的萌發狀況存在明顯差異(表1)。高羊茅種子萌發狀況較對照組無顯著差異,發芽率、發芽勢、發芽指數與PCE處理間相關系數分別為-0.59、-0.69、-0.74,無顯著相關性。
PCE處理下鴨茅、黑麥草種子發芽率、發芽指數持續受抑,但低濃度PCE(0~8 mg/L) 對鴨茅種子發芽勢有輕微促進作用。當PCE濃度達20 mg/L時,鴨茅、黑麥草種子發芽率分別較之對照組降低51.4%、31.5%。鴨茅種子發芽勢、發芽率、發芽指數與PCE處理間相關系數分別是-0.81(P<0.01)、-0.96(P<0.05)、-0.86(P<0.05);黑麥草種子發芽勢、發芽率、發芽指數與PCE處理間相關系數分別為-0.87、-0.85、-0.73,均呈現顯著相關性(P<0.05)。
2.2 PCE對草坪草幼苗葉片細胞膜透性的影響
由圖1可知,3種供試草坪草幼苗葉片的電導率隨PCE濃度的遞增呈持續升高趨勢。在PCE最高濃度下,高羊茅、黑麥草、鴨茅葉片電導率分別為對照組的2.95倍、5.16倍、4.62倍,與PCE處理的相關系數分別為0.98、0.95、0.95,均呈極顯著正相關(P<0.01)。

表1 PCE對草坪草種子萌發的影響(平均數±標準誤)
注:不同小寫字母表示不同PCE濃度處理組間差異顯著(P<0.05);下同
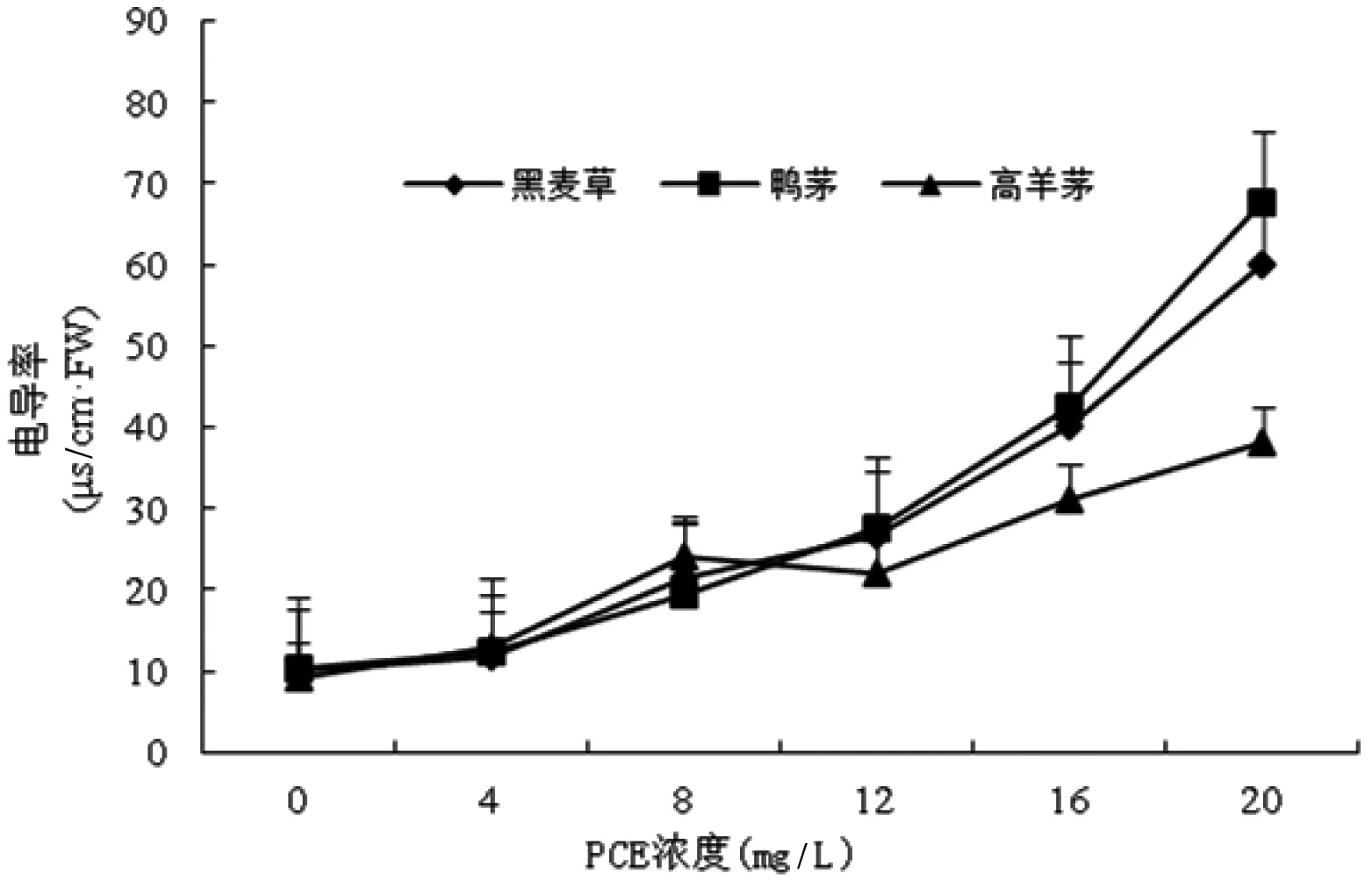
圖1PCE對草坪草幼苗葉片細胞膜透性的影響
Figure 1 Effects of PCE on CMP in leaf of turfgrass seedling
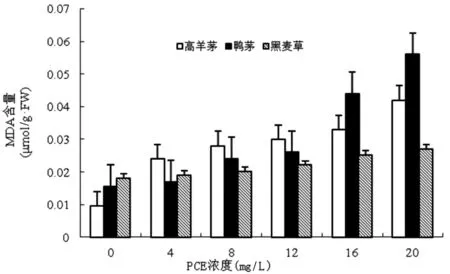
圖2 PCE對草坪草葉片MDA含量的影響
2.3 PCE對草坪草幼苗葉片MDA含量的影響
如圖2所示,隨著PCE濃度的增加,3種草坪草幼苗葉片的MDA含量逐漸上升,當PCE濃度為20 mg/L時,高羊茅、鴨茅、黑麥草葉片MDA比之對照組分別增長了4.44倍、3.82倍。而黑麥草葉片MDA含量受PCE濃度影響不大,其峰值僅比對照組增加了14%。高羊茅、鴨茅、黑麥草的MDA含量與PCE處理間相關系數分別為0.95、0.92、0.94,呈極顯著正相關(P<0.01)。
2.4 PCE對草坪草葉片幼苗脯氨酸含量的影響
PCE處理下,3種草坪草幼苗葉片脯氨酸含量具有顯著差異(圖3)。低濃度PCE(0~8 mg/L)影響下,高羊茅葉片脯氨酸含量減少,至PCE濃度為8 mg/L時降至最低,較對照組減少46.91%。而后隨著PCE濃度的繼續升高(8~20 mg/L),脯氨酸在葉片中逐漸累積,并在較高濃度PCE(16~20 mg/L)影響下急劇增長,最高值較對照組高出1.72倍,高羊茅脯氨酸含量與PCE處理間相關系數為0.82(P<0.05)。
鴨茅、黑麥草葉片的脯氨酸含量隨著PCE濃度的增加而呈持續升高的趨勢,當PCE濃度為20 mg/L時達到最高值,其峰值分別為對照組的4.07倍、5.61倍,鴨茅、黑麥草脯氨酸含量與PCE處理間相關系數分別為0.97(P<0.01)、0.95(P<0.01)。
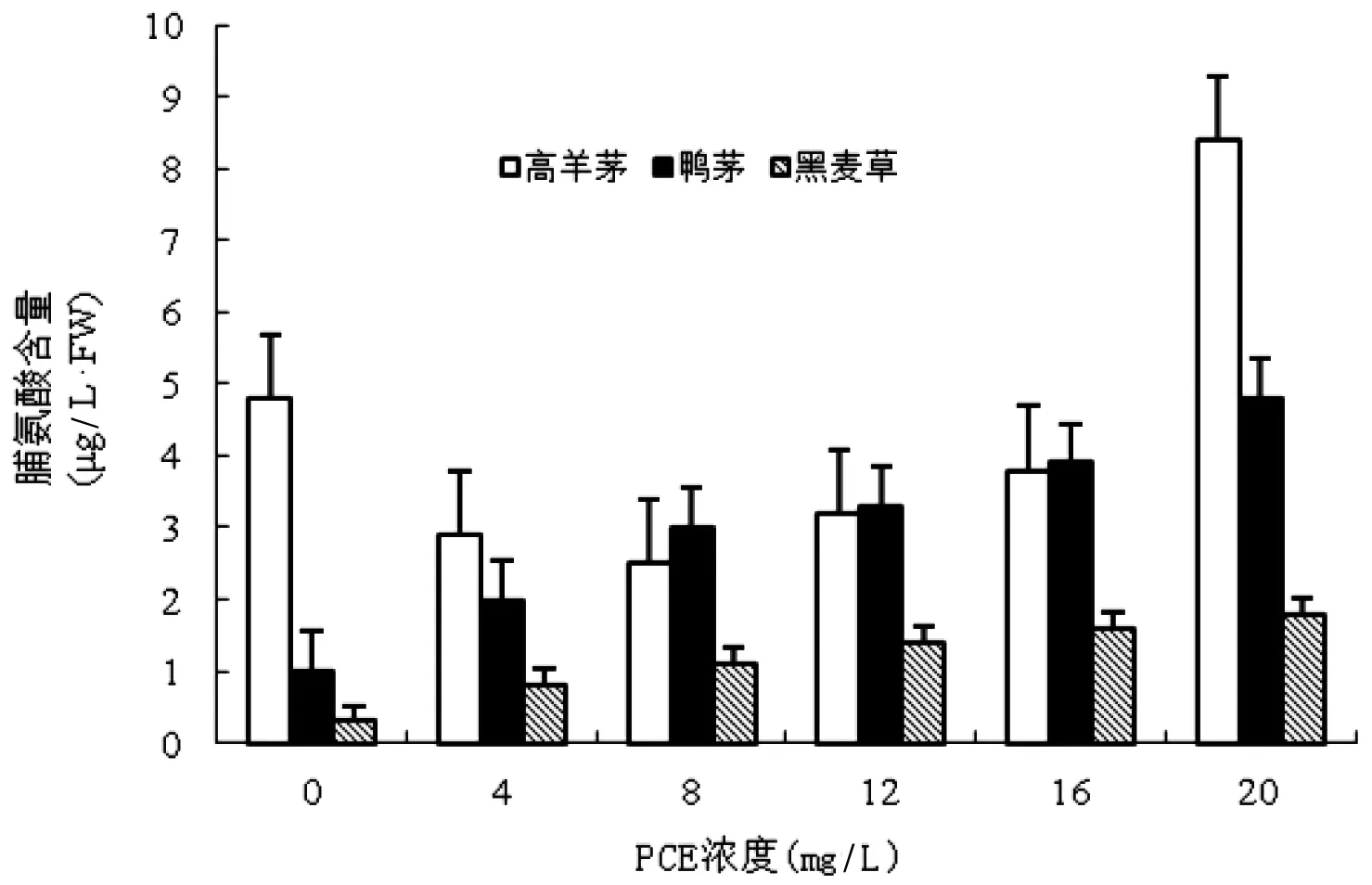
圖3 PCE對草坪草葉片脯氨酸含量的影響
2.5 PCE對草坪草幼苗葉片抗氧化酶的影響
2.5.1 PCE對幼苗葉片SOD活性的影響
在梯度濃度PCE脅迫下,3種供試植株幼苗體內SOD活性變化趨于一致(圖4)。低濃度PCE(0~8 mg/L)誘使黑麥草、鴨茅葉片SOD活性略有上升,當PCE濃度為8 mg/L時兩種植株SOD的活性峰值較CK分別增長了56.3%、72.9%。當PCE為20 mg/L SOD活性最低,此時鴨茅、黑麥草葉片的SOD活性分別為CK的73.6%、50.7%。PCE對鴨茅、黑麥草葉片的SOD活性抑制率分別為26.4%和49.3%。
高羊茅葉片SOD活性抗性高峰出現在較高濃度的PCE處理組中(12 mg/L),此時SOD峰值較對照組增長了68.5%。之后,當PCE繼續升高至濃度為20 mg/L,高羊茅葉片SOD活性仍較對照組高出17.6%。高羊茅、鴨茅、黑麥草葉片的SOD活性與PCE處理間相關系數分別為-0.841(P<0.05),-0.965(P<0.01),-0.954(P<0.01)。

圖4 PCE對3種草坪草的葉片SOD活性的影響
2.5.2 PCE對幼苗葉片CAT活性的影響
在PCE處理下,3種供試植株幼苗葉片CAT活性均先上升繼而下降;較低濃度PCE處理(高羊茅<12 mg/L,鴨茅、黑麥草<8 mg/L)對葉片的CAT活性具有誘導作用(圖5)。高羊茅葉片CAT活性于PCE 12 mg/L時呈現抗性峰。高羊茅、鴨茅、黑麥草最高CAT活性分別為對照組的1.94倍、3.15倍、4.41倍。較高濃度PCE(高羊茅>12 mg/L,鴨茅、黑麥草>8 mg/L)對葉片CAT活性具抑制效應。高羊茅、鴨茅、黑麥草葉片的CAT活性在PCE影響下抑制率分別為15.3%、14.7%、27.9%,與PCE處理間的相關系數分別為-0.710,-0.977(P<0.01),-0.886(P<0.01)。
2.5.3 PCE對幼苗葉片POD活性的影響
由圖6可知,低濃度PCE處理下(0~8 mg/L),高羊茅、黑麥草和鴨茅葉片中POD活性均隨PCE濃度的遞增呈上升趨勢,說明低濃度的PCE可以促進高羊茅幼苗的生長,高羊茅、黑麥草和鴨茅葉片POD活性的峰值分別較對照組上升了34.9%、25.3%、53.6%。隨PCE濃度繼續升高,3種草葉片POD活性則逐漸下降。高羊茅、黑麥草和鴨茅葉片POD活性與PCE處理之間的相關系數為-0.852(P<0.05)、-0.572、-0.653,高羊茅葉片POD活性與PCE濃度之間呈顯著負相關,黑麥草和鴨茅葉片POD活性與PCE濃度之間無顯著相關性。
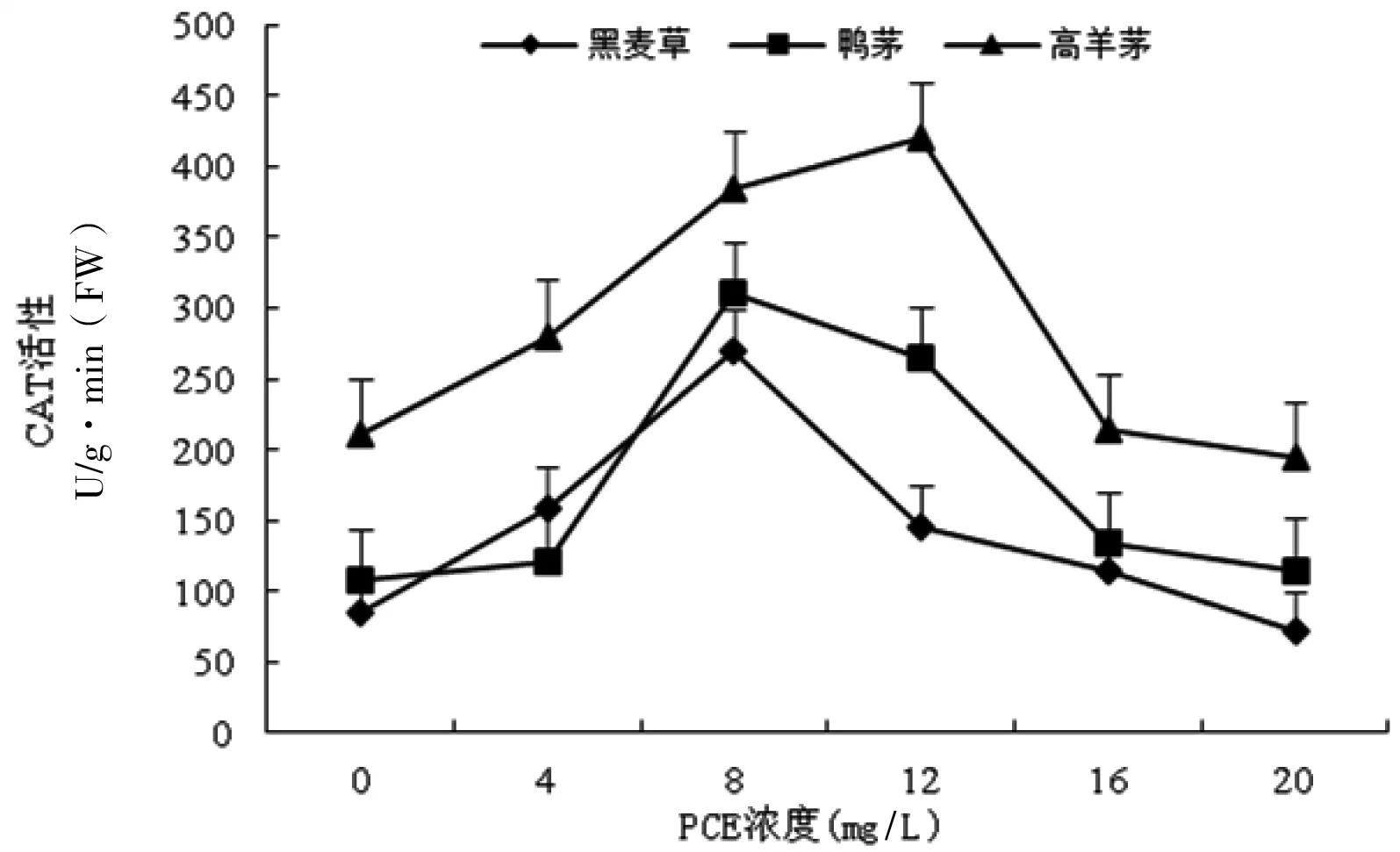
圖5 PCE對草坪草葉片CAT活性的影響
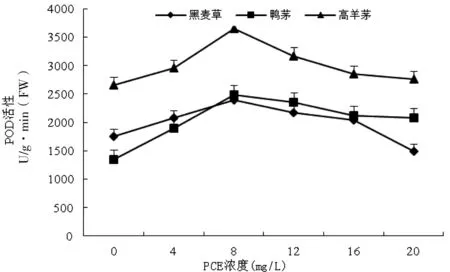
圖6 PCE對3種草坪草POD活性的影響
3 討論
較植株成體而言,種子萌發和幼苗生長階段對外界環境不利因素更為敏感[13]。本試驗結果顯示,PCE處理對高羊茅種子萌發不構成劑量效應;鴨茅、黑麥草種子萌發雖均呈受抑趨勢,但相同PCE濃度下(0~8 mg/L)黑麥草種子的劣變程度高于鴨茅。因此,高羊茅種子萌發對PCE脅迫具有抗性,黑麥草表現出敏感性。
MDA是細胞膜脂過氧化作用的重要產物,其含量指示膜脂過氧化程度。在較低PCE濃度下(0~12 mg/L),PCE對高羊茅的質膜損傷較小,黑麥草與鴨茅細胞質膜抗性較差。高濃度PCE(16~20 mg/L)脅迫下高羊茅的細胞膜脂質過氧化作用最強。
生物細胞對膜脂過氧化的主要應對策略是調整滲透勢平衡,其中,脯氨酸就是一類具代表性的滲透調節物質,對穩定生物大分子結構、清除過量活性氧自由基及減輕膜脂過氧化反應等具有重要意義[14]。本試驗中,鴨茅、黑麥草葉片的脯氨酸含量在外加PCE后立即進行累積,高羊茅則先抑制繼而累積;高羊茅葉片脯氨酸含量最高、黑麥草最低。該結論證實,脯氨酸累積是植株對PCE毒害的應激響應,PCE抗性強的品種可積累較多的脯氨酸,因此,脯氨酸含量可作為衡量植物對PCE脅迫進行適應性代謝調整的生理指標,這與張義賢[15]和Metha[16]等人的研究成果一致。
SOD、POD、CAT等酶活性之間的動態平衡是維持超氧自由基和H2O2穩態水平的關鍵[17]。本研究中,低濃度PCE脅迫下的植株細胞能夠提高酶活性,但在更高濃度PCE或更長時間脅迫下,草坪草葉片細胞無法通過提高抗氧化酶活力來消除脅迫產生的氧化壓力,導致活性氧過量積累,對蛋白質、脂類、核酸等生物大分子造成氧化損傷,引發活性氧過量累積[18-19]。結合電導率、MDA和脯氨酸的變化趨勢,本研究進一步證實,逆境條件能夠通過促使活性氧生成增多,或抗氧化酶清除能力減弱[20]。此外,SOD作為活性氧清除的首要位點[21],而POD作為敏感性較高的適應性酶,兩者都能夠更好地反映植物體內代謝水平及對外界環境的適應性[22]。
在各組PCE處理中,高羊茅SOD、CAT活性的抗性峰出現均遲于鴨茅和黑麥草,且SOD、POD活性基本持續高于鴨茅和黑麥草,亦證實高羊茅葉片抗氧化酶系統的平衡閾值高于鴨茅、黑麥草,對PCE脅迫的抗逆性優于其他兩種草坪草;鴨茅的活性氧清除系統最敏感。3種草坪草對PCE濃度的抗性順序從高到低依次為高羊茅、鴨茅、黑麥草。
4 結論
1) PCE處理(0~20 mg/L)對高羊茅種子萌發無顯著劑量-效應關系,3種草坪草種子萌發對PCE脅迫的抗性從高到低依次為高羊茅、鴨茅、黑麥草。
2) PCE處理下,植株葉片脯氨酸含量大量積累,積累效率與對PCE的抗性大小成正比,其含量可以作為衡量植物對PCE脅迫抗性強弱的生理指標。
3) 綜上,高羊茅對于PCE脅迫的抗逆性優于鴨茅和黑麥草,黑麥草對PCE脅迫最敏感。因此,高羊茅可作為PCE污染地區生態修復的地面植被,而黑麥草對PCE的土壤和地下室污染具有生物指示意義。

