三疣梭子蟹PtCrustin2抗菌肽基因優化及其在畢赤酵母中高效表達
王艷慧, 陶 妍
(上海海洋大學 食品學院 上海水產品加工及貯藏工程技術研究中心, 上海 201306)
目前,抗生素在生物機體內的殘留問題及微生物耐藥性問題已經成為醫學和環境科學界面臨的重大挑戰,因此,研究和開發能夠替代傳統抗生素的天然生物類抗菌劑勢在必行,由此開展的抗菌肽方面的研究也應運而生。抗菌肽廣泛存在于生物體內,是一類具有廣譜抗菌活性的小分子多肽[1-2]。研究表明,水生動物由于其棲息環境不同于陸生動物而致使其體內擁有更為豐富的抗菌肽;尤其是水生動物中的甲殼類動物,雖然其體內缺乏具有“記憶效應”的特異性免疫機制,但仍然能抵御各種病原微生物的侵染,由此可以推斷它們主要是依賴自身先天性非特異性免疫系統中存在的諸多免疫因子[3],而抗菌肽則是防御細菌、真菌和病毒等病原微生物入侵的最重要分子屏障[4-6]。
Crustin是甲殼類動物來源的一系列富含半胱氨酸的小分子抗菌肽;除去N端信號肽序列后的肽段被稱為成熟肽,8個高度保守的半胱氨酸殘基位于成熟肽區域中,可形成由4個二硫鍵聯接的WAP結構域;成熟肽賦予了crustin的生物學功能[7]。最初從普通濱蟹(Carcinusmaenas)的血淋巴中分離到的I型crustin具有抑制部分革蘭氏陽性菌的活性[8];之后發現在三疣梭子蟹(Portunustrituberculatus)的血細胞和眼柄中存在3種I型crustin的同工型基因(PtCrustin1、PtCrustin2、PtCrustin3),通過大腸桿菌原核表達系統對其中的PtCrustin2基因進行重組表達后,發現重組體PtCrustin2具有抑制金黃色葡萄球菌(Staphylococcusaureus)和銅綠假單胞菌(Pseudomonasaeruginosa)的生物學活性[9]。眾所周知,大腸桿菌表達系統沒有真核翻譯后加工的功能,難以形成正確的二硫鍵配對和空間構像折疊,因而產生的蛋白質經常是不溶的,會在細菌內聚集成包涵體而沒有足夠的生物學活性[10-11]。有鑒于此,近幾年來我們開展了基于畢赤酵母真核表達系統的各種水產生物來源抗菌肽的重組DNA表達[12-15];就三疣梭子蟹PtCrustin2的真核表達而言,在先前的研究中,通過RT-PCR獲得編碼其成熟肽的天然cDNA,以pPIC9K為表達載體、畢赤酵母GS115為工程菌,初步實現了PtCrustin2的重組DNA 表達[16]。然而,因使用的表達載體為pPIC9K,目的片段5′端所添加的限制性內切酶位點為EcoR I,導致表達的重組體PtCrustin2 帶有非天然的N末端;另一方面,由于使用的編碼PtCrustin2成熟肽的基因為天然cDNA,對于畢赤酵母來說可能存在某些密碼子的限制,所以導致了較低的表達量。
本研究在前期研究的基礎上,根據畢赤酵母的密碼子偏愛性對編碼三疣梭子蟹PtCrustin2成熟肽的天然cDNA進行密碼子優化并合成,選擇pPICZαA替代pPIC9K作為表達載體、畢赤酵母X-33為工程菌,以期提高重組體目的蛋白的表達量,為進一步擴大制備重組體PtCrustin2及深入研究其抑菌機理奠定基礎。
1 材料與方法
1.1 載體、菌種和試劑
表達載體pPICZαA、畢赤酵母X-33和博來霉素由Invitrogen公司(美國)提供;克隆載體pMD-19T simple、限制性內切酶(XhoⅠ、XbaⅠ、SacⅠ)和T4 DNA連接酶由Takara公司(日本)提供;大腸桿菌DH5α來源于本實驗室;PCR反應試劑、DNA回收試劑盒、質粒小提試劑盒、DNA分子量Marker、蛋白質分子量Marker和酵母基因組提取試劑盒均由天根生化科技有限公司(北京)提供;抗His標簽鼠單克隆抗體和辣根過氧化物酶標記山羊抗小鼠IgG (H+L)由北京康為世紀生物科技公司提供;低鹽LB培養基、YPDS平板、MD平板、MM平板、BMG和BMM培養基均按照Invitrogen公司的說明書配制。
1.2 smPtCrustin2基因的優化合成
根據已經登錄(GenBank:JQ728435)的三疣梭子蟹PtCrustin2的cDNA序列,參考酵母的密碼子偏愛性,使用JAVA Codon Adaption Tool(http://www.jcat.de/Start.jsp),對編碼PtCrustin2成熟肽的相關密碼子進行優化,由上海生工生物工程有限公司合成目的基因smPtCrustin2,在該目的基因的5′端依次添加Kex2信號肽酶切位點和XhoI酶切位點,在其3′端依次添加6×his標簽和XbaI酶切位點。DNA測序委托上海生工生物工程有限公司完成。
1.3 構建pPICZαA-smPtCrustin2及其鑒定
合成的目的基因以重組質粒(pUCk-smPtCrustin2)的形式存在于大腸桿菌DH5α中;質粒經純化后,對pUCk-smPtCrustin2進行XhoI和XbaI的雙酶切;目的片段經回收后與pPICZαA(經同樣酶切割過)混合(1∶ 4,V/V),于16 ℃經T4DNA連接酶作用16 h;轉化大腸桿菌DH5α后在低鹽LB培養基中37 ℃培養12 h。通過XhoI和XbaI雙酶切驗證、菌落PCR和DNA測序驗證重組表達載體pPICZαA-smPtCrustin。
1.4 轉化畢赤酵母X-33及陽性酵母轉化子的篩選
經SacI線性化處理后的pPICZαA-smPtCrustin2與畢赤酵母X-33感受態細胞混合(1∶ 8,V/V),在0.2 cm電轉杯中的電轉條件如下:25 μF、200 Ω、1.5 kV;加入1 mL山梨醇(1 mol/L);于30 ℃放置2 h后離心,菌體涂于含100 μg/mL博來霉素的YPDS平板上,在30 ℃避光培養至單克隆產生;挑取單菌落分別轉接至MM及MD平板上,篩選高拷貝甲醇利用快速型酵母轉化子;同時將線性pPICZαA空載體電轉入畢赤酵母X-33中作為陰性對照。以篩選到的轉化子的基因組DNA為模板,用pPICZαA載體上的醇氧化酶基因的引物5′AOX1和3′AOX1進行PCR以鑒定陽性轉化子。
1.5 在畢赤酵母X-33中誘導表達目的蛋白及其表達產物的純化
將含pPICZαA-smPtCrustin2的陽性酵母轉化子于BMG培養基中培養至OD600為4~5(30 ℃、250 r/min);對其進行離心后,收集的菌體接種于BMM培養基,在28 ℃、250 r/min條件下使用0.5%甲醇誘導培養96 h,保持甲醇體積為0.5%;培養液經離心后,使用0.22 μm濾膜對上清進行過濾,通過固化金屬離子親和層析(IMAC)分離純化重組蛋白,經福林-酚法測定純化產物的濃度,并估算表達量。Tricine-SDS-PAGE條件:4%濃縮膠、10%夾層膠、15.5%分離膠。
1.6 重組體smPtCrustin2的Western Blot分析
經Tricine-SDS-PAGE后的凝膠上的條帶在100 V電壓下,經過1.5 h電轉至PVDF膜上,用TBST洗膜3次(每次10 min),將膜浸于封閉液中1 h;再用TBST洗膜3次(每次10 min),先與鼠單克隆抗體室溫下培育2 h,用TBST洗去剩余抗體;再與辣根過氧化物酶標記的山羊抗小鼠IgG (H+L) 室溫下培育1 h,用TBST漂洗后使用DAB試劑盒進行顯色。
2 結果與分析
2.1 優化前后的PtCrustin2成熟肽基因比較
如圖1所示,優化后的smPtCrustin2分子量為270 bp,除去XbaI、XhoI、終止密碼子、6×his標簽和Kex2酶切位點,編碼了由77個氨基酸殘基組成的PtCrustin2成熟肽;在不改變氨基酸殘基的前提下,半胱氨酸、脯氨酸、谷氨酸、賴氨酸、天冬氨酸等15個殘基的密碼子被修改。與天然cDNA“mPtCrustin2”相比,其5′端添加的XhoI酶切位點和Kex2信號肽酶切位點預示了表達的重組體smPtCrustin2含天然N末端。
2.2 基于菌落PCR和雙酶切的重組表達載體pPICZαA-smPtCrustin2的鑒定
構建的重組表達載體pPICZαA-smPtCrustin2如圖2所示。首先,采用pPICZαA的通用引物5′AOX1和3′AOX1對含pPICZαA-smPtCrustin2的大腸桿菌進行菌落PCR鑒定,結果如圖3-a所示,1個約743 bp的理論分子量條帶非常明顯。另外,采用XhoI和XbaI對純化的pPICZαA-smPtCrustin2進行雙酶切鑒定,電泳結果顯示了1個與smPtCrustin2的理論分子量(270 bp)相符的條帶,而另一個在近10 000 bp處的條帶屬于pPICZαA(圖3-b)。此外,對pPICZαA-smPtCrustin2的DNA測序結果也證明了pPICZαA與smPtCrustin2連接正確。

*為終止密碼子;下劃線為Kex2信號肽酶切位點;斜體為限制性酶切位點;方框為6×his標簽;陰影為半胱氨酸殘基
圖1密碼子優化前后的PtCrustin2成熟肽基因的比較
Figure 1 Comparison of mPtCrustin2 optimized and un-optimized for codons
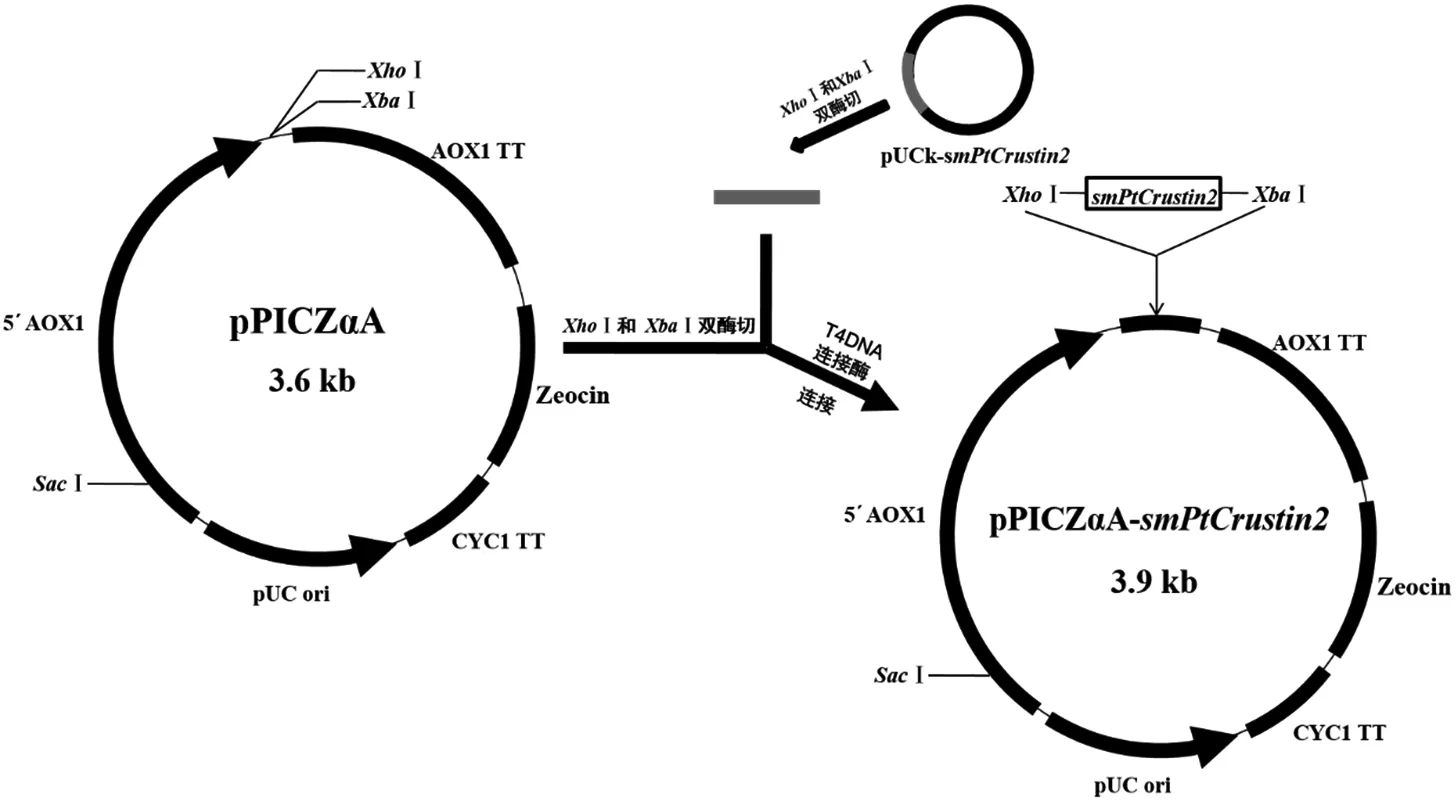
圖2 pPICZαA-smPtCrustin2重組表達載體的構建
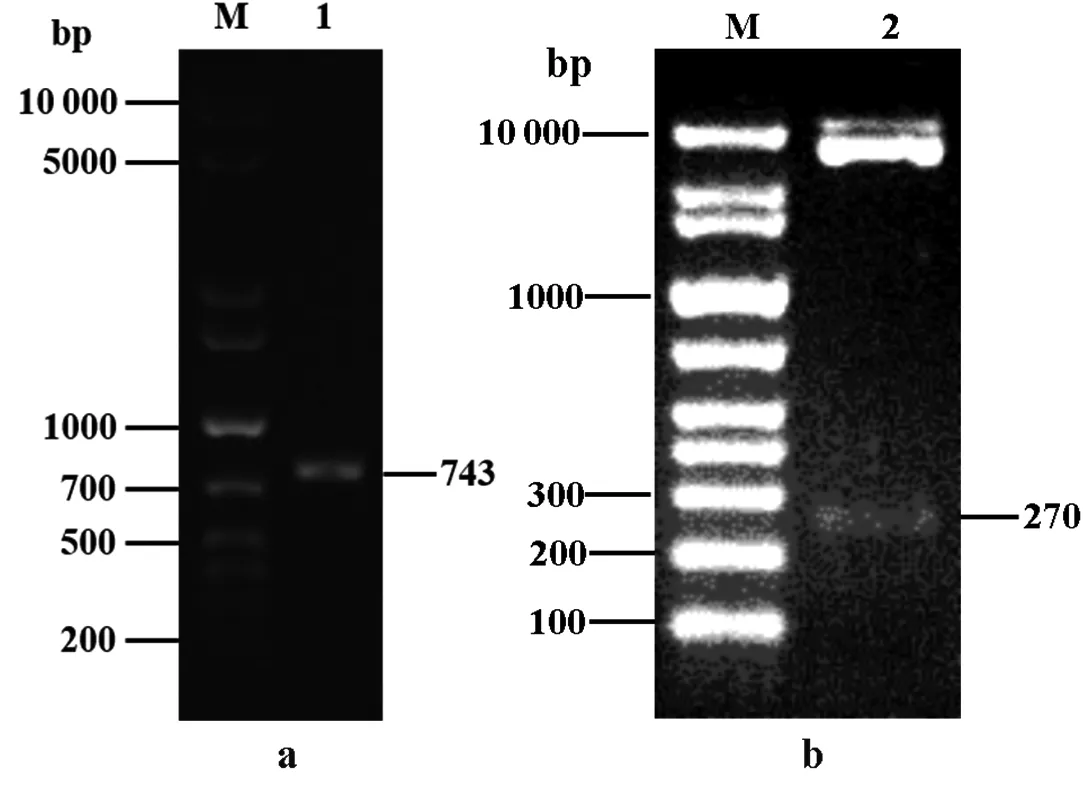
M:DNA 分子量Marker;1:PCR擴增產物;2:酶切產物
圖3基于菌落PCR(a)和雙酶切(b)的pPICZαA-smPtCrustin2鑒定
Figure 3 Identification of pPICZαA-smPtCrustin2 by colony PCR (a) and endonuclease digestion (b)
2.3 酵母轉化子的鑒定
通過含100 μg/mL博來霉素的YPDS平板篩選和MM及MD平板篩選,共獲得6株高拷貝酵母轉化子;經培養并提取基因組DNA為模板,以上述的5′ AOX1和3′-AOX1為引物進行PCR驗證,同時以含pPICZαA空載體的酵母轉化子作為陰性對照。PCR結果如圖4所示,1~6號泳道均顯示了與理論分子量相符的約743 bp的條帶;另一個由7號泳道顯示的約493 bp的條帶符合陰性對照的理論分子量,據此,可以證明pPICZαA-smPtCrustin2與畢赤酵母基因組DNA已成功整合。
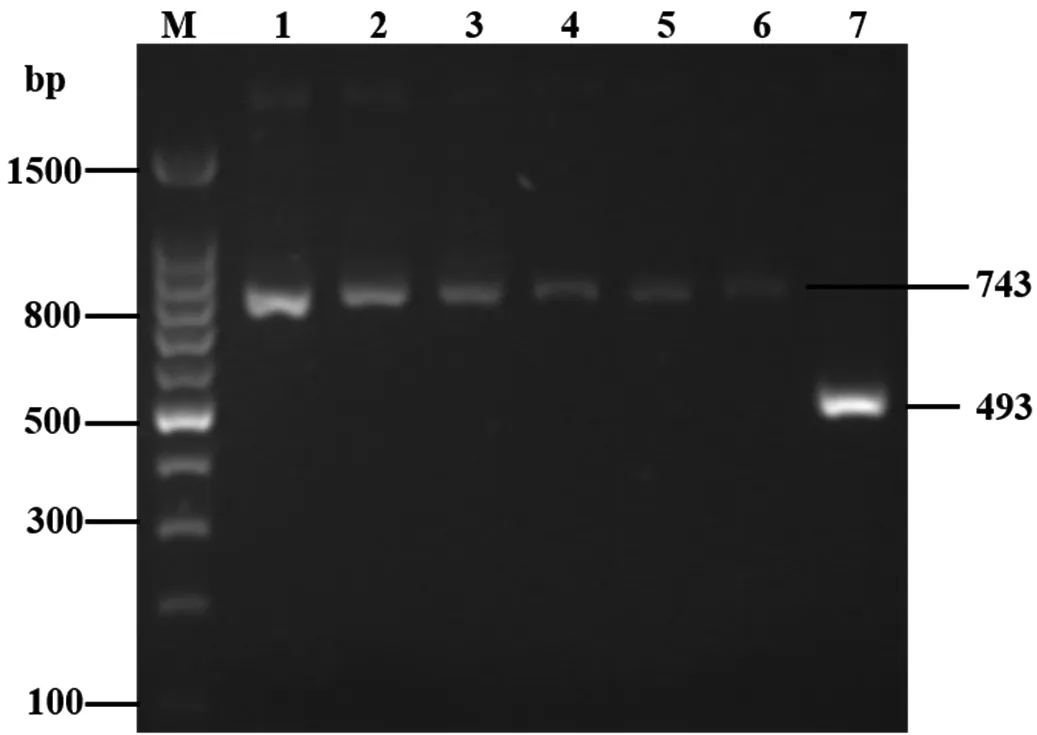
M:DNA 分子量Marker;1~6:含有pPICZαA-smPtCrustin2的轉化子;7:含有pPICZαA的轉化子
圖4基于PCR的陽性酵母轉化子的鑒定
Figure 4 Identification of positive yeast transformants by PCR
2.4 基于甲醇誘導表達的重組體smPtCrustin2及其純化
在BMM培養基中于28 ℃、250 r/min條件下,對篩選到的高拷貝甲醇利用快速型酵母轉化子進行96 h的0.5%甲醇誘導培養;對培養液進行IMAC法純化后,經Tricine-SDS-PAGE分析顯示(圖5):共有2條清晰明顯的條帶(1號泳道),小于14.4 ku的條帶應該為目的條帶,而在近20 ku處的條帶被推測是目的蛋白形成的二聚體。另一方面,含空載體的酵母轉化子的表達上清中并未出現任何明顯條帶(2號泳道),由此證明重組體smPtCrustin2被成功表達。通過福林-酚法測定的純化產物濃度為0.56 mg/mL,進一步推算至產量為22.4 mg/L。
2.5 基于Western Blot分析的重組體smPtCrustin2的鑒定
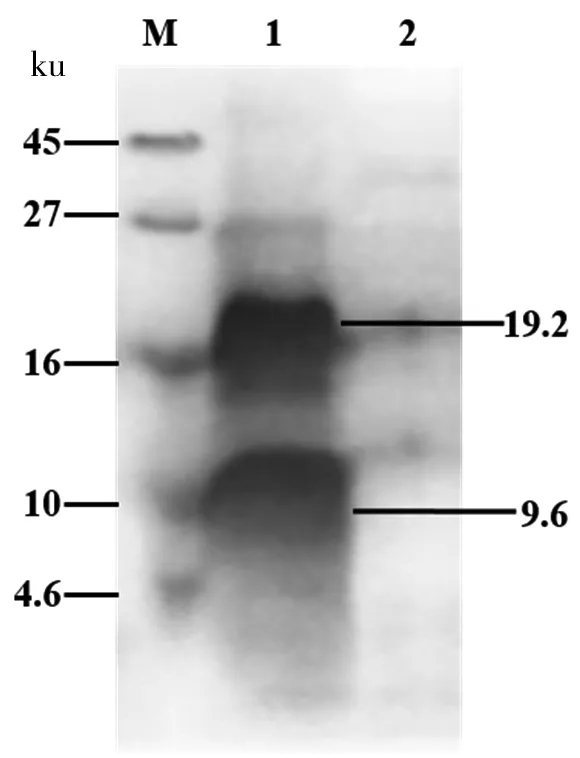
對上述純化產物進行Western Blot分析,因重組體smPtCrustin2的C端含6×his標簽,所以與鼠單克隆抗體(抗his標簽)能夠雜交。結果如圖6所示,1號泳道為純化產物,在約10 ku處的一個明顯雜交條帶應該屬于目的蛋白;而大于16 ku的另一個雜交條帶可能為目的蛋白的二聚體。2號泳道是含pPICZαA空載體的酵母轉化子的表達上清,未見任何明顯的雜交條帶。Western Blot分析的結果基本上與Tricine-SDS-PAGE分析的結果相符,由此證明通過本研究建立的畢赤酵母表達系統可以成功表達重組體目的蛋白。
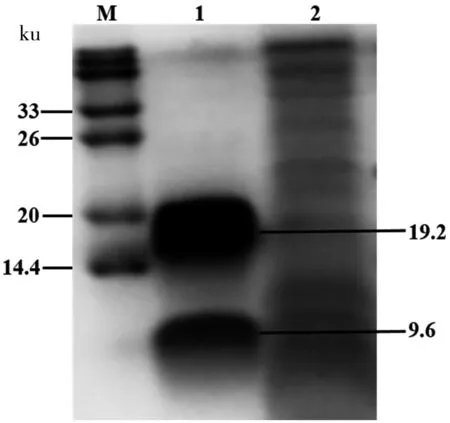
M:蛋白質分子量Marker;1:純化的smPtCrustin2;2:含pPICZαA空載體的酵母培養液上清
圖5純化的smPtCrustin2的Tricine-SDS-PAGE分析
Figure 5 The purified smPtCrustin2 was analyzed by tricine-SDS-PAGE
M:蛋白質分子量Marker;1:純化的smPtCrustin2;2:含pPICZαA空載體的酵母培養液上清
圖6純化的smPtCrustin2的WesternBlot分析
Figure 6 The purified smPtCrustin2 was analyzed by Western Blot
3 討論
三疣梭子蟹屬于無脊椎動物中的水產甲殼類動物,主要依靠血細胞吞噬和包囊化作用發揮其防御機能。它們雖然缺乏抗體介導的特異性免疫功能、不產生免疫球蛋白,但具有先天性的非特異性免疫系統,能夠識別和有效清除入侵的病原微生物[17]。由此可以推測,較脊椎動物而言,由甲殼動物免疫系統產生的免疫因子具有更為天然的優勢成為天然抗菌劑開發的良好候選者。我們在前期研究中,聚焦于三疣梭子蟹先天性免疫系統中的重要免疫因子PtCrustin2成熟肽,對其天然cDNA進行了克隆和實現了在畢赤酵母中的表達[16],然而,如前言中述及的因前期研究策略上存在弊端,表達效率很低。據此,本文通過3個方面對畢赤酵母表達系統進行了改進。
根據Yang等[18]的報道,他們對黑曲霉(Aspergillusniger)lip2基因的密碼子進行優化后在畢赤酵母細胞中的表達量和生物學活性分別提高了11.6和5.3倍;王方芹等[19]根據釀酒酵母的密碼子偏愛性優化了黑曲霉的α-L-鼠李糖苷酶基因rha,發現重組rha的表達量提高了2.9倍;我們最近報道的在畢赤酵母X-33中高效表達的斑馬魚重組β-防御素(zfDB3)的編碼基因中有28個密碼子也是被優化過的[20]。此外,楊剛剛等[21]通過對載體-宿主菌組合的改變,顯著提高了重組蛋白的表達量。有鑒于此,本文一方面參考畢赤酵母的密碼子偏愛性,對編碼三疣梭子蟹PtCrustin2成熟肽的天然cDNA進行檢測,對顯示低頻的53個密碼子進行了優化;另一方面,將之前使用的表達載體pPIC9K改為pPICZαA,因后者分子量較小,其長度僅為pPIC9K的1/3,使得轉化操作和染色體的整合相對更容易;此外,將宿主由原來的畢赤酵母GS115改為畢赤酵母X-33,因X-33屬野生型的酵母菌株,其對外源蛋白具有更強的分泌和適應能力[22]。本研究結果證明,上述的改進策略使重組體smPtCrustin2的表達量與之前未經密碼子優化的表達量(5.25 mg/mL)[16]相比,提高了4倍以上,達到了本研究的預期目的。通過對目的基因5′端進行XhoⅠ酶切位點和Kex2信號肽酶切位點的添加,確保了“重組體smPtCrustin2”在分泌表達至胞外時含有純粹的N末端。
4 結論
本研究通過使用經密碼子優化的三疣梭子蟹PtCrustin2成熟肽基因“smPtCrustin2”和構建重組表達載體pPICZαA-smPtCrustin2,在畢赤酵母X-33中,經0.5%甲醇誘導,在28 ℃、250 r/min條件下培養96 h,獲得含重組體smPtCrustin2的表達產物,經IMAC法得到純化的重組體smPtCrustin2,表達量為22.4 mg/L。

