人轉運蛋白SR2的原核表達及其與HIV-1整合酶體外相互作用的檢測
許曉雙, 張大為, 孔 韌
(江蘇理工學院 生物信息與醫藥工程研究所, 常州 213001)
HIV-1 整合酶(Integrase,IN)是HIV-1病毒復制過程中的關鍵酶,能夠介導逆轉錄后形成的病毒cDNA與宿主細胞基因組的整合,也是研究抗艾滋病藥物的重要靶標[1]。在已上市的藥物中,雷特格韋(Raltegravir,RAL)、埃替格韋(Elvitegravir,EVG)和度魯特韋(Dolutegravir,DTG)是IN催化位點抑制劑,其分子機制是結合于整合酶的催化活性口袋從而抑制整合酶的鏈轉移反應活性[2]。近年來,由于已上市藥物存在越來越嚴重的耐藥性問題,迫切需要進行基于新機制的抗艾滋病藥物研發。
HIV-1自身編碼的蛋白質數量有限,需要依賴宿主細胞蛋白及其信號通路完成自身復制。人轉運蛋白SR2(tansportin-SR2,TRN-SR2)是β-核素蛋白,是近年來發現的一種HIV-1整合酶輔助因子,主要參與HIV-1生命周期中整合前復合體PIC(pre-integration complex)核輸入過程,促進HIV感染。通過核孔蛋白復合物將HIV-1 PIC及病毒輔助蛋白運送到細胞核的過程稱為核輸入過程,是一個多因子參與的復雜過程[3]。HIV-1 PIC包括多種病毒的基質蛋白、IN、病毒蛋白R、cDNA以及多種細胞輔助因子,如晶狀體上皮細胞衍生生長因子(LEDGF /p75)、輸入蛋白α和轉運蛋白SR2[3]。因此,HIV-1核輸入過程主要依賴于PIC成分或單獨HIV-1蛋白與細胞核輸入因子之間的蛋白質-蛋白質相互作用[4]。Demeulemeester等[5]基于TRN-SR2與HIV-1 IN蛋白-蛋白相互作用利用AlphaScreen高通量篩選技術從25 608個小分子中找到2個活性化合物,它們能夠阻斷HIV-1核輸入過程,提示TRN-SR2與HIV-IN的相互作用是抗HIV治療的有效靶點。因此,尋找和設計開發TRN-SR2與HIV-1 IN相互作用的高效抑制劑具有重要的發展前景和研究意義。
為了開展以TRN-SR2與HIV-1 IN相互作用為靶點的抑制劑篩選研究,本文將人源蛋白TRN-SR2進行原核表達純化,從而獲得可溶表達且具有活性的重組TRN-SR2蛋白,并利用生物膜干涉技術(Bio-Layer Interferometry,BLI)檢測TRN-SR2與HIV-1 IN體外相互作用,同時采用均相時間分辨熒光(Homogeneous time resolved fluorescence,HTRF)技術和交叉滴定實驗確定TRN-SR2與HIV-1 IN相互作用的最適反應濃度。本文將為后續TRN-SR2與HIV-1 IN相互作用為靶點的抑制劑的開發提供研究基礎。
1 材料與方法
1.1 材料
1.1.1菌株及質粒
大腸桿菌(Escherichiacoli)菌株Rosetta(DE3)、DH5α購自北京全式金生物技術有限公司。pGST-TRN-SR2重組質粒由臺灣生物醫學研究所的Woan-Yuh Tarn博士饋贈[5]。
1.1.2試劑與儀器
GST純化柱填料購自常州天地人和生物科技有限公司,黑色96孔板、384孔聚丙烯淺孔微孔板購自Perkin Elmer(美國),Anti-6His-XL665受體磁珠、Anti-GST-Cryptate供體磁珠購自Cisbio公司(法國),其他試劑均為國產分析純。微孔板恒溫振蕩器BE-9008(其林貝爾儀器制造有限公司),多功能酶標儀Envision 2102 multilabel reader(珀金埃爾默儀器有限公司PerkinElmer Life Sciences),ForteBio Octet Red 96分子相互作用分析儀(美國)。
1.2 方法
1.2.1TRN-SR2的表達純化
重組質粒pGST-TRN-SR2的載體為pGEX-2T,將重組質粒pGST-TRN-SR2轉化到大腸桿菌DH5α感受態細胞,第2天挑取單個克隆進行DNA序列測定,測序工作在蘇州金維智公司完成,測序結果正確。然后將重組質粒pGST-TRN-SR2的轉化大腸桿菌Rosetta(DE3)菌株,37 ℃培養過夜,將單個克隆37 ℃振蕩培養過夜,然后擴大培養至菌液在600 nm下的吸光值達到0.6,添加0.5 mmol/L IPTG 28 ℃誘導表達過夜,8000 r/min離心收集菌體。裂解液(50 mmol/L Tris-HCl,pH 7.5,150 mmol/L NaCl,5 mmol/L DTT)重懸菌體,超聲破碎后離心收集上清。利用GST親和色譜柱純化TRN-SR2蛋白,用洗脫buffer(50 mmol/L Tris-HCl,pH 7.5,150 mmol/L NaCl,5 mmol/L DTT,20 mmol/L reduced glutathione)洗脫目的蛋白,采用SDS-PAGE檢測蛋白表達純化結果,并使用BCA蛋白濃度測定試劑盒測定蛋白質含量。HIV-1 IN的表達純化參考文獻[6]。
1.2.2 BLI體外檢測TRN-SR2與HIV-1 IN的相互作用
在Octet RED96系統中操作BLI實驗,反應體積為200 μL,反應溫度為30 ℃。實驗方法如下:1)基線平衡。首先將Streptavidin (SA)標記的探針放入PBST(0.05% Tween,pH 7.5)中浸濕20 min,在系統中進行第一次基線(Baseline)平衡,時間120 s。2)蛋白固定。將探針轉移入含有500 nmol/L biotin標記的終濃度為5 μmol/L HIV-1 IN的PBST中進行HIV-1 IN蛋白固定(Loading),時間600 s。3)結合測定。將固定后含有biotin的HIV-1 IN探針重新轉移到PBST中進行第2次基線(Baseline)平衡,時間120 s;然后將探針轉移至終濃度5 μmol/L TRN-SR2的PBST中進行結合(Association)測定,時間150 s。4)蛋白解離。將結合后的探針再次轉移到PBST中進行解離(Dissociation)實驗,時間300 s。
1.2.3基于HTRF確定TRN-SR2與HIV-1 IN相互作用最適濃度
采用交叉滴定實驗考察兩個蛋白在384孔板中的最適反應濃度,實驗中所用蛋白和化合物均用反應Buffer(25 mmol/L Tris-HCl pH 7.5,1 mg/mL BSA,2 mmol/L MgCl2,150 mmol/L NaCl,0.1% NP40)稀釋。實驗設置HIV-1 IN與TRN-SR2的起始濃度為320 nmol/L,并依次梯度稀釋至160、80、40、20和10 nmol/L,以0 nmol/L為對照。將4 μL HIV-1 IN、4 μL TRN-SR2、2 μL Buffer依次加入到384孔板中混勻,25 ℃,300 r/min反應30 min。反應結束后將5 μL 0.8 nmol/L的GST-Cryptate供體磁珠和5 μL 4 nmol/L的Anti-6His-XL665受體磁珠(含100 mmol/L KF)混勻加入到384孔板中,繼續反應1 h后使用Envision 2102 multilabel reader酶標儀進行檢測[6]。儀器檢測條件:以320 nm為激發光,讀取665 nm和620 nm處的發射光,分別計算各孔665 nm和620 nm處熒光強度的比值(Ration 665/620)。
1.2.4數據處理
結合-解離曲線、動力學參數使用Data analysis(ForteBio,version 7.1)進行數據分析。KD值是基于結合-解離曲線并通過nonlinear global fitting model模擬計算得出解離常數(Kd)與結合常數(Ka)的比值,該值可反映分子間親和力的大小。HIV-1 IN與TRN-SR2濃度均為5 μmol/L,重復3次計算平均值。使用軟件Graphpad 6.0作柱狀圖。
2 結果與分析
2.1 TRN-SR2與IN-HIS的表達純化結果
圖1為TRN-SR2在大腸桿菌Rosetta(DE3)中的表達結果,TRN-SR2在經0.5 mmol/L的IPTG誘導后,目的蛋白(約130 ku)蛋白量明顯增多,再通過20 mmol/L GSH洗脫,SDS-PAGE電泳檢測在130 ku左右有明顯的TRN-SR2蛋白條帶,使用BCA法測得TRN-SR2蛋白的濃度約為0.8 mg/mL。
2.2 BLI體外檢測TRN-SR2與HIV-1 IN的相互作用結果
圖2為BLI體外檢測5 μmol/L TRN-SR2與HIV-1 IN相互作用的結合-解離曲線,曲線中的橫坐標是結合解離持續時間,縱坐標為相位移變化(代表結合信號的強弱)。圖2中TRN-SR2與HIV-1 IN在Octet系統Association步驟中曲線明顯升高,說明TRN-SR2與HIV-1 IN親和力較高,結合效果較好。通過結合-解離曲線計算出TRN-SR2與HIV-1 IN的KD值為45.2 nmol/L。
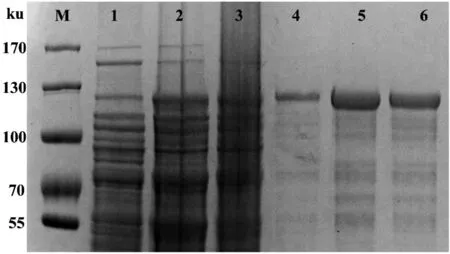
1:誘導前;2:誘導后;3:上清;4-6:20 mmol/L GSH洗脫;M:Marker
圖1SDS-PAGE檢測TRN-SR2的表達純化結果
Figure 1 The expression and purification results of TRN-SR2 was detected by SDS-PAGE

圖2 TRN-SR2與HIV-1 IN相互作用的結合-解離曲線(平滑的為擬合曲線)
2.3 TRN-SR2與HIV-1 IN相互作用的最適濃度
圖3為不同濃度TRN-SR2與HIV-1 IN相互作用的HTRT交叉滴定實驗結果。結果表明:當TRN-SR2蛋白濃度不變時,熒光信號值隨著HIV-1 IN蛋白濃度呈現拋物線狀變化。同樣,當HIV-1 IN蛋白濃度不變時,熒光信號值隨著TRN-SR2蛋白濃度也呈現拋物線狀變化。TRN-SR2蛋白濃度為20 nmol/L和HIV-1 IN蛋白濃度為40 nmol/L時,信號值達到最大,實驗靈敏度最高。
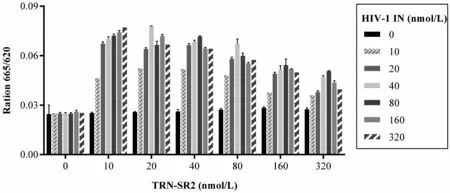
圖3 不同濃度TRN-SR2與HIV-1 IN相互作用的HTRT實驗結果
3 討論與結論
目前上市治療HIV的藥物雖然能夠有效降低患者體內病毒的數量,但長期服用均有不良反應發生,而耐藥毒株的快速出現也使艾滋病的治療形勢更加嚴峻,因此研究者們迫切希望找到新型抗HIV療法和以新作用機制為靶點的抗病毒藥物[3]。HIV整合前核輸入過程中TRN-SR2與HIV-IN的相互作用已成為抗HIV-1 IN藥物篩選的新靶點。本文通過原核表達純化能夠簡單快速得到大量的重組TRN-SR2蛋白用于后續的抑制劑篩選實驗研究,同時也降低了經濟成本。
生物膜干涉技術是一種快速檢測分子間相互作用的方法,具有準確度高、高通量和速度快等優點[7]。HIV-1 IN晶體結構研究表明[8-10],二聚化的整合酶CCD形成的結合口袋是與其他輔助因子發生相互作用關鍵位置。因此本文原核表達純化了HIV-1 IN-CCD蛋白,并通過BLI檢測其與TRN-SR2相互作用,計算出TRN-SR2與HIV-1 IN的KD值為45.2 nmol/L。Stephanie等[11]通過AlphaScreen的方法確定His6-IN/GST-TRN-SR2相互作用的KD值為16.8 nmol/L。根據BLI原理,KD值即為親和力常數,它只與分子間相互作用大小有關,與分子濃度無關,其數值越小代表的分子間親和力越強[12]。行業內比較認可的親和力差異的評價標準為:“KD值差異10倍”可認定2種分子與配體間的親和力存在明顯差異,因此本文測得KD值45.2 nmol/L與文獻報道的16.8 nmol/L沒有明顯差異[12-13]。根據計算公式,當KD值為10-6mol/L時,解離百分比約為0.1%,因此TRN-SR2與HIV-1 IN的KD值為45.2 nmol/L同時也說明兩者結合后的解離百分比小于0.1%。以上結果表明TRN-SR2與HIV-1 IN在體外相互作用結合效果較好,可用于后續的抑制劑篩選研究。
HTRF是常用于高通量藥物篩選的方法,具有穩定、經濟、操作簡便的特點[14-15],可用于TRN-SR2與HIV-1 IN相互作用抑制劑的活性評價。本文通過交叉滴定實驗確定篩選體系中TRN-SR2和HIV-1 IN蛋白最適反應濃度分別為20 nmol/L和40 nmol/L,這將為開展以TRN-SR2與HIV-1 IN相互作用為靶點的抑制劑篩選研究提供良好基礎。

