銀杏內酯B抗心肌氧化應激損傷作用機制研究?
蘇 琦,趙 娜,苗雨欣,李朝陽,肖 童,孫雅涵,何瑪麗,田 煒,徐菁蔓△
(1.華北理工大學醫學實驗研究中心,河北 唐山 063210; 2.華北理工大學實驗動物中心,河北 唐山 063210; 3.國家科技部老年醫學國際科技合作基地,河北 唐山 063210)
心肌缺血/再灌注損傷(myocardial ischemia/reperfusion injury,MIRI)是指缺血心肌在恢復血流之后發生的更加嚴重的損傷,常出現梗死面積擴大和心率失常[1]。氧化應激(oxidative stress,OS)是機體受到多種有害因素刺激后,活性氧簇(ROS)產生過多,抗氧化能力下降對機體造成損傷。在MIRI中ROS大大增加,造成病理損傷[2]。近年來,磷脂酰肌醇-3激酶(phosphatidylinositol-3 kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信號途徑已成為研究熱點,Akt對下游信號分子的活化起重要作用,如糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)[3],GSK-3β磷酸化失活對于抗氧化應激損傷尤為重要,故本實驗以此作為研究方向。
銀杏內酯B(ginkgolide B,GB)是銀杏葉(ginkgo biloba L)提取物。銀杏葉化學成分豐富,其主要有效成分為萜內酯類化合物,包括銀杏內酯A、B、C等[4],其中GB生理活性最強[5]。研究發現,GB可以用于治療心血管疾病,具有抗炎、抗氧化等作用[6],但在MIRI方面研究甚少。本實驗意在探討GB能否具有發揮抗氧化應激損傷的作用及其作用機制,以期為MIRI臨床治療提供方向。
1 材料與方法
1.1 細胞株
H9c2細胞株(來源于大鼠胚胎心臟組織)購自美國ATCC 公司。
1.2 試劑與儀器
實驗藥物銀杏內酯B(Ginkgolide B GB)由北京百威靈科技有限公司提供(純度>99%);H2O2(批號STBB6350)購自美國Sigma 公司;兔源單克隆抗體p-Akt(Ser473)、p-GSK-3β(Ser9)、鼠源微管蛋白β-Tubulin(多克隆抗體)及辣根過氧化物酶標記山羊抗兔IgG二抗均購自美國Cell Signaling Technology公司;熒光染料羅丹明123(Rhodamine 123)購自上海碧云天生物技術研究所,改良Eagle 培養基(dulbecco'smodified eagle medium DMEM),四甲基偶氮唑鹽比色法[3-(4、5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazoliumbromide,MTT] 細胞增殖及毒性檢測試劑盒、聚氰基丙烯酸正丁酯(Butyleyanoacrylate,BCA)蛋白濃度檢測試劑盒、電化學發光免疫分析(ElectrogeneratedChemiluminescence,ECL)發光檢測試劑盒,均購自上海碧云天生物技術研究所,37 ℃二氧化碳CO2 培養箱購自美國Thermo Forma 公司;熒光酶標儀購自美國Molecular Devices公司;生物安全柜購自新加坡ESCO 公司;5804R 高速冷凍離心機購自德國Eppendorf 公司;JY200C 電泳儀購自北京君意東方電泳設備有限公司;酶標儀和濕轉運系統購自美國Bio-Rad 公司。
1.3 試驗方法
1.3.1 細胞培養 從液氮罐中取出凍存的H9c2細胞,放入37 ℃恒溫水浴箱中溶化,在超凈工作臺中將溶好的細胞懸液移入裝有5 mlDMEM培養基(含10%胎牛血清、雙抗)的無菌離心管中,置于離心機離心(1000 rm,離心5 min)后棄上清,將細胞重懸于25 ml培養瓶中,并使其均勻分布,放置于細胞培養箱(CO2濃度為5%,溫度為37 ℃,飽和濕度)中進行培養;在培養24~48 h之后顯微鏡觀察H9c2細胞狀態,待其長至大約>90%時,選擇狀態良好的H9c2細胞棄培養基,用無菌磷酸鹽緩沖溶液(phosphate buffered saline, PBS)將細胞沖洗3遍,用0.25%胰蛋白酶200 μL 消化2 min,用10 ml培養基終止消化,反復輕輕吹打為均勻的細胞懸液,分配到2個培養瓶中即可,每周傳代2~3次;選取生長狀態良好的細胞,在處于對數生長期且細胞數目達到80%~90%時同傳代步驟相同,將細胞消化離心后加入500 μL凍存液,使其懸浮充分混勻后移入1.5 ml凍存管中,用封口膜封口并標記,保存于-80 ℃冰箱中(如需長期保存轉入液氮罐中)。
1.3.2 實驗分組及處理條件 實驗共分為4組。Control組:正常培養的H9c2細胞不進行任何藥物處理;H2O2組:650 μmol/L 處理20 min;GB+H2O2組:加入不同濃度GB(15.0、30.0、60.0 和120.0 μmol/L)處理20 min,加入H2O2650 μmol/L處理20 min;之后的研究中GB+H2O2組均采用60.0 μmol/L預處理20 min,然后用650 μmol/L處理20 min, GB組:只加入60.0 μmol/L的GB處理20 min。
1.3.3 MTT 法檢測細胞存活率 選取對數生長期且細胞狀態良好的細胞重復培養步驟,待其消化離心重新懸浮后進行細胞計數,稀釋為1×104個/ml,96 孔板加入100 μL/孔,約1000個細胞培養24~48 h,待其長到75%左右后按照各組要求加藥處理細胞,處理后把液體全部吸出,PBS沖洗,重新加入完全培養基100 μL,再加入10 μL MTT,繼續在細胞培養箱內培養4 h后,加入150 μL二甲基亞砜(dimethyl sulfoxide,DMSO),放置于搖床慢搖15 min后,在顯微鏡下觀察到藍色結晶物完全溶解,用酶標儀在570 nm 處測定每孔吸光度值(optical delnsity,OD),計算細胞的存活率(survival rate,SR)。細胞存活率%=實驗組OD值/ 對照組OD值×100%。
1.3.4 檢測線粒體膜電位 選取對數生長期且細胞狀態良好的細胞重復細胞培養步驟,待其消化離心重新懸浮后進行細胞計數,稀釋為1×104個/ml,96 孔板加入100 μL/孔,約1000個細胞,培養24 h長至75%左右后按照各組要求處理細胞,處理后把培養基全部吸出,PBS沖洗2遍,重新加入含有2 μmol/l R123的培養基100 μL培養40 min后,倒掉其中培養基,PBS洗2遍,再加入100 μL完全培養基,用酶標儀在507~529 nm處檢測定每孔吸光度值。
1.3.5 Western blot 檢測 Akt 和 GSK-3β 磷酸化蛋白表達 在2 ml小皿中細胞培養48 h后,選擇生長狀態良好的細胞按照分組處理再棄培養基,PBS沖洗3遍,加入40 μL裂解液冰上裂解30 min, 將細胞收集于Eppendorf 管中,超聲破碎15 s,4℃ 12 000 r/min,離心15 min 后取上清液,使用二喹啉甲酸(Bicinchoninic acid,BCA)法進行蛋白定量。以25μg/孔上樣,依次進行電泳及轉膜,使用10%脫脂奶粉室溫慢搖2 h,孵育p-Akt(Ser473)、p-GSK-3β(Ser9)及β-Tublin一抗(1∶1000稀釋),4 ℃慢搖過夜(8~12 h),Tris-HCl 緩沖鹽溶液洗3次,每次10 min;二抗(1∶1000稀釋)室溫慢搖孵育2 h,Tris-HCl 緩沖鹽溶液洗3次,每次10 min;增強化學發光法(enhanced chemiluminescence,ECL)熒光顯色,用Image J 進行灰度掃描及定量分析。
1.4 統計學方法

2 結果
2.1 GB對心肌氧化應激損傷的影響
2.1.1 GB對細胞存活率的影響 表1顯示,與對照組比較, H2O2組的細胞存活率下降。不同濃度的GB預處理,MTT檢測OD值均升高,其中GB為60 μmol/L 時效果最為明顯,差異有統計學意義,表明GB能減輕H2O2引起的細胞存活率下降,60 μmol/L為其最適濃度。
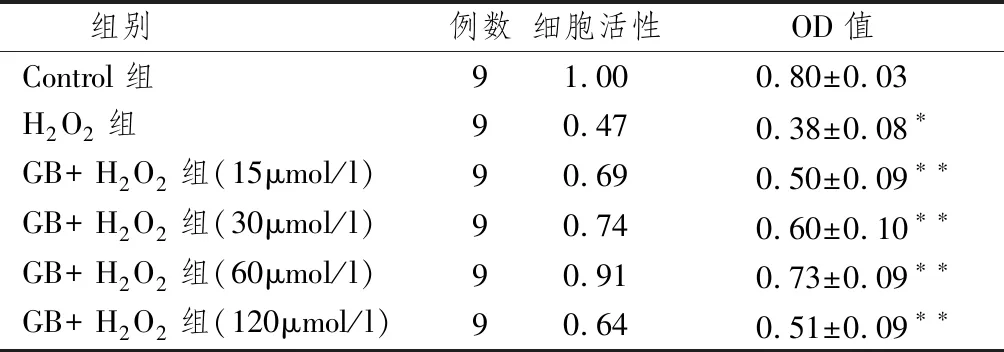
表1 MTT法測定GB對H9c2細胞存活率的影響
注:與control組比較:*P<0.05;與H2O2組比較:**P<0.05
2.1.2 GB對心肌細胞線粒體通透性轉換孔(mitochondrial permeablity transition pore,mPTP)開放的影響 表2顯示,與對照組比較, H2O2組的熒光強度下降。60 μmol/L 的GB預處理,熒光酶標儀檢測熒光強度升高,差異有統計學意義,表明GB能夠減輕H2O2引起的mPTP開放。

表2 熒光酶標儀檢測GB對H9c2線粒體膜電位的影響
注:與control組比較:*P<0.05;與H2O2組比較:**P<0.05
2.1.3 GB對Akt磷酸化蛋白表達的影響 圖1顯示,與對照組比較, H2O2組的Akt蛋白磷酸化水平降低, GB預處理組中Akt蛋白磷酸化水平增強,差異有統計學意義(P<0.05),表明GB能夠上調Akt蛋白磷酸化水平。
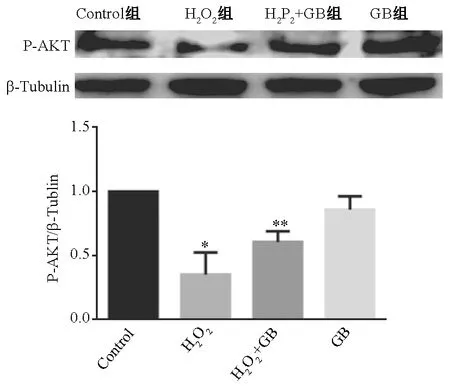
注:與control組比較:*P<0.05;與H2O2組比較:**P<0.05圖1 P-Akt (Ser473)蛋白表達比較
2.1.4 GB對GSK-3β磷酸化蛋白表達的影響 圖2顯示,與對照組比較, H2O2組的GSK-3β蛋白磷酸化水平降低,GB預處理組中GSK-3β蛋白磷酸化水平增強,差異有統計學意義(P<0.05),表明GB能夠上調GSK-3β蛋白磷酸化水平。
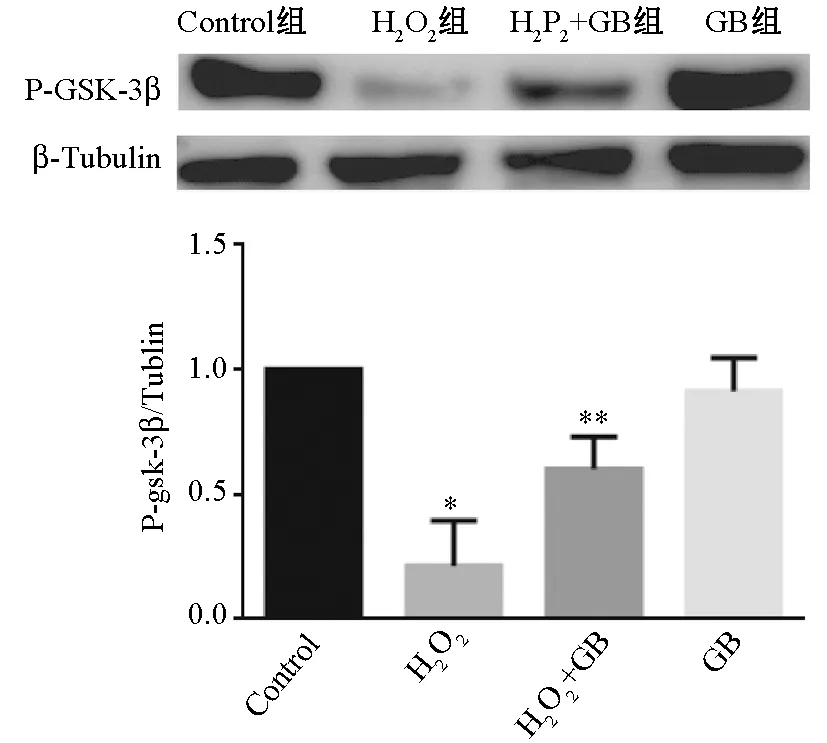
注:與control組比較:*P<0.05;與H2O2組比較:**P<0.05圖2 p-GSK-3β(Ser9)蛋白表達比較
3 討論
GB作為銀杏葉中活性最強的成分,曾被稱為 “活化石”,具有極高的觀賞、經濟和藥用價值,化學成分極為豐富。有研究發現,GB在抗腦缺血/再灌注損傷中可發揮保護作用,明顯減輕大腦損傷[7], 還可降低氧化應激所導致的內皮細胞損傷[8]。近年來相關研究顯示,GB在I/R損傷方面可發揮其保護作用,降低損傷程度[9]。從本研究MTT檢測結果可以看出,GB能夠明顯減輕氧化應激損傷,提高H9c2細胞存活率。
線粒體是機體各種生命活動的能量來源,在維持機體正常代謝中扮演著重要角色。而mPTP是一種位于線粒體內、外膜之間的膜通透性轉換孔,在正常情況下mPTP處于關閉狀態,阻擋離子和其他代謝物質通過[10]。但當各種有害因素刺激細胞時,如H2O2會導致線粒體鈣超載和氧化應激程度增加,線粒體膜及電子傳遞鏈發生氧化損傷, ATP 產生大大減少,線粒體穩定狀態被破壞,從而產生大量ROS[11],使細胞發生應激性損傷,沒有足夠的ATP就會使mPTP處于開放狀態[12],大量本被阻擋在線粒體外的分子、離子涌入線粒體內,導致損傷引發細胞凋亡。近年來發現,若能抑制mPTP開放,就有可能降低細胞氧化應激損傷[13]。本研究熒光酶標儀檢測結果表明,銀杏內酯B能夠抑制mPTP 開放,發揮抗氧化應激損傷作用,這表明銀杏內酯B也可通過線粒體機制發揮心肌保護作用。
PI3K/AKT信號通路是細胞內非常重要的信號傳導通路之一,可以在機體多種生命活動過程中影響下游效應分子(一氧化氮合酶、Bcl-2 家族、胱天蛋白酶9(caspase-9)等)的活化狀態,從而發揮抗凋亡、減輕細胞損傷的作用。由于AKT磷酸化之后可產生級聯放大效應,因此若采用阻斷此通路中關鍵環節的方法,就可能有效防治I/R損傷及細胞凋亡等[14]。目前已有研究顯示,通過藥物靶向治療Akt通路的關鍵環節,可明顯減輕心肌損傷和細胞凋亡[15]。本研究結果顯示,GB能夠使Akt磷酸化蛋白表達明顯增加,提示GB可能是通過PI3K/Akt通路發揮抗心肌細胞氧化損傷作用。
GSK-3β是GSK-3亞型之一,屬于絲氨酸/蘇氨酸蛋白激酶家族成員,具有重要的細胞調節功能,廣泛分布于哺乳動物真核細胞中[16]。在正常狀態下GSK-3β處于激活狀態,當其被磷酸化后則失活,若能抑制GSK-3β活性就可提高心肌細胞抗氧化應激能力。近年來各項研究表明,GSK-3β與I/R損傷等心血管疾病密切相關[17],同時也是參與肝糖代謝的關鍵酶,廣泛參與體內多種功能活動的調節。GSK-3β也與細胞凋亡、損傷等緊密關聯,主要是通過磷酸化多種底物蛋白來調節糖原的合成代謝,參與細胞的分化、增殖等[18]。有研究認為,GSK-3β是心肌保護通路的一個重要交點,GSK-3β磷酸化在上游信號AKT作用下增強,從而減輕MIRI。本研究結果顯示,GB能夠上調GSK-3β磷酸化蛋白的表達,提示GB可能是通過此途徑發揮心肌保護作用的。
本實驗結果表明,GB預處理可以使H9c2細胞存活率升高,并提示 GB可能是通過PI3K/Akt 途徑抑制GSK-3β活性, 減少mPTP 開放,從而減輕氧化應激引起的心肌細胞損傷。

