電針五臟俞治療PCPA誘導大鼠失眠的療效觀察?
唐 雷,徐 芬,胡 星,李云飛
(華中科技大學同濟醫學院附屬武漢市中心醫院康復科,武漢 430000)
失眠是指無法入睡或保持睡眠狀態[1]。調查顯示,全球約有31%~56%的人受到失眠困擾[2]。長期失眠不僅會使免疫功能下降,還會增加糖尿病、高血壓等疾病的風險[3-4]。近年來,臨床上以藥物治療失眠為主,而大多數藥物長期服用易產生耐藥性和依賴性[5],因此研究非藥物治療的重要性日益凸顯[6]。
現代針灸中的電針“五臟俞”療法是在對失眠發病機制全面認識基礎上制定的[7-8]。有研究顯示,睡眠剝奪能加快機體新陳代謝,增加自由基,降低超氧化物歧化酶(SOD)活性,并形成大量脂質過氧化物丙二醛(MDA)[9]。此外,失眠癥與神經元活性也密切相關,PCPA長時期刺激會導致神經元線粒體功能損傷[10]。腦源性神經營養因子(BDNF)具有促進多種神經元存活和軸突再生、防止發育中神經元凋亡、調節神經遞質釋放等作用,BDNF表達下調則可能對神經可塑性造成有害影響[11]。NeuN是一種穩定而敏感的成熟神經細胞特異抗原結合物,參與神經系統的發育、分化和功能,常作為成熟神經元存活的主要檢測指標[12]。
因此,本文筆者采用電針五臟俞治療PCPA致大鼠失眠,并從多方面觀察其療效,與常規藥物治療進行對比,探討其干預失眠的作用機制,為臨床電針五臟俞治療失眠癥提供理論基礎。
1 材料與方法
1.1 材料
雄性Sprague Dawley大鼠購自華中農業大學實驗動物中心,飼養于SPF動物房;PCPA、地西泮購自Sigma公司;RIPA裂解液、TUNEL試劑盒、SOD試劑盒、MDA試劑盒購自Bioswamp公司;BDNF抗體、NeuN抗體、GAPDH抗體購自CST公司;反轉錄試劑盒購自Takara公司。
1.2 方法
1.2.1 PCPA誘導大鼠失眠模型的建立與評估 模型建立[13]:40只大鼠按隨機數字表法分為正常對照組、PCPA模型組、地西泮西藥組及電針療法組4組,適應性喂養1周。PCPA模型組連續2 d腹腔注射PCPA混懸液(30 mg/100 g),若大鼠出現易受聲光等激擾而狂躁不安、不讓抓握、晝伏夜出節律消失等行為,表明造模成功,而后不予以任何處理。地西泮西藥組造模成功后,連續7 d以地西泮(0.9 mg/kg)水溶液灌胃。電針療法組造模成功后連續7 d針刺治療大鼠肺俞、心俞、肝俞、脾俞、腎俞,頻率60 Hz,治療時間15 min,強度以針柄輕微顫動為宜。
模型評估:行為學觀察,如模型組及干預組大鼠在第1次腹腔注射PCPA后28~30 h間,出現晝伏夜出節律消失,白天活動不止,總睡眠時間減少,且性情煩躁,攻擊性增強,整體觀察與對照組明顯不同,則表明模型復制成功。體質量監測:正常對照組不給予任何處理。各組大鼠分別在實驗前、造模第1天、治療第1天及治療第7天稱量體質量。
1.2.2 大鼠血清SOD活性和MDA含量測定 治療結束后次日麻醉大鼠,取腹主動脈血5 mL,離心并收集上清,按試劑盒說明操作分別檢測SOD活性和MDA含量。
1.2.3 大鼠海馬TUNEL染色 治療結束次日處死大鼠取出海馬,4%多聚甲醛固定48 h。各組樣本制石蠟切片,脫蠟水化,按試劑盒說明操作分別進行染色并計算細胞凋亡率。
1.2.4 RT-PCR、Western blot檢測大鼠海馬NeuN、BDNF的mRNA及蛋白表達 治療結束次日處死大鼠取出海馬,一部分樣品提總RNA并反轉錄,行cDNA擴增。條件為95 ℃預變性3 min,95 ℃變性7 s,56 ℃退火延伸30 s,45個循環。剩余海馬樣品RIPA提取總蛋白。SDS-PAGE后,分別以稀釋比1∶500、1∶500、1∶1000加NeuN、BDNF、GAPDH一抗,4 ℃孵過夜;加二抗,采用化學發光儀曝光條帶。
1.3 統計學方法

2 結果與分析
2.1 對大鼠行為學與體質量的影響
圖1顯示,給予PCPA注射大鼠約24 h后對外界聲光刺激異常敏感,興奮性增強,晝夜節律紊亂,表明失眠模型復制成功。地西泮西藥組及電針療法組大鼠經治療后,精神狀態、行為活動趨于正常,晝夜節律逐漸恢復;而PCPA模型組大鼠精神萎靡,飲食不振,晝夜節律恢復較慢;正常對照組大鼠生活、睡眠規律無明顯變化。實驗前及造模第1天,各組大鼠體質量平穩增長,組間無明顯差異。治療第1天,失眠使大鼠體質量顯著下降,除正常對照組外的各組大鼠體質量間無明顯差異。而治療第7天,各組大鼠平均體質量由重至輕依次為正常對照組、電針療法組、地西泮西藥組及PCPA模型組,組間差異性顯著,其中正常對照組體質量正常增長,PCPA模型組增長緩慢,電針療法組、地西泮西藥組經治療后體質量呈恢復性增加。
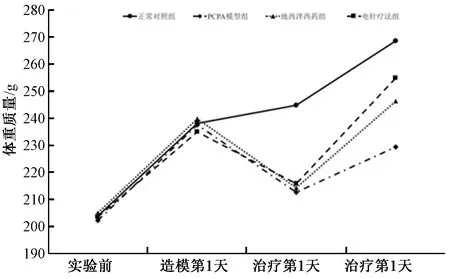
圖1 各組大鼠不同時間點體質量變化比較(g)
2.2 大鼠血清SOD活性和MDA含量的變化
表1顯示,與正常對照組比較,PCPA模型組大鼠血清SOD活性、SOD/MDA值降低(均P<0.05),MDA含量升高(P<0.05);地西泮西藥組SOD活性與對照組比較差異無統計學意義,但MDA含量、SOD/MDA值分別低于和高于模型組(均P<0.05);電針療法組SOD活性高于對照組(P<0.05),MDA含量、SOD/MDA值與地西泮西藥組比較差異無統計學意義。
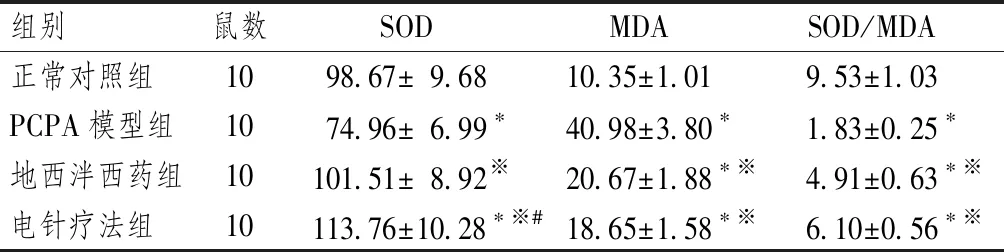
表1 大鼠血清SOD活性及MDA含量比較
注:與對照組比較:*P<0.05;與模型組比較:※P<0.05;與地西泮西藥組比較:#P<0.05
2.3 大鼠海馬TUNEL凋亡染色的變化
圖2表2顯示,TUNEL檢測大鼠海馬區凋亡情況顯示,正常對照組的大鼠海馬神經元僅出現少量凋亡且分布分散,細胞凋亡率最低;PCPA模型組的大鼠海馬神經元凋亡數量顯著增多且分布密集,細胞凋亡率最高;地西泮西藥組、電針療法組的大鼠海馬區陽性細胞數及細胞凋亡率較PCPA模型組均明顯降低。
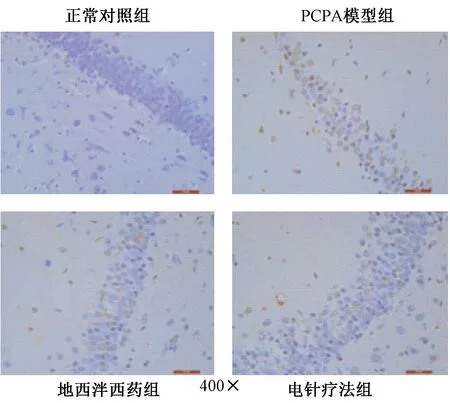
圖2 大鼠海馬TUNEL檢測細胞凋亡的結果

組別正常對照組PCPA模型組地西泮西藥組電針療法組凋亡率(%)7.56±1.2374.89±5.66?37.84±3.59?※36.19±3.94?※
注:與對照組比較:*P<0.05;與模型組比較:※P<0.05
2.4 大鼠海馬NeuN和BDNF的mRNA及蛋白表達情況

表3 大鼠海馬NeuN及BDNF的mRNA及蛋白表達差異比較
注:與對照組比較:*P<0.05;與模型組比較:※P<0.05;與地西泮西藥組比較:#P<0.05
表3圖3顯示,與正常對照組比較,PCPA模型組大鼠海馬中NeuN的mRNA及蛋白表達明顯降低(均P<0.05);與PCPA模型組比較,地西泮西藥組及電針療法組經治療能夠顯著提高大鼠海馬中NeuN的mRNA及蛋白表達,尤以電針療法組表達水平提升更為明顯(均P<0.05)。各組大鼠海馬中BDNF的mRNA及蛋白表達情況也同樣符合上述規律。
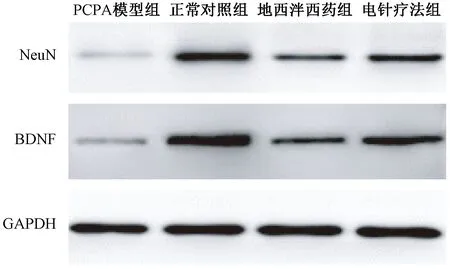
圖3 各組大鼠海馬NeuN及BDNF的蛋白表達條帶
3 討論
失眠癥屬于中醫“不寐”范疇。不寐發病機制主要以五臟功能紊亂為基礎,以五神失守為表現[14]。電針五臟俞治療失眠,是對失眠發病機制全面認識的基礎上結合前期研究結果制定的[15-16]。五臟俞即肺俞、心俞、肝俞、脾俞、腎俞,其對五臟功能有直接雙向調理作用[17]。《素問·宣明五氣篇》:“五臟所藏:心藏神,肺藏魄,肝藏魂,脾藏意,腎藏志”,說明五臟的生理活動與精神情志密切相關,五臟功能失調導致精神情志失常,繼而導致不寐的發生。電針刺激有調節外周神經、鎮靜作用,使人體腦有所依、神有所歸,在臨床中配合五臟俞可起到很好的寧神安寐之功[18]。本實驗成功復制PCPA致大鼠失眠經典模型,從晝夜不間斷觀察中我們發現,與PCPA模型組比較,失眠大鼠經電針五臟俞治療后精神狀態、行為活動趨于正常,晝夜節律、體質量增速逐漸恢復,對大鼠失眠狀態的整體改觀稍優于地西泮西藥組,提示電針五臟俞能促進失眠大鼠體內生理功能恢復,改善中樞神經活動。
觀察各組大鼠海馬TUNEL染色結果可以看出,相較正常對照組,PCPA模型組海馬區神經元凋亡嚴重、凋亡率最高,而電針療法組神經元細胞相較模型組凋亡程度明顯減輕、凋亡率降低,地西泮西藥組海馬凋亡減弱程度與電針療法組接近。由此電針五臟俞對失眠大鼠中樞神經的調節保護作用得以初步顯現。現代醫學認為,通過針刺背俞穴調節植物神經,能影響機體氧化與抗氧化系統平衡[19]。SOD是一種重要的抗氧化劑,外源性補充適量SOD能夠有效清除體內過量氧自由基,延緩細胞衰老,最終起到防病治療的作用[20]。而病理情況下,SOD活性降低,導致氧自由基過量聚集,引發脂質過氧化反應,形成MDA等脂質過氧化產物,損傷生物膜進而使細胞死亡[21]。在本研究中,電針療法組SOD/MDA值高于PCPA模型組和地西泮西藥組,與正常對照組接近。提示電針五臟俞可通過促進機體血清SOD活性和降低MDA合成,從而緩解PCPA致失眠引起的氧化應激、自由基水平上升、機體氧化與抗氧化系統紊亂,再次驗證電針五臟俞具有促進大鼠體內生理功能,改善睡眠的效果。肖愛嬌等研究同樣發現,熱敏灸具有緩解PCPA所致失眠大鼠癥狀的作用,且能顯著提高機體SOD活性,降低MDA含量[22]。NeuN是一種穩定而敏感的成熟神經細胞特異抗原結合物,參與神經系統的發育、分化和功能,在大部分神經細胞種類中表達,常作為成熟神經元存活的主要檢測指標[12],已被廣泛用于神經發育學、病理組織診斷學以及干細胞臨床研究等領域[23-24]。BDNF是目前為止研究最多的神經營養因子,其合成于腦,廣泛分布于大腦皮質及海馬區域,BDNF表達下調會損傷神經可塑性[25]。本實驗分別在基因和蛋白水平檢測大鼠海馬NeuN和BDNF的表達。結果表明,PCPA模型組大鼠海馬區NeuN和BDNF的mRNA表達較正常對照組顯著下調,而電針療法組的顯著上調;蛋白檢測結果與mRNA水平檢測基本一致,且電針組2指標變化與西藥組比較差異有統計學意義。提示PCPA剝奪睡眠會造成大鼠腦神經元的缺失,使神經元出現死亡,這可能與內源性神經再生受到抑制和神經元嚴重損傷有關。而通過針刺五臟俞能顯著促進BDNF的釋放,從而間接刺激神經發生和神經元的生長,提高海馬神經元內NeuN的表達,且電針組治療效果明顯高于西藥組。以上結果均表明,電針治療對失眠后腦神經修復發揮著重要作用。
綜上所述,筆者認為電針五臟俞促進體內生理功能,改善中樞神經活動的機制是通過內部促進大鼠海馬區營養因子BDNF的釋放,從而增加腦內能正常表達NeuN的神經元數目,減少神經元細胞凋亡,提高血清SOD活性,下調MDA含量以緩解PCPA造成的機體氧化與抗氧化系統紊亂,使大鼠外在精神面貌愈發轉好,晝夜節律、體質量增速愈發恢復,進而達到治療失眠的目的。電針五臟俞刺激對失眠大鼠腦神經的修復損傷和保護作用稍優于常規西藥地西泮,且電針五臟俞操作簡便,無不良反應,可使失眠患者擺脫藥物治療煩惱,具有較強的臨床實用性,適宜臨床推廣。至于電針五臟俞刺激提高海馬區BDNF及NeuN表達的機制仍需進一步的深入研究。

