基于離子遷移譜的肌酐檢測研究
高曉光何秀麗賈建李建平
(1.中國科學院電子學研究所傳感技術國家重點實驗室,北京100190;2.中國科學院大學,北京100049)
肌酐是人體肌肉組織代謝的產物。肌肉中肌酸主要通過不可逆的非酶脫水反應緩慢形成肌酐,再釋放到血液中。血清肌酐(Serum creatinine,Scr)與體內肌肉總量關系密切,不易受飲食影響。人體中的肌酐主要由腎小球濾過排出體外。在正常條件下,肌酐濃度相對穩定,當腎臟機能受到損傷時,肌酐的正常排泄功能受到一定阻礙,Scr濃度升高。腎功能正常者的Scr濃度小于133 μmol/L,而尿毒癥患者的Scr濃度一般大于707 μmol/L。Scr濃度是臨床上計算腎小球濾過率(glomerular filtration rate, GFR),評價腎功能的重要指標。檢測Scr對慢性腎臟病等疾病的發現和治療具有重要意義[1]。
臨床上主要通過堿性苦味酸法和酶法(包括肌氨酸氧化酶法與肌酐亞胺水解酶法)測定Scr[2, 3],堿性苦味酸法成本低廉,但特異性不強,抗干擾能力差;肌氨酸氧化酶法準確度、抗干擾能力均優于堿性苦味酸法,并且交叉污染較少,適用于全自動生化分析儀,但檢測成本較高,測得的Scr值容易受到血管保護劑類藥物羥苯磺酸鈣和維生素類藥物維生素C等的干擾[4 - 6]。我國于2013年頒布了衛生行業標準《血清肌酐測定參考方法. 同位素稀釋液相色譜串聯質譜法》(WS/T413—2013),規定同位素稀釋液相色譜串聯質譜法為Scr測定的標準方法[7]。除此之外,肌酐檢測方法還包括毛細管電泳法、高效液相色譜法、拉曼散射法等,但這些不適合大規模現場檢測,只適合實驗室中校準對照或高精度檢測[3]。
離子遷移譜(Ion Mobility Spectrometry,IMS)基于不同氣相離子在電場中遷移速度的差異實現對化學物質的分離檢測。與其它方法相比,IMS具有分析速度快、檢測限低、不需要真空環境等優點[8]。IMS已被廣泛應用于人體健康檢測研究中,如許多研究人員使用IMS檢測人體呼出氣體或尿樣、血樣中的特定組分,區分某些疾病患者與健康人,實現疾病的早期發現與診斷[9]。
本實驗使用實驗室自制的電暈放電離子遷移譜(CD-IMS)系統進行肌酐檢測研究,根據IMS圖譜中被測物特征離子峰強度實現對肌酐的定量測量,并探討了羥苯磺酸鈣、維生素C等藥物對肌酐IMS檢測的干擾。
1 實驗
1.1 實驗試劑與材料
肌酐(CAS:60-27-5):99%,上海阿拉丁生化科技股份有限公司;羥苯磺酸鈣(CAS:20123-80-2):99%,上海阿拉丁生化科技股份有限公司;維生素C(CAS:50-81-7):分析純,國藥集團化學試劑有限公司;封口玻璃毛細管:內徑0.9~1.1 mm,壁厚0.10~0.15 mm,管長100 mm,華西醫科大學儀器廠;去離子水:電阻率18.2MΩ·cm。
1.2 離子遷移譜實驗系統及原理
圖1為CD-IMS實驗系統結構示意圖。整個系統由漂移管和維持漂移管正常工作的輔助設備組成。
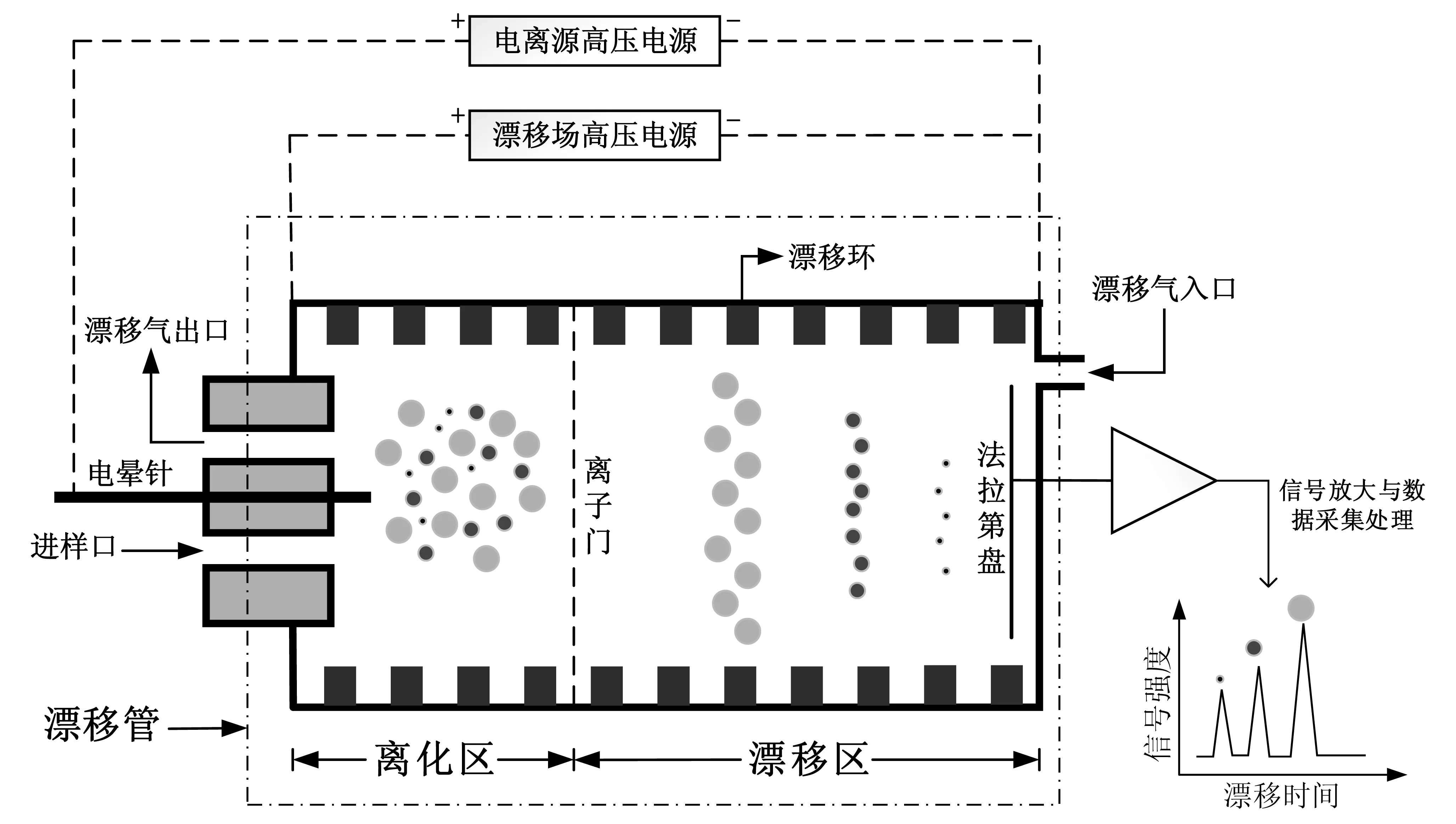
圖1 CD-IMS實驗系統結構示意圖
漂移管為CD-IMS實驗系統核心部件,主要包括離化區和漂移區兩部分,兩者由Bradbury-Nielson型離子門隔開。漂移管由不銹鋼漂移環和聚四氟乙烯絕緣環交替重疊組成,漂移電壓通過電阻分壓后加在各漂移環上,在漂移管內形成均勻漂移電場。漂移管末端為法拉第盤,用于離子流信號收集檢測。在漂移管前端離化區入口處的不銹鋼電暈針與漂移管第一級漂移環構成“針-環”結構的電暈放電電離源。在離化區入口處另有通孔分別作為進樣口與漂移氣出口。
輔助設備包括溫控模塊、漂移氣路、離子流信號放大與數據采集處理裝置以及用于電離源及漂移電場的高壓電源等。漂移氣路包括空氣源(A-10型,北京中惠普分析技術研究所)、干燥凈化管以及管路。空氣源產生的潔凈空氣經活性炭與分子篩干燥凈化后從法拉第盤周圍導入漂移管作為漂移氣體。整個漂移管置于恒溫裝置中,由溫控模塊調控漂移管工作溫度。受材料限制,漂移管最高工作溫度為200℃。
被測物分子在離化區與空氣電暈放電產生的反應離子相互作用生成被測物特征離子,通過離子門進入漂移區,然后在電場作用下漂移到末端法拉第盤。pA級的離子流信號經放大后轉換為數字信號并上傳到上位機,由上位機實現IMS譜圖的顯示、分析及存儲。通過IMS譜圖中離子峰的變化確定被測物特征離子峰,進而實現對被測物的定性定量檢測。
IMS實驗系統的主要參數如表1所示。

表1 CD-IMS實驗系統主要參數
1.3 實驗方法
使用電子天平(GR-202型,日本AND)稱量一定量肌酐固體,溶于去離子水中得到1 g/L(8840 μmol/L)的肌酐母液,之后取母液用去離子水按照一定比例稀釋即可得到一系列濃度的肌酐樣品。
將封口玻璃毛細管加熱,用移液器移取2 μL肌酐樣品,在封口玻璃毛細管冷卻過程中沿開口端注入封口玻璃毛細管中。由于氣體熱脹冷縮,肌酐樣品完全進入毛細管中,進樣時將封口玻璃毛細管開口端沿進樣口插入IMS系統,避免了樣品與進樣口內壁接觸造成損耗和污染。實驗發現玻璃毛細管的插入位置及漂移管溫度會對實驗結果造成影響,通過參數優化確定最優的玻璃毛細管進樣位置和漂移管溫度。
采集從進樣到產物離子峰消失全過程的IMS譜圖,根據譜圖中肌酐特征離子峰的漂移時間計算肌酐的約化遷移率。為減小漂移氣以及環境中的痕量雜質對實驗的影響,采用肌酐響應圖譜與空白譜的差分譜中肌酐特征離子峰最大高度作為IMS對肌酐響應的信號強度。檢測不同濃度肌酐樣品,得到肌酐的響應—濃度曲線、線性范圍與檢測限。
采用同樣方法配制羥苯磺酸鈣與維生素C樣品并進行IMS檢測,獲得高濃度羥苯磺酸鈣與維生素C樣品的IMS譜圖;分別配制肌酐與羥苯磺酸鈣、維生素C的混合樣品,研究羥苯磺酸鈣與維生素C對肌酐IMS檢測的干擾情況。
2 結果與討論
2.1 肌酐的IMS檢測圖譜
圖2為空白圖譜及4.42 μmol/L肌酐樣品CD-IMS檢測時得到的系列譜圖,其中(a)為空白譜圖,(b)、(c)和(d)分別為進樣后8s、62s、79s的譜圖。

圖2 空白圖譜及肌酐的系列CD-IMS譜圖(a).空白譜 ;(b).進樣后8s;(c).進樣后62s;(d).進樣后79s漂移管溫度:200℃ ; 進樣距離:5cm
圖2(a)空白譜圖中,RIP1,RIP2,RIP3為反應物離子峰,利用四丁基溴化銨標定[10]后計算其約化遷移率分別為3.09cm2·V-1·s-1,2.69cm2·V-1·s-1和2.40cm2·V-1·s-1,可知其分別為(NH4)+(H2O)n,(NO)+(H2O)n和(H3O)+(H2O)n,其中n的數值與漂移氣中的水含量及漂移管溫度有關[11]。
將玻璃毛細管插入進樣口之后,由于肌酐的沸點(184.3±23.0℃)較高,而且常溫下蒸汽壓很小(25℃時0.2±0.8 mmHg),在漂移管高溫作用下樣品中水首先汽化,漂移氣體中水含量增加,導致IMS譜圖中RIP1離子峰增大,RIP2離子峰減小直至消失。在水的汽化過程中(持續時間約55~60s),漂移管中水汽濃度基本維持不變,IMS譜圖也保持如圖2(b)所示基本不變。
樣品中水完全汽化后,肌酐通過蒸發或升華過程逐漸變成氣體,在IMS圖譜中出現漂移時間為11.04ms的新離子峰,如圖2(c)所示。同時由于漂移氣體中水汽含量降低,RIP2峰重新出現。比較相同條件下去離子水的IMS譜圖,可以知道漂移時間為11.04ms的離子峰為肌酐特征離子峰。由于肌酐分子中含有易于結合質子的胺類官能團,易與質子結合形成[M+H]+(m/z 114)的分子離子[12],推測圖2(c)中肌酐的特征離子為質子化的水合離子[M+H]+(H2O)n,計算其約化遷移率為1.83cm2·V-1·s-1,與文獻[13]報道的約化遷移率(1.86~1.89 cm2·V-1·s-1)基本一致。
樣品中肌酐完全變為氣體后,在漂移氣的清潔作用下離化區中肌酐濃度逐漸降低,其特征峰強度逐漸降低,到79s左右時基本消失,譜圖見圖2(d)。
2.2 IMS漂移管溫度及玻璃毛細管進樣位置優化
不同漂移管溫度下4.42 μmol/L肌酐的CD-IMS信號強度如圖3所示。

圖3 不同漂移管溫度下肌酐CD-IMS信號強度進樣距離:5cm
可以看出在160℃到200℃范圍內,肌酐信號強度隨漂移管溫度的提高而逐漸增大。這主要是因為高的漂移管工作溫度有助于肌酐的快速蒸發或升華,從而在離化區獲得更高濃度的肌酐氣體及更大的響應信號。下文實驗中漂移管工作溫度保持為200℃。
玻璃毛細管的進樣位置(玻璃毛細管開口端插入進樣口的距離)對肌酐的CD-IMS信號強度有較大影響。圖4是不同玻璃毛細管進樣位置下肌酐的CD-IMS信號強度。當玻璃毛細管進入進樣口深度小于5cm時,毛細管開口位于CD電暈針尖前方(電暈針尖與漂移氣出口之間),樣品中的大部分肌酐分子在漂移氣作用下被直接吹出漂移管,未能形成離子,導致肌酐特征峰信號很小。當玻璃毛細管進入進樣口深度為5cm時,毛細管開口處與CD電暈針尖基本齊平,在CD放電區域可以獲得較高的肌酐分子濃度,從而得到較大的肌酐信號。當玻璃毛細管進入進樣口深度超過5cm時,玻璃毛細管開口處位于CD電暈針后方(電暈針與第一級漂移管之間),毛細管外壁積累的表面電荷對電暈放電產生較大影響;而且毛細管開口處與CD電暈針尖距離增大也導致放電區域肌酐分子濃度降低,這些都導致了肌酐信號的減小。

圖4 不同玻璃毛細管進樣位置下肌酐CD-IMS信號強度漂移管溫度:200℃
2.3 肌酐樣品的IMS檢測
配制一系列濃度的肌酐樣品,在優化后的工作參數下對每個濃度樣品進行12次檢測,得到肌酐的CD-IMS響應-濃度曲線如圖5所示。

圖5 肌酐CD-IMS響應-濃度曲線
肌酐在0.88 μmol/L ~ 8.80 μmol/L范圍內線性回歸方程為y=0.03874x+0.00712,相關系數R2=0.98,基于3倍噪聲計算的檢測限(Limit of Detection,LOD)為0.087 μmol/L,遠低于健康人的Scr值。
2.4 羥苯磺酸鈣和維生素C對肌酐檢測的影響
圖6為羥苯磺酸鈣、維生素C樣品以及它們與肌酐混合樣品的CD-IMS譜圖,其中(a)、(b)分別為高濃度羥苯磺酸鈣與維生素C樣品的CD-IMS譜圖,而(c)、(d)為肌酐分別與羥苯磺酸鈣、維生素C混合樣品的CD-IMS譜圖。

圖6 羥苯磺酸鈣、維生素C以及與肌酐混合樣品的CD-IMS譜圖(a).4780 μmol/L羥苯磺酸鈣;(b) .567 μmol/L維生素C;(c).4.42 μmol/L肌酐 +1.20 μmol/L羥苯磺酸鈣;(d). 4.42 μmol/L肌酐 + 4.19 μmol/L維生素C
由圖6(a)可見,羥苯磺酸鈣IMS圖譜10.74ms處出現一強度較弱的特征峰,其約化遷移率為1.88 cm2·V-1·s-1,與肌酐的約化遷移率不同。圖6(b)維生素CIMS圖譜在12.19 ms處有一較弱特征峰a,12.80ms處有一較強特征峰b,約化遷移率分別為1.66 cm2·V-1·s-1和1.58 cm2·V-1·s-1,均與肌酐的約化遷移率不同。維生素C具有較強的還原性,其水溶液不穩定,容易被氧化成脫氫維生素C,在正離子模式下的IMS譜圖中可見較強的特征離子峰。
圖6(c)、(d)樣品分別為4.42 μmol/L肌酐和1.20 μmol/L羥苯磺酸鈣混合溶液、4.42 μmol/L肌酐和14.19 μmol/L維生素C混合溶液。這是因為根據文獻[4]報道,當按照建議劑量服用羥苯磺酸鈣藥品時,體內血清羥苯磺酸鈣濃度將會穩定在15 mg/L(35.85 μmol/L)以下,其濃度量級與Scr相當。正常人體血漿中維生素C含量在4mg/L(9.56 μmol/L)以上,其濃度量級同樣與Scr相當。從圖6(c)、(d)可以看出混合樣品的譜圖中除了肌酐的特征離子峰和反應物離子峰外,沒有出現其它明顯的干擾峰。
對兩種混合樣品分別進行6次重復檢測,與肌酐樣品的CD-IMS響應信號進行比較。4.42 μmol/L肌酐樣品的IMS信號強度為0.183±0.019 a.u.,肌酐與羥苯磺酸鈣混合樣品的IMS信號強度為0.163±0.046a.u.,與肌氨酸氧化酶法相比本方法中羥苯磺酸鈣對肌酐檢測的負干擾較小;肌酐與維生素C混合樣品的IMS信號強度為0.175±0.016a.u.,與肌酐樣品信號強度基本相當,可見維生素C對于肌酐的IMS檢測影響很小。
肌酐的肌氨酸氧化酶檢測法是通過檢測肌酐在酶作用下降解產生的H2O2濃度來確定肌酐濃度,羥苯磺酸鈣、維生素C等可消耗H2O2,從而對肌酐檢測產生負干擾。而在IMS檢測方法中,由于肌酐含有胺類官能團,很容易形成正離子,羥苯磺酸鈣、維生素C等對肌酐與反應離子之間的分子離子反應影響較小,從而對肌酐的IMS檢測干擾較小。IMS可作為肌氨酸氧化酶法的補充用于肌酐檢測。
3 結論
利用自制CD-IMS系統實現對肌酐樣品檢測,線性范圍0.88 μmol/L~ 8.80 μmol/L,基于3倍噪聲的檢測限為0.087 μmol/L。對肌酐和羥苯磺酸鈣、維生素C的混合樣品檢測實驗證實羥苯磺酸鈣、維生素C對肌酐的IMS檢測影響很小。IMS方法操作簡便,在肌酐的快速檢測方面具有良好的應用前景。

