米諾環素對神經病理性疼痛大鼠海馬促炎性細胞因子表達的影響
李永男 車守梅 張 祁 杜仁峰 王洪財 郭朝暉 赫丹丹
神經病理性疼痛(neuropathic pain, NP)是最常見的慢性疼痛之一,多種病因如外傷、感染及糖尿病等均可導致其發病[1,2]。由于其發生率高、病理機制復雜、臨床治療效果欠佳,已成為神經科學領域的一大難題。既往研究者對于NP的研究主要圍繞在脊髓及其下位水平,發現初級感覺神經元的敏化及脊髓背角突觸可塑性改變是NP發病的重要機制[3,4]。然而,疼痛作為一種復雜的體驗,除了感覺成分外,還包括認知及情感成分,而認知及情緒調節則是腦的功能屬性[5]。因此,對于NP發生、發展過程中腦區特殊部位的研究已成為探索NP發病機制的新方向。已有研究表明海馬在疼痛感覺分辨、痛情緒調節等神經信息處理過程中扮演重要角色[6~8]。
近年來,神經-免疫反應在NP發病中的重要作用已得到研究者的廣泛認可,而小膠質細胞的激活在其中起到關鍵作用[1~4,9]。激活的小膠質細胞釋放炎性因子,如TNF-α、IL-1β、IL-6等,而這些促炎性因子對NP的發生、發展起到至關重要的作用。近期研究發現,小膠質細胞抑制劑米諾環素在多種NP動物模型中都觀察到具有良好的鎮痛效應,并抑制上述促炎性細胞因子的釋放[1,10]。但是,這些研究均圍繞在脊髓水平,而米諾環素是否同樣在海馬水平抑制小膠質細胞的激活、調控促炎性細胞因子的釋放還不清楚。因此,本研究通過觀察米諾環素對L5脊神經結扎橫斷所致NP模型大鼠的行為學改變以及海馬水平TNF-α、IL-1β、IL-6表達變化的影響,探討米諾環素在海馬參與NP調控的可能機制。
材料與方法
1.材料:(1)實驗動物:雄性Sprague-Dawley(SD)大鼠36只,6~8周齡,體質量220~260g。由上海斯萊克實驗動物有限責任公司提供。實驗期間大鼠分籠飼養,自然光照,自由攝水和食物1周。所有實驗操作符合我國《實驗動物管理條例》。(2)儀器和試劑:Touch Test Sensory Evaluator (EXACTA),高速低溫離心機(美國Sigma公司),酶標儀(瑞士Tecan公司),熒光定量PCR儀(瑞士ABI公司),手術器械(上海金鐘手術器械),384孔RT-PCR板(美國ABI公司),RT-PCR反應膜(美國ABI公司),PrimeScriptTMRT master mix (Perfect real time,日本TaKaRa公司),TRIzol(日本TaKaRa公司),Power SYBR Green PCR Master(美國Thermo公司),無水乙醇(國藥集團,10009218),注射用青霉素鈉(華北制藥公司,F5082102),米諾環素(源葉生物公司,S17015-5g)。
2.模型制備:按照完全隨機法將大鼠36只分成4組,每組9只,正常組(Z組)、假手術組(J組)、模型+生理鹽水組(MS組)及模型+米諾環素組(MM組)。采用大鼠左側L5神經結扎橫斷(L5spinal nerve transection, L5-SNT)術制備大鼠NP模型[11]。MS及MM組大鼠腹腔注射3%水合氯醛(10ml/kg)麻醉后,將大鼠俯臥位固定在鼠板上,皮膚消毒后在L4~S1水平沿脊椎中線作縱行切口,逐層分離左側椎旁肌肉組織,暴露L6橫突后用咬骨鉗咬除L6橫突,在靠近L5背根神經節處結扎神經,并在遠端切斷,創面撒青霉素干粉后依次縫合肌肉和皮膚。J組僅暴露L5神經而不予以結扎及橫斷。MM組于SNT神經病理性疼痛模型建立后每天給予米諾環素40mg/kg腹腔注射,而MS組給予同等劑量的生理鹽水(均在每次動物行為學測定前15h給藥)。
3.觀測指標:(1)行為學檢測:采用up-and-down方法[12],分別于術前1天,術后1、2、3、7和11 天測定大鼠50%機械刺激縮足閾值 (paw withdrawal threshold,PWT)。測定前將大鼠置于金屬網為底的透明有機玻璃箱內30min,使之逐漸安靜并適應實驗環境。選用0.2、0.4、1.0、1.4、2.0、4.0、6.0、8.0、10.0、15.0g不同刻度的Von Frey絲對大鼠左后肢足底部進行機械性刺激,大鼠出現抬足或舔足行為則為陽性反應,記錄標度。以2g作為初始強度,若陰性,則更換相鄰大一級刻度,若陽性,則更換相鄰較小刻度,如此反復,記錄以第1個陽性反應前一點為起點的6個連續數值,計算大鼠50% PWT。(2)海馬促炎性細胞因子水平測定:大鼠行為學測定結果表明Z組及J組大鼠機械痛閾在不同時間點差異無統計學意義。因此,將J組作為陰性對照組,測定機械性痛閾后,選擇術后不同時間點2、7、11天,隨機取J組、MS組及MM組大鼠并處死(每組每個時間點3只),立即剝離大腦,分離海馬組織迅速置于-80℃液氮中保存。按照Trizol法提取海馬組織總RNA,取總RNA 0.5μg 反轉錄合成cDNA,再以cDNA為模板進行PCR擴增。PCR反應條件為:95.0℃ 3min;95.0℃ 10s;60.0℃ 30s,共進行40個循環,3種細胞因子測定條件相同。反應在熒光定量PCR儀(美國ABI公司)上進行。檢測結果以GAPDH為內參,然后依據2-△△CT法進行相對定量分析[13]。基因引物及引物序列見表1。
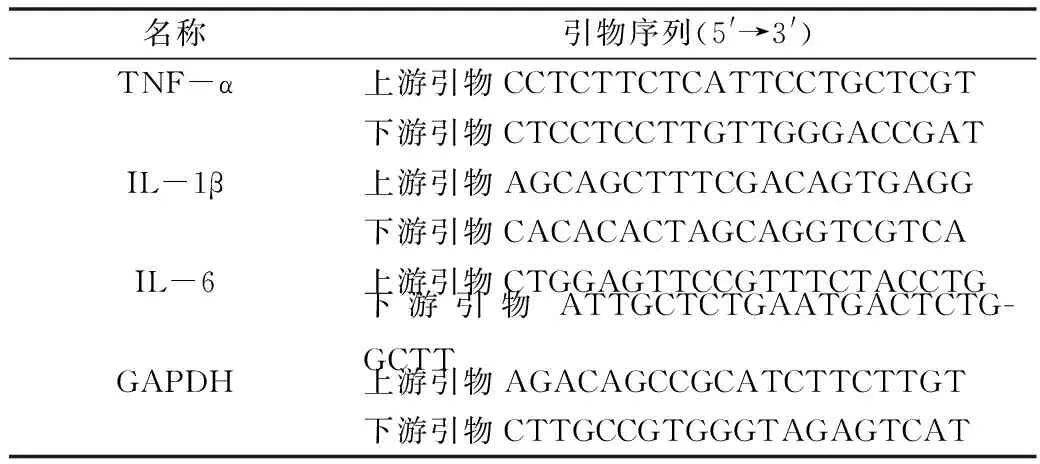
表1 PCR引物及序列
結 果
1.行為學檢測:術前1天4組大鼠痛閾值比較,差異無統計學意義(P>0.05)。術后1天,MS組及MM組大鼠表現出術側足趾并攏、背屈、輕度外翻且常處于懸空位,無自殘及跛行表現。MS組大鼠術后第2、3、7及11天行為同術后1天相似,而MM組大鼠逐漸趨于正常。Z組及J組大鼠一般狀態及行為表現較前無明顯變化。與術前1天比較,MS組大鼠術后術側PWT迅速降低(P<0.01),與Z組及J組比較,MS組大鼠手術側50% PWT明顯下降(P<0.01)。與術前1天比較,MM組大鼠術后手術側PWT亦明顯下降(P<0.01),除術后第3天外,其余各時間點大鼠PWT明顯低于Z組及J組(P<0.05)。MM組大鼠術后第3、7、11天術側PWT較MS組大鼠明顯增高(P<0.05)。Z組與J組的50%PWT比較,差異無統計學意義(P>0.05)。詳見圖1。
2.海馬促炎性細胞因子水平測定:大鼠行為學測定結果表明Z組及J組大鼠機械痛閾在不同時間點差異無統計學意義。因此,將J組作為陰性對照組。
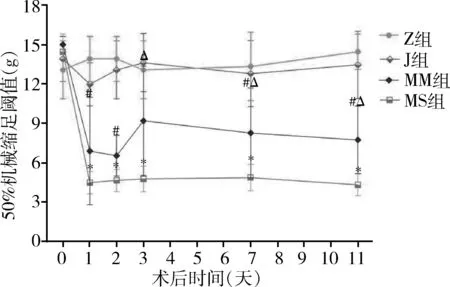
圖1 米諾環素對L5-SNT大鼠機械痛閾的影響MS組大鼠PWT與術前1天、Z級及J組比較,*P<0.01;MM組大鼠PWT與Z組及J組比較,#P<0.05;MM組大鼠PWT與MS組比較,ΔP<0.05
與J組比較,MS組大鼠海馬TNF-α于術后第2天開始增高,第7天達高峰,至術后11天仍保持較高水平(P<0.05),與MS組比較,MM組TNF-α水平在術后2、7、11天表達均下降,其中以第7天最為顯著(P<0.05,圖2A)。與J組比較,MS組大鼠海馬IL-1β在術后第11天表達明顯上調(P<0.05),而與MS組比較,MM組大鼠IL-1β表達均下調,但無統計學差異(圖2B)。與J組比較,MS組大鼠海馬IL-6含量在術后第2天表達增高(P<0.05),并且在術后第7天、11天仍處于較高水平,應用米諾環素后,其含量在術后第2、7、11天表達均下調(圖2C)。
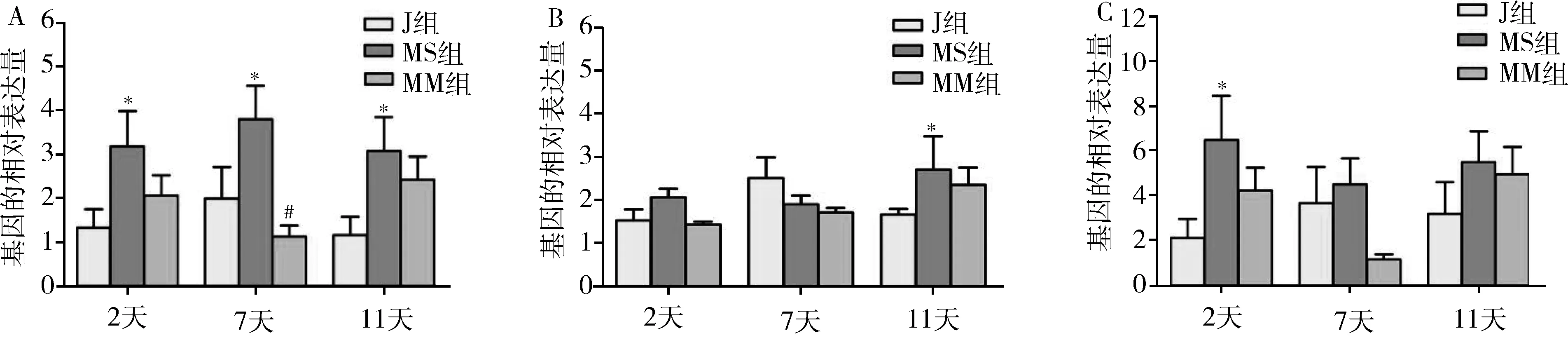
圖2 米諾環素對L5-SNT大鼠海馬水平TNF-α、IL-1β、IL-6表達變化的影響A.TNF-α;B.IL-1β;C.IL-6。與J組比較,*P<0.05;與MS組比較,#P<0.05
討 論
疼痛是一種復雜、多維的體驗,除感覺成分外,情緒及認知亦是其重要組成部分。臨床上,NP患者常常伴有記憶能力減退,并且有超過50%的患者伴有抑郁、焦慮樣負性情緒,但目前由于對于痛性腦機制的認知不足,使得新型鎮痛藥的開發和個體化治療方式的研究陷入瓶頸。近來已有研究報道,海馬是疼痛等傷害性信息加工及修飾的關鍵腦區,但具體機制尚未闡明[6~8]。
以往的大量研究證實,膠質細胞所介導的神經炎性反應在NP發生和維持中扮演重要角色[1,3,4,9]。此過程中,小膠質細胞的形態、增殖能力、基因表達和功能迅速發生變化,并通過神經遞質受體的表達、信號轉導通路的激活以及大量炎性介質的釋放與神經元、星形膠質細胞以及其他免疫系統細胞相互交流,成為NP發生、發展的基礎。米諾環素是一種半合成四環素類抗生素,除了其高效、廣譜的抗菌作用外,還具有抗炎、抗細胞凋亡、免疫調節及神經保護等多種作用,并且在多種NP動物模型中都觀察到米諾環素的應用具有較好的鎮痛效果[1,14]。目前,多數研究者認為其鎮痛機制主要與其抑制NP過程中小膠質細胞的激活、調節突觸間傳遞、減少促炎性介質如TNF-α、IL-1β、IL-6的表達和釋放有關[1,10,14,15]。但上述研究主要圍繞脊髓及其下位水平,而對于NP發病過程中在海馬水平是否同樣伴有小膠質細胞的激活以及促炎性細胞因子的釋放還不十分清楚。
本研究發現應用米諾環素后,L5-SNT神經病理性疼痛大鼠的機械性異常疼痛明顯改善。與此同時,通過RT-PCR法檢測發現,與對照組比較,SNT大鼠海馬水平TNF-α、IL-1β、IL-6都有不同程度的表達上調,而腹腔內注射米諾環素后,上述促炎性細胞因子的表達及釋放均有不同程度的降低。
TNF-α是一種具有廣泛生物學功能的促炎性細胞因子,在NP的神經-免疫調節機制中發揮著重要作用。近來,在多種NP動物模型中都觀察到脊髓背角TNF-α及其受體水平表達增加,而應用TNF-α抑制劑干預后,實驗動物脊髓背角TNF-α及其受體水平明顯下降并且疼痛得到明顯緩解[16,17]。在臨床方面,脊髓損傷(SCI)且伴有NP的受試者與對照組比較,外周血清TNF-α水平增加約70%[18]。對于海馬水平,Martuscello等[19]發現大鼠海馬水平TNF的表達上調可導致實驗大鼠出現持續的疼痛癥狀,而抑制其在海馬水平的表達后,大鼠NP的相關行為亦明顯改善[20]。本研究發現與對照組比較,模型組大鼠海馬TNF-α于術后第2天開始增高,在第7天達高峰,并且術后11天仍保持較高水平。應用米諾環素后SNT大鼠海馬TNF-α的表達明顯下調,其中以術后第7天下調最為顯著。既往的研究表明,TNF-α可通過提高神經元的興奮性、調節突觸的可塑性、激活疼痛信號轉導通路以及激活更多免疫細胞等參與NP的產生及維持[3,4,9]。由此,研究推測TNF-α是海馬參與疼痛調控的關鍵因子,而降低海馬TNF-α表達是米諾環素的重要作用機制之一。
IL-1β是IL-1家族的成員之一,廣泛地參與NP過程中細胞因子的級聯反應及疼痛信號轉導,在NP的調控中亦扮演重要角色。Pilat等[21]在慢性坐骨神經壓迫損傷(CCI)所致NP大鼠的研究中發現,CCI術后大鼠出現異常性疼痛和痛覺過敏且伴隨脊髓IL-1β mRNA水平的顯著上調,而鞘內注射IL-1受體拮抗劑后大鼠的痛覺過敏得到緩解。在海馬水平,Del等[22]發現CCI對Wistar Kyoto(WKY)大鼠觸覺閾值無明顯影響,海馬內IL-1β表達亦無明顯變化,而坐骨神經分支選擇性損傷(SNI)可導致WKY大鼠出現超敏反應且伴有手術對側海馬IL-1β mRNA水平顯著升高。在本研究中,筆者發現海馬IL-1β水平在術后第11天表達明顯上調,但在SNT術后早期及11天后并無明顯變化,這與Del等[22]研究報道具有一定的一致性。出現上述不同結果的原因可能與疼痛模型和大鼠品系的差異相關。應用米諾環素后在不同時間點IL-1β的表達均降低,但與對照組比較差異無統計學意義。說明米諾環素對海馬IL-1β的表達有一定的影響,但其并不是米諾環素的主要作用機制。
IL-6是一種多效能細胞因子,對中樞神經系統內神經元的分化、再生及神經保護方面起著重要作用。近來研究表明,IL-6也參與對傷害性感受的加工和病理性疼痛的調節。Brázda 等[23]在CCI所致NP大鼠模型的研究中發現,CCI大鼠L4~L5以及C7~C8水平背根神經節內IL-6及IL-6受體(IL-6R)mRNA水平均較假手術組明顯增加。在腦區紅核(RN)參與NP調控的研究中,Ding等[24]研究發現,SNI大鼠手術對側RN內IL-6和IL-6R水平在術后第3周顯著增加,而術后第3周在手術對側RN內注射抗IL-6抗體后,大鼠機械性異常性疼痛明顯改善。本研究發現海馬IL-6水平在SNT術后第2天開始明顯增高,并且在第7天、11天仍處于較高水平。而應用米諾環素后,在不同時間點IL-6表達均下調,其中術后第7天最為顯著。因此,研究推測IL-6可能是海馬參與NP調控的另一個關鍵因子,而抑制海馬IL-6的表達是米諾環素的鎮痛機制之一。但迄今為止,對于IL-6參與NP調控的具體機制尚不清楚,仍需進一步探索。
綜上所述, SNT可導致大鼠海馬TNF-α、IL-1β、IL-6的水平上調,而米諾環素的應用能改善SNT大鼠的疼痛行為并抑制TNF-α、IL-1β、IL-6的表達及釋放,推測海馬參與NP的調控與海馬內小膠質細胞的激活及炎性介質TNF-α、IL-1β、IL-6的釋放有關。目前,對于海馬參與NP的研究尚處于初始階段,雖然本研究對于海馬參與NP的調控進行了初步探討,但對于NP過程中海馬小膠質細胞的具體表達變化規律以及其與海馬神經元、星形膠質細胞之間相關信號通路和關鍵信息分子的復雜網絡聯系尚不清晰,仍有許多細節及因果關系有待探究。因此,針對上述疼痛網絡的探索對于明確海馬參與NP調控及米諾環素對NP的臨床治療具有重要意義。

