長鏈非編碼RNA Beta2.7通過上調(diào)eNOS/NO通路影響內(nèi)皮細(xì)胞功能
葉 楠 龔 輝 王 昕
(復(fù)旦大學(xué)附屬金山醫(yī)院心內(nèi)科 上海 201508)
心血管疾病是目前世界范圍內(nèi)威脅人類健康、導(dǎo)致人類死亡的第一大疾病,嚴(yán)重影響我國居民健康[1-2]。血管內(nèi)皮損傷與功能障礙是心血管事件鏈上最重要的病理機(jī)制,與高血壓、冠心病等嚴(yán)重危害人類健康的心血管疾病的發(fā)生發(fā)展及其危險因素互為因果,彼此促進(jìn)[3]。血管內(nèi)皮能夠合成、釋放多種生物活性物質(zhì),其中一氧化氮(nitric oxide,NO)由左旋精氨酸在內(nèi)皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)的催化下合成,具有舒張血管、保護(hù)血管內(nèi)皮、抗炎抗氧化及阻止血栓形成等作用[4]。eNOS是一氧化氮合酶同工酶中的一種亞型,在血管內(nèi)皮細(xì)胞中特異性表達(dá),其生物學(xué)活性在被磷酸化后顯著增強(qiáng),從而促進(jìn)內(nèi)皮細(xì)胞產(chǎn)生并釋放NO[5]。eNOS/NO信號通路在調(diào)節(jié)和維持血管內(nèi)皮功能方面發(fā)揮重要的作用,eNOS活性降低和NO生成減少均可引起血管內(nèi)皮功能障礙[6-7]。
非編碼RNA (non-coding RNA,ncRNA)是指不編碼蛋白質(zhì)的RNA,包括rRNA、tRNA、snRNA、microRNA 等多種已知功能和未知功能的RNA。眾所周知,人類基因組中可轉(zhuǎn)錄的部分超過90%,但其中僅有不足2%的部分編碼為蛋白質(zhì)[8-10]。通常認(rèn)為,ncRNA不翻譯為蛋白質(zhì),在RNA 水平即能行使其生物學(xué)功能。其中,長度超過200個堿基的ncRNA分子占大多數(shù),被稱為長鏈非編碼RNA(long non-coding RNA,LncRNA);它能夠和DNA、RNA或蛋白質(zhì)結(jié)合,在多個層面實現(xiàn)對基因表達(dá)的調(diào)控[11]。LncRNA廣泛參與機(jī)體的生理和病理過程,與各心血管疾病的發(fā)生發(fā)展密切相關(guān)[12-13]。近年來,多項研究報道揭示了LncRNA與心血管疾病發(fā)生發(fā)展之間的聯(lián)系[14-15]。我們歸納了其中可能與血管內(nèi)皮損傷相關(guān)的LncRNA,概況見表1。

表1 相關(guān)LncRNA的生物學(xué)功能及其病理意義Tab 1 Biological function and pathological significance of related LncRNA
EC:Endothelial cells;I/R:Ischemia/reperfusion;VSMC:Vascular smooth muscle cell;AS:Atherosclerosis.
然而,LncRNA在血管內(nèi)皮細(xì)胞eNOS/NO信號通路中的作用仍不明確。僅有個別研究指出,LncRNA-uc001pwg.1可以在由人誘導(dǎo)多能干細(xì)胞分化而來的內(nèi)皮細(xì)胞中上調(diào)eNOS/NO通路[27];STEEL(splicedtranscriptendothelial-enriched lncRNA)與LEENE(lncRNA that enhances eNOS expression)能夠上調(diào)eNOS的表達(dá)[28-29]。因此,本研究結(jié)合既往發(fā)現(xiàn)并以此為基礎(chǔ),尋找并驗證心血管疾病相關(guān)LncRNA中調(diào)控eNOS/NO的分子,為今后以eNOS/NO為靶點進(jìn)一步探究防治心血管疾病的新策略提供實驗依據(jù)。
材 料 和 方 法
主要材料小鼠主動脈內(nèi)皮細(xì)胞(mouse aorta endothelial cells,MAECs)購于江蘇齊氏生物科技有限公司;內(nèi)皮細(xì)胞專用培養(yǎng)基(endothelial cell medium,ECM)購于美國ScienCell公司;OptiMEM培養(yǎng)基購于美國Gibco公司;生物基質(zhì)膠(BD356234 Matrigel)購于美國Corning公司;Trizol試劑、逆轉(zhuǎn)錄試劑(RrimeScript RT Master Mix)、PCR試劑(SYBR Premix Ex Taq)購于日本Takara公司;PCR相關(guān)引物由上海生工生物工程股份有限公司構(gòu)建并完成測序;eNOS與p-eNOS單克隆抗體購于美國Cell Signaling Technology公司;GAPDH內(nèi)參抗體以及二抗購于美國Proteintech公司;RIPA裂解液、細(xì)胞與組織裂解液(NO檢測用,S3090)、總NO檢測試劑盒購于上海碧云天生物技術(shù)有限公司。
慢病毒質(zhì)粒構(gòu)建慢病毒質(zhì)粒由上海吉滿生物科技有限公司構(gòu)建,并完成測序、PCR驗證與滴度測定。慢病毒作為載體攜帶有包括:空白質(zhì)粒(Negative control,NC)、LncRNA-Beta2.7過表達(dá)質(zhì)粒(LncRNA-Beta2.7)、LincRNA-p21干擾質(zhì)粒(shLincRNA-p21)、LncRNA-ANRIL干擾質(zhì)粒(shLncRNA-ANRIL)和LncRNA-H19過表達(dá)質(zhì)粒(LncRNA-H19)。其中,空白質(zhì)粒、LincRNA-p21干擾質(zhì)粒與LncRNA-ANRIL干擾質(zhì)粒攜帶有綠色熒光蛋白(green fluorescent protein,GFP)和嘌呤霉素抗性基因;LncRNA-Beta2.7過表達(dá)質(zhì)粒和LncRNA-H19過表達(dá)質(zhì)粒攜帶有嘌呤霉素抗性基因。
細(xì)胞培養(yǎng)與穩(wěn)定感染MAECs由含5%胎牛血清、1%內(nèi)皮細(xì)胞生長補(bǔ)充劑和1%青/鏈霉素雙抗的ECM培養(yǎng)基培養(yǎng)于37 ℃、5%CO2的細(xì)胞培養(yǎng)箱中,待細(xì)胞融合度達(dá)到80%~90%時按1∶3進(jìn)行傳代,取第3~7代細(xì)胞用于后續(xù)實驗。取部分第3代細(xì)胞在細(xì)胞融合度達(dá)到30%~40%時,將培養(yǎng)基置換為預(yù)先混勻有攜帶相應(yīng)基因序列的慢病毒原液的新鮮培養(yǎng)基,48 h后換液;再經(jīng)24 h后傳代,并在培養(yǎng)基中加入2 ng/mL的嘌呤霉素進(jìn)行細(xì)胞篩選,從而構(gòu)建穩(wěn)定感染的細(xì)胞株。
熒光定量PCRTrizol法提取內(nèi)皮細(xì)胞總RNA,測定樣品濃度與純度后應(yīng)用RrimeScript RT Master Mix (配成反應(yīng)體系逆轉(zhuǎn)錄總RNA為cDNA,反應(yīng)條件為37 ℃ 15 min,85 ℃ 5 s。得到cDNA樣品經(jīng)適當(dāng)稀釋后(1∶3)應(yīng)用SYBR Premix Ex Taq 配成RCP體系,上機(jī)。eNOS上游引物:5’-CAGTGTCCAACATGCTGCTGGAAATTG-3’,下游引物:5’-TAAAGGTCTTCTTCCTGGTGATG-CC-3’;GAPDH上游引物:5’-TGAAGGTCGGTG-TGAACGGATT-3’,下游引物:5’-CGTGAGTGG-AGTCATACTGGAACA-3’。擴(kuò)增條件為:第一階段:95 ℃ 30 s;第二階段:95 ℃ 5 s,60 ℃ 31 s,共40個循環(huán)。eNOS mRNA的表達(dá)水平以GAPDH為內(nèi)參進(jìn)行標(biāo)準(zhǔn)化,以2-△△CT值進(jìn)行統(tǒng)計分析。
Western blotRIPA裂解液(添加1∶100 PMSF、1∶100 PI)提取細(xì)胞總蛋白,取上清加入上樣緩沖液煮沸變性。得到總蛋白樣品經(jīng)BCA測定濃度后取10 μg經(jīng)SDS-聚丙烯酰胺凝膠電泳,70 V恒壓濕轉(zhuǎn)至PVDF膜。而后使用5%脫脂牛奶室溫封閉2 h,一抗(eNOS:1∶2 000;p-eNOS:1∶1 000;GAPDH:1∶5 000) 4 ℃孵育過夜,二抗(1∶5 000)室溫孵育45~60 min后曝光顯色。目的蛋白的表達(dá)水平以GAPDH為內(nèi)參進(jìn)行標(biāo)準(zhǔn)化。
間接法檢測NO收集細(xì)胞培養(yǎng)液上清,每組60 μL;S3090裂解液裂解細(xì)胞所得樣品,每組取20 μL經(jīng)1∶3稀釋。按照總NO檢測試劑盒說明書的流程,采用還原比色法檢測NO的含量。
劃痕實驗取6孔板,預(yù)先在背面用馬克筆做好標(biāo)記。完成慢病毒穩(wěn)定轉(zhuǎn)染的MAECs,取對數(shù)生長狀態(tài)的細(xì)胞,再次傳代并將細(xì)胞鋪板。在細(xì)胞密度達(dá)到80%~90%時,使用200 μL無菌槍頭在各孔底面劃出豎直且平行的劃痕。穩(wěn)定培養(yǎng)2 h (作為0 h),之后每隔12 h在倒置顯微鏡下觀察一次。參考馬克筆所做的標(biāo)記于固定位置觀察,并拍照記錄。
小管形成實驗預(yù)先在冰浴條件下,于96孔板中均勻加入用OptiMEM培養(yǎng)基1∶1稀釋的生物基質(zhì)膠(BD Matrigel) 100 μL,37 ℃孵育30 min。完成慢病毒穩(wěn)定轉(zhuǎn)染的MAECs,取對數(shù)生長狀態(tài)的細(xì)胞。終止消化后稀釋為1×105個/mL的細(xì)胞懸液,取100 μL覆蓋于基質(zhì)膠表面,放入細(xì)胞培養(yǎng)箱孵育。3 h后在Olympus BX43倒置熒光顯微鏡下觀察,并拍照記錄。應(yīng)用Image J Angiogenesis analyzer軟件對所得圖像進(jìn)行分析,采用小管數(shù)目(Nb branches)、小管總長度(Tot.length)、分支點數(shù)(Nb Junctions)作為量化指標(biāo)。
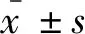
結(jié) 果
穩(wěn)定轉(zhuǎn)染小鼠主動脈內(nèi)皮細(xì)胞原代培養(yǎng)小鼠主動脈內(nèi)皮細(xì)胞生長狀態(tài)良好,呈不規(guī)則的梭形。通過嘌呤霉素篩選、傳代后,在倒置熒光顯微鏡下可以觀察到細(xì)胞內(nèi)GFP表達(dá)率高,病毒轉(zhuǎn)染效率可達(dá)90%以上。熒光定量PCR的結(jié)果顯示:與對照組相比,LncRNA-Beta2.7過表達(dá)組LncRNA-Beta2.7的表達(dá)顯著升高(P=0.047),LincRNA-p21敲低組LincRNA-p21的表達(dá)顯著降低(P=0.032),LncRNA-ANRIL敲低組LncRNA-ANRIL的表達(dá)顯著降低(P=0.009),LncRNA-H19過表達(dá)組LncRNA-H19的表達(dá)顯著升高(P=0.029),差異均具有統(tǒng)計學(xué)意義(圖1)。
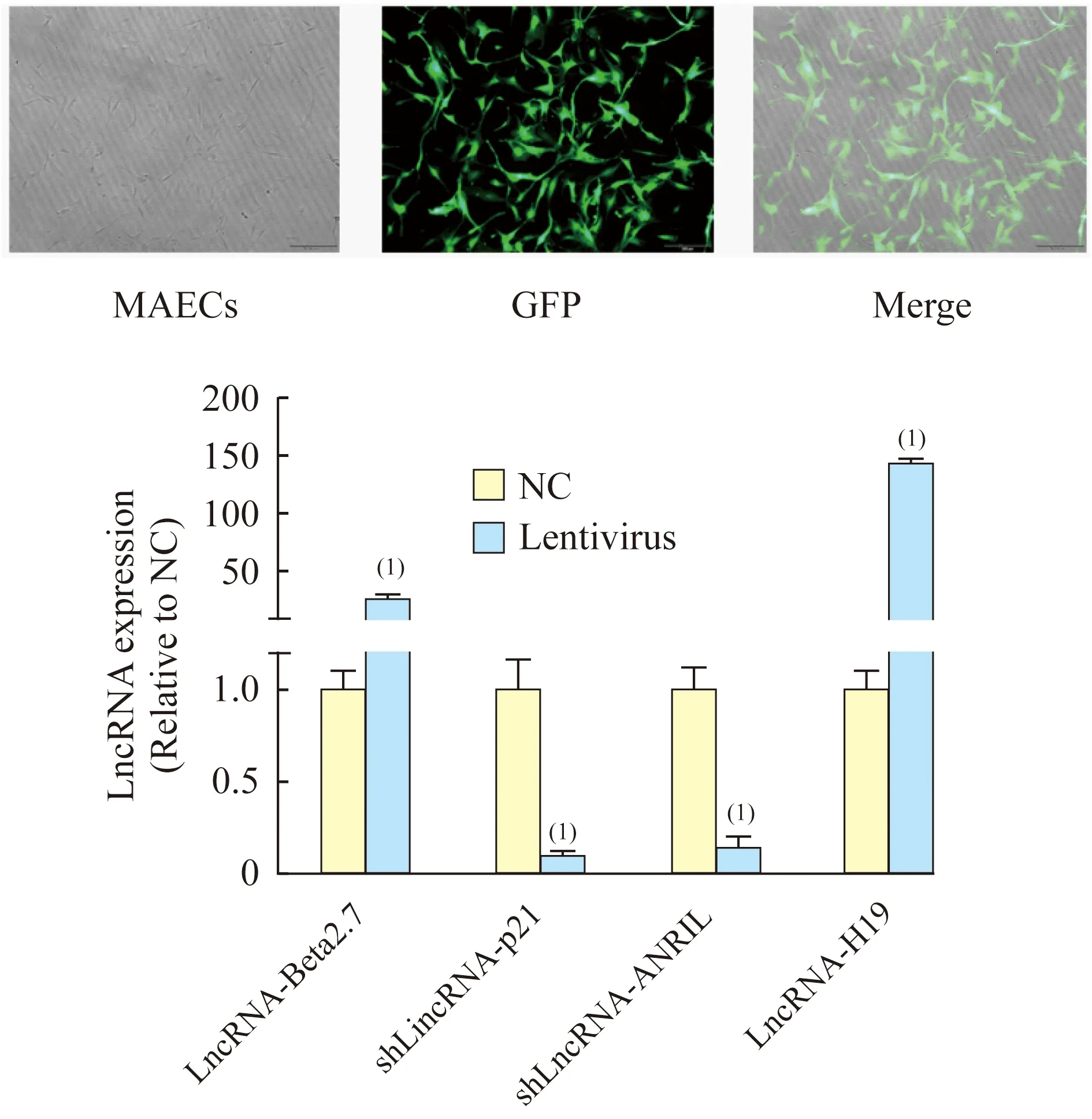
圖1 穩(wěn)定轉(zhuǎn)染小鼠主動脈內(nèi)皮細(xì)胞及其
LncRNA過表達(dá)/敲低效率
Fig 1 Stably transfected MAECs and the LncRNAoverexpression/knockdown efficiency
LncRNA對內(nèi)皮細(xì)胞eNOS mRNA表達(dá)的影響熒光定量PCR的結(jié)果顯示:與空白組相比,陰性對照組、LincRNA-p21敲低組、LncRNA-ANRIL敲低組的eNOS mRNA的表達(dá)水平無明顯改變;LncRNA-Beta2.7過表達(dá)組eNOS mRNA表達(dá)顯著升高(P=0.002),差異具有統(tǒng)計學(xué)意義;LncRNA-H19過表達(dá)組的eNOS mRNA表達(dá)下降(P=0.007),差異具有統(tǒng)計學(xué)意義(圖2)。
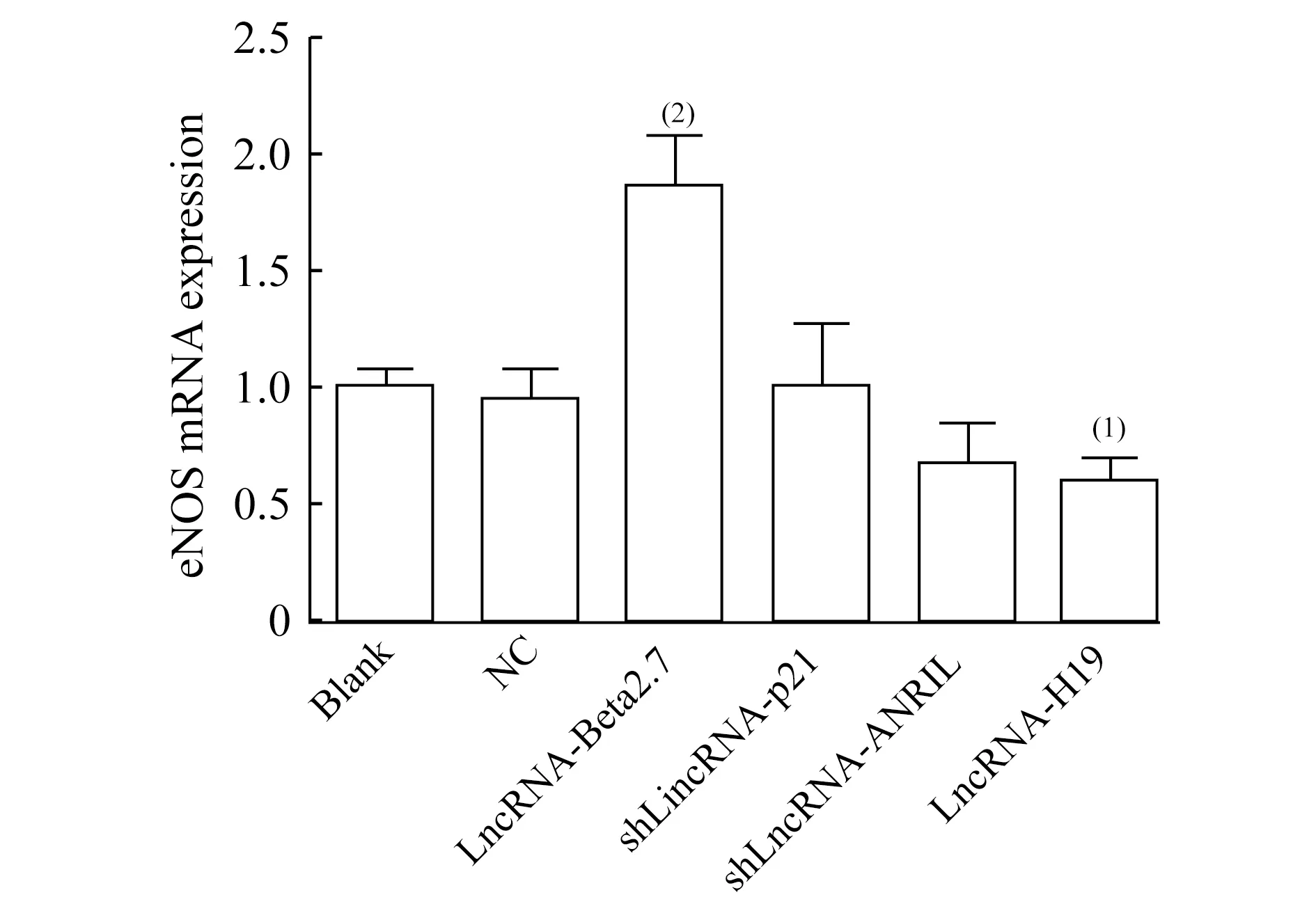
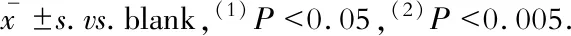
圖2 小鼠主動脈內(nèi)皮細(xì)胞eNOS mRNA的表達(dá)水平
Fig 2 The mRNA expression of eNOS in MAECs
LncRNA對內(nèi)皮細(xì)胞eNOS/p-eNOS蛋白表達(dá)的影響Western blot結(jié)果顯示:與空白組相比,陰性對照組、LincRNA-p21敲低組、LncRNA-ANRIL敲低組、LncRNA-H19過表達(dá)組的eNOS蛋白的表達(dá)水平無明顯改變,而LncRNA-Beta2.7過表達(dá)組eNOS 蛋白的表達(dá)顯著升高(P=0.036);另外,與空白組相比,陰性對照組、LncRNA-Beta2.7過表達(dá)組、LncRNA-ANRIL敲低組、LncRNA-H19過表達(dá)組的p-eNOS/eNOS比值無明顯改變,而LincRNA-p21敲低組的p-eNOS/eNOS比值則顯著升高(P=0.008)(圖3)。
LncRNA對內(nèi)皮細(xì)胞內(nèi)NO含量及其分泌水平的影響各組內(nèi)皮細(xì)胞內(nèi)的NO水平均無明顯差異;而與空白組相比,LncRNA-Beta2.7過表達(dá)組中培養(yǎng)基上清液中的NO水平則有顯著升高(P=0.019),差異具有統(tǒng)計學(xué)意義(圖4)。
LncRNA-Beta2.7對內(nèi)皮細(xì)胞遷移與血管形成能力的影響劃痕實驗結(jié)果顯示:相比于對照組,LncRNA-Beta2.7過表達(dá)組的MAECs傷口愈合速率在12 h和24 h都有顯著提高(P均<0.001);小管形成實驗的結(jié)果顯示:相比于對照組,LncRNA-Beta2.7過表達(dá)組的MAECs在單位視野內(nèi)形成的小管分支數(shù)無明顯改變(P=0.970),而在小管的總長度和分支點數(shù)上顯著升高(P=0.009,P=0.020)(圖5)。
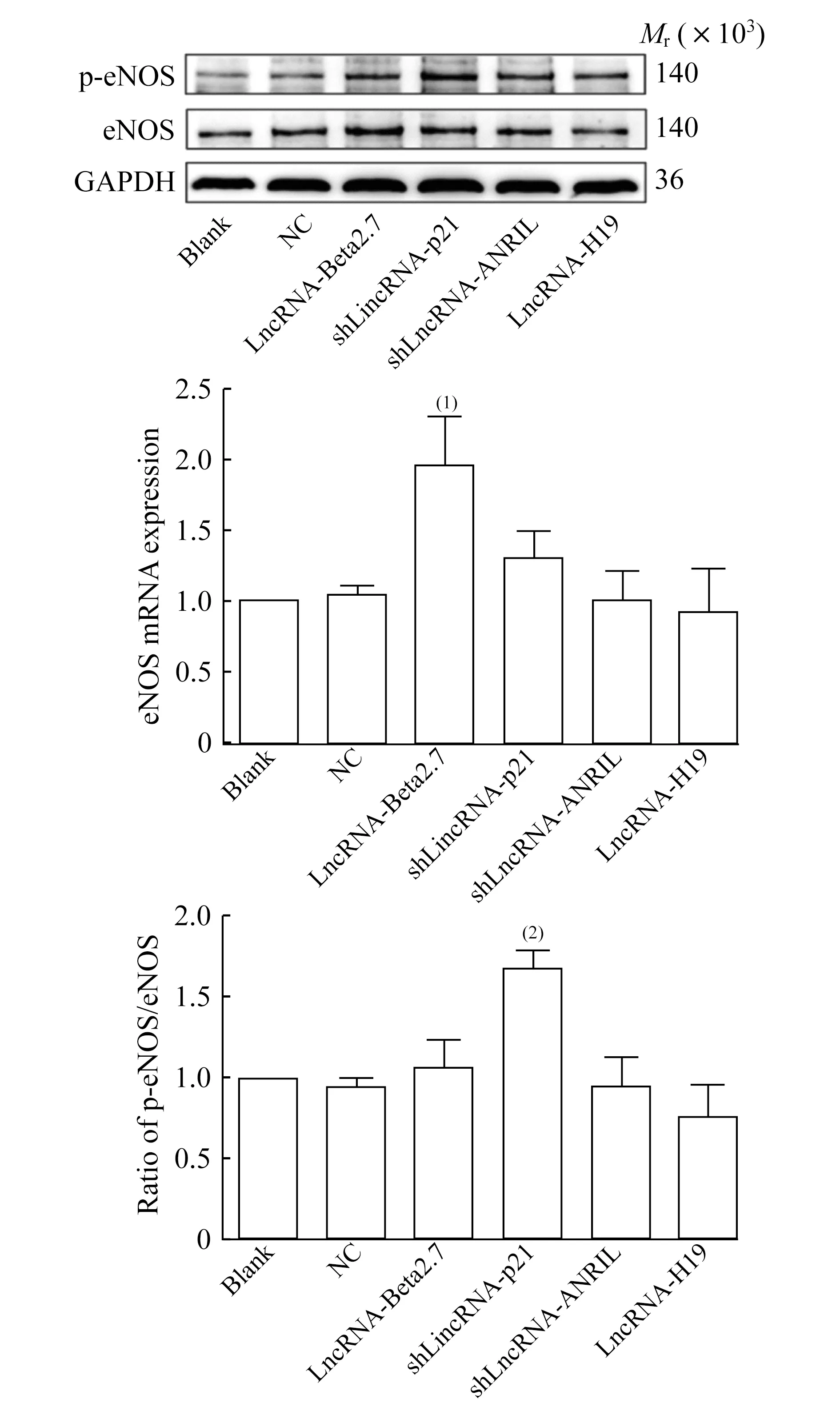
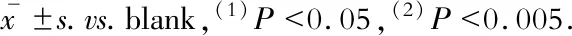
圖3 小鼠主動脈內(nèi)皮細(xì)胞eNOS、p-eNOS蛋白的表達(dá)水平
Fig 3 The protein expression of eNOS and p-eNOS in MAECs
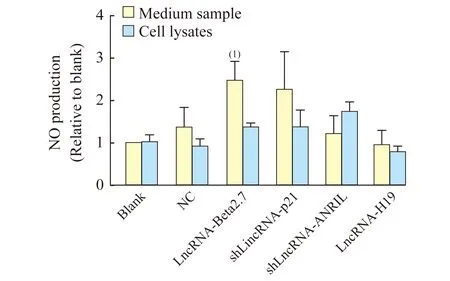
圖4 小鼠主動脈內(nèi)皮細(xì)胞內(nèi)NO含量以及NO的分泌水平
Fig 4 The NO production and secretion in MAECs
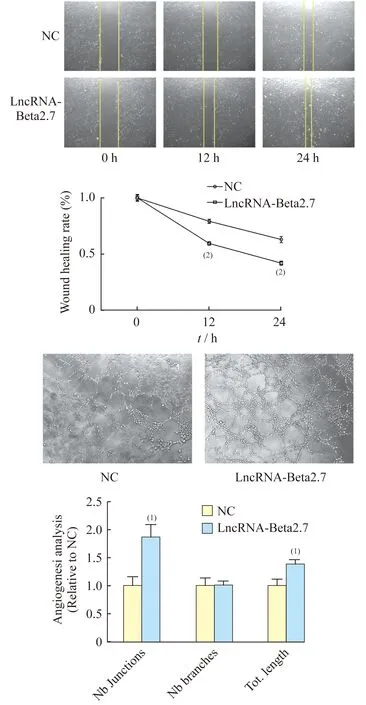
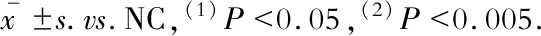
圖5 劃痕實驗和小管形成實驗
Fig 5 Wound healing assay and tube formation assay
討 論
本研究結(jié)合既往發(fā)現(xiàn)并以此為基礎(chǔ),篩選動脈粥樣硬化相關(guān)的LncRNA。在獲得可靠的LncRNA全長序列后,結(jié)合慢病毒構(gòu)建可行性,構(gòu)建了相應(yīng)LncRNA的干擾與過表達(dá)載體。未能獲得可靠的Tie-1-AS全長序列,MALAT1全長序列過長無法插入質(zhì)粒等原因使得我們無法考察其對內(nèi)皮細(xì)胞eNOS表達(dá)的影響。基于動靜脈不同的生理組成,為了使細(xì)胞實驗更接近體內(nèi)的生理病理狀態(tài),本研究選用了原代的MAECs。
本研究首先發(fā)現(xiàn)LncRNA-Beta2.7能夠上調(diào)內(nèi)皮細(xì)胞eNOS/NO信號通路。通過慢病毒穩(wěn)定轉(zhuǎn)染實現(xiàn)的過表達(dá)LncRNA-Beta2.7上調(diào)了eNOS mRNA與蛋白的表達(dá),且同步上調(diào)eNOS的磷酸化,使得p-eNOS/eNOS比值保持不變,從而上調(diào)NO的產(chǎn)量。既往研究表明,血管內(nèi)皮生長因子(vascular endothelial growth factor,VEGF)的許多生物學(xué)功能依賴于eNOS的活性被激活[30],包括誘導(dǎo)血管內(nèi)皮細(xì)胞的增殖、遷移、分化和血管形成等[31-32]。為了進(jìn)一步驗證LncRNA-Beta2.7上調(diào)eNOS/NO通路在內(nèi)皮細(xì)胞中發(fā)揮的作用,我們使用穩(wěn)定過表達(dá)LncRNA-Beta2.7的內(nèi)皮細(xì)胞進(jìn)行功能學(xué)實驗,包括劃痕實驗與小管形成實驗。發(fā)現(xiàn)過表達(dá)LncRNA-Beta2.7上調(diào)了內(nèi)皮細(xì)胞劃痕愈合速率和小管形成水平,表明LncRNA-Beta2.7能夠影響內(nèi)皮細(xì)胞的遷移與血管形成能力,這與其對eNOS/NO信號通路的調(diào)控作用相符合。而在既往研究中有學(xué)者發(fā)現(xiàn)LncRNA-Beta2.7可以幫助內(nèi)皮細(xì)胞抵御缺血再灌注損傷,是一種保護(hù)性分子[17,33],與本研究結(jié)果基本一致。
除此之外,我們還發(fā)現(xiàn)了敲低LincRNA-p21在不影響eNOS mRNA和蛋白表達(dá)水平的情況下,能夠上調(diào)eNOS的磷酸化水平,這與既往研究中LincRNA-p21促進(jìn)細(xì)胞凋亡、抑制細(xì)胞增殖的表現(xiàn)相符合[22,34]。但在后續(xù)實驗中,敲低LincRNA-p21上調(diào)NO分泌水平的表現(xiàn)卻并不穩(wěn)定,缺乏統(tǒng)計學(xué)意義。既往研究指出LncRNA-H19能夠促進(jìn)血管平滑肌細(xì)胞增殖,引起血管重構(gòu)[20-21],而我們發(fā)現(xiàn)過表達(dá)LncRNA-H19能夠下調(diào)內(nèi)皮細(xì)胞內(nèi)eNOS的mRNA水平,但在后續(xù)實驗中LncRNA-H19并沒有影響eNOS蛋白的表達(dá)、磷酸化以及NO的含量。我們推測這可能是由于在生理狀態(tài)即非病理模型中改變LncRNA的表達(dá)水平對eNOS/NO的調(diào)控作用有限。在本研究中,LncRNA-ANRIL對內(nèi)皮細(xì)胞eNOS的表達(dá)、NO的含量及其分泌水平?jīng)]有產(chǎn)生顯著的影響。
綜上所述,本研究發(fā)現(xiàn)了LncRNA-Beta2.7在內(nèi)皮細(xì)胞可以上調(diào)eNOS/NO的表達(dá)以及內(nèi)皮細(xì)胞的遷移和血管形成能力。這提示了LncRNA-Beta2.7可能起到保護(hù)血管內(nèi)皮、阻止動脈粥樣硬化等心血管疾病發(fā)生發(fā)展的的作用,為今后進(jìn)一步探究如何保護(hù)內(nèi)皮功能障礙,防治心血管疾病提供了新的思路和實驗依據(jù)。此外,LncRNA-Beta2.7如何實現(xiàn)對eNOS的表達(dá)及其磷酸化的調(diào)控,是否還有其他靶基因參與了血管內(nèi)皮功能的調(diào)節(jié),均值得進(jìn)一步研究和探討。

