二氧化鈦基Z型異質結光催化劑
梅邱峰 張飛燕 王 寧 魯聞生 宿新泰,3 王 偉*, 武榮蘭*,
(1新疆大學化學化工學院,石油天然氣精細化工重點實驗室,烏魯木齊 830046)
(2中國科學院化學研究所,膠體、界面與化學熱力學重點實驗室,北京 100086)
(3華南理工大學環境與能源學院,工業聚集區污染控制與生態修復教育部重點實驗室,廣州 510006)
0 引 言
目前,環境污染和資源短缺是亟需解決的兩大全球性問題。光催化技術,源于對植物光合作用的人工模擬,可以實現太陽能向化學能的轉化,被認為是一種綠色高效的能源轉換模式。自1972年日本科學家Fujishima和Honda發現TiO2在光電驅動下的水分解現象之后[1],TiO2便得到不少研究者的青睞,隨后在降解污染物[2-3]、水分解析氫產氧[4-6]和CO2還原[7-8]等領域上均表現出潛在的應用價值。TiO2具有廉價、無毒、化學性質穩定等優異的性質,但受限于較寬的能帶間隙和快速的光生電子-空穴對復合,難以滿足實際應用的要求。
針對以上問題,研究者們提出了元素摻雜、貴金屬表面沉積和異質結等改性方法,以致力于改善TiO2的2個缺陷。其中,選擇與TiO2的能帶結構相匹配且能帶間隙小的半導體,與TiO2構建異質結,表現出更高的量子產率和更寬的光譜響應范圍。在異質結中,能有效提高TiO2光催化性能的主要包含2類:type-Ⅱ異質結和Z型異質結。type-Ⅱ異質結的2種半導體的能帶交錯排列,光激發電子躍遷和遷移導致電子和空穴在不同半導體上累積,從而實現電子與空穴的分離。然而,這種電子遷移途徑會弱化type-Ⅱ異質結的氧化還原能力。Z型異質結具有與type-Ⅱ異質結相同的能帶排列,但電子傳遞的途徑不同,電子在半導體間的遷移路徑類似于英文字母“Z”,因此稱之為Z型光催化體系。這種獨特的電子遷移途徑導致Z型異質結在增加電子與空穴分離效率的同時,仍然能保持較高的氧化還原能力[9]。本文以TiO2基Z型異質結光催化劑為主題,介紹了TiO2光催化劑、異質結光催化劑和TiO2基Z型異質結光催化劑的能帶結構與電子遷移原則,對比了type-Ⅱ異質結與Z型異質結的異同點,討論了Z型異質結的優勢所在,并在此基礎上提出了區分type-Ⅱ異質結與Z型異質結的3種方法。另外,歸納整理了TiO2基Z型異質結在光催化領域內的優秀研究成果,展現出TiO2基Z型異質結在污染物降解、水分解以及CO2還原等領域上廣闊的應用前景。在此基礎上,我們希望能借此拓寬TiO2在光催化領域中的應用,并為研究者們提供構建新型光催化劑的一些啟發和建議。
1 TiO2光催化劑
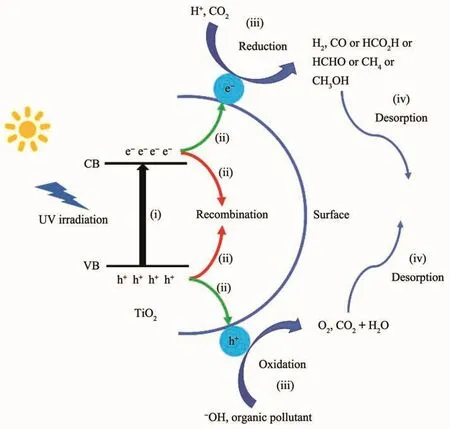
圖1 TiO2的光催化機理圖Fig.1 Photocatalytic mechanism diagram of TiO2
TiO2是一種能帶間隙為3.0~3.2 eV的半導體,在自然界中存在3種形式的晶型:銳鈦礦、金紅石和板鈦礦。晶體結構的差異會導致TiO2的能帶間隙和光催化活性發生變化。銳鈦礦的能帶間隙為3.2 eV,光催化活性最高;金紅石的能帶間隙為3.0 eV,光催化活性次之;板鈦礦不穩定,不宜作為光催化劑。TiO2的光催化過程一般包含 4步(圖1):わ TiO2能帶較寬,僅受紫外光激發,電子(e-)從價帶(VB)躍遷到導帶(CB)上,并在導帶上留下帶正電的空穴(h+);ぷ電子與空穴分離并擴散到TiO2表面,或在體相內復合而湮滅;ぺ電子和空穴與吸附在TiO2表面的反應物發生氧化還原反應,例如H+和CO2的還原、OH-和有機污染物的氧化等;ぱ 產物從TiO2表面解吸。通過時間分辨吸收光譜研究光生載流子在TiO2中形成、擴散、復合以及傳遞的反應動力學(圖2)[10]。結果顯示,各光催化反應的時間十分短暫,其中載流子在TiO2表面上復合的時間為1~10 ps,在體相內的復合時間大于20 ns,如此快速的復合并不利于其它光催化反應的進行。因此,提高TiO2光催化性能的關鍵在于能帶調控和電子-空穴分離,其中涉及到一些常用的方法包括:元素(C[11]、S[12]、N[13]、I[14]、Fe[15]、Ti[16]、Bi[17]等 )摻 雜 , 或 貴 金 屬 (Au[18]、Pt[19]、Ag[20]、Pd[21-22]等)表面沉積,或引入窄帶隙的半導體(NiO[23]、CuS[24]、NiS[25]、MoS2[26]、g-C3N4[27]、WO3[28]、Ag2O[29]、SnS2[30]等)作為光敏組分與之構建異質結等。前2種方法均存在一定的局限性:一是元素摻雜所形成的雜質能級有可能成為電子與空穴的復合中心;二是貴金屬價格昂貴且在催化反應過程中易流失。相較之下,異質結是一種更理想的光催化劑。
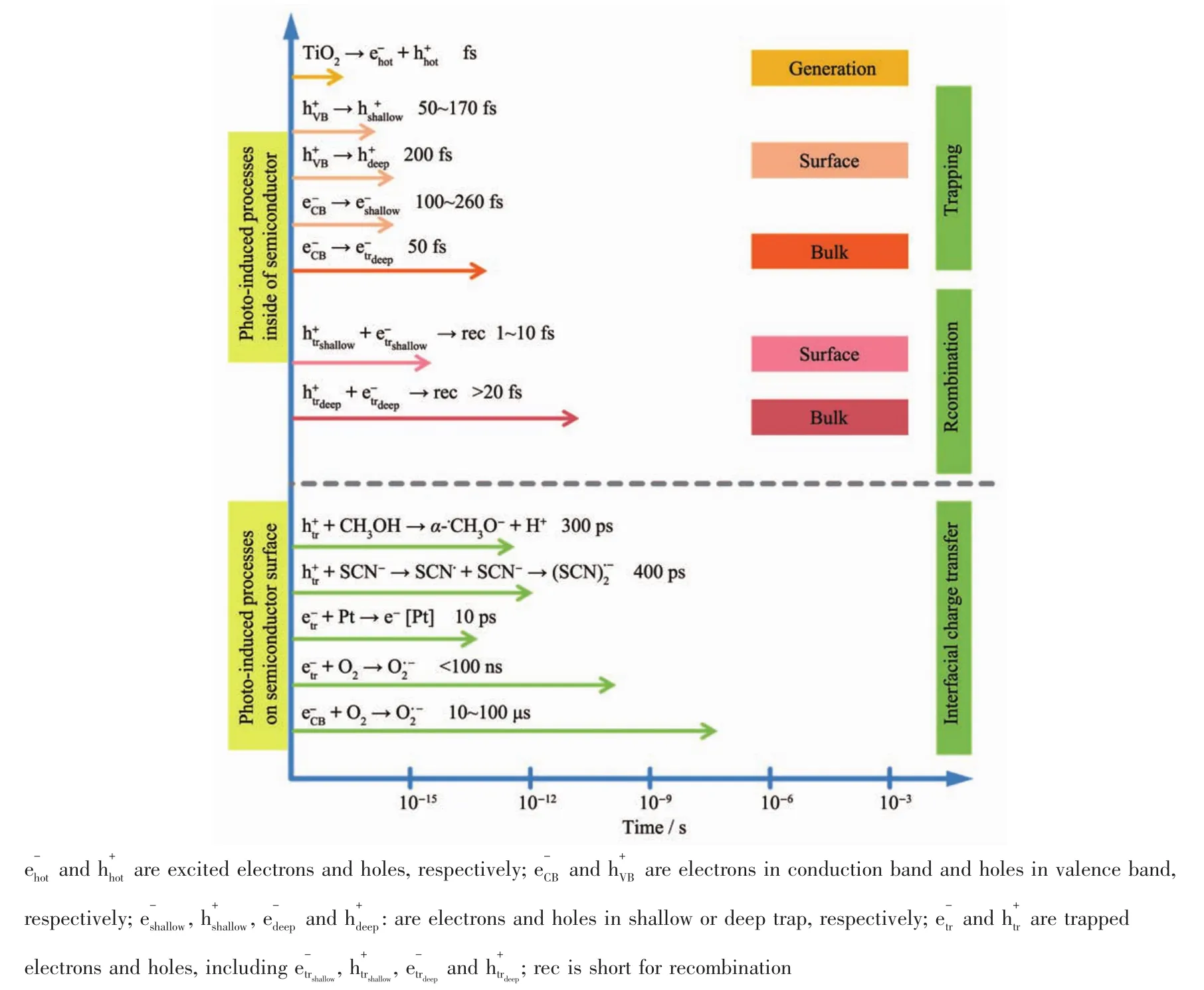
圖2 TiO2光催化中的光誘導反應及其時間尺度[10]Fig.2 Photoinduced reactions in TiO2 photocatalysis and the corresponding time scales[10]
2 異質結光催化劑
異質結,是指2種能帶結構不同的半導體相接觸的界面[31]。根據半導體的能帶排列不同,異質結可以分為type-Ⅰ異質結、type-Ⅱ異質結和type-Ⅲ異質結,它們的能帶排列如圖3[32]所示。圖3a為type-Ⅰ異質結,2種半導體(S1和S2)的能帶呈現跨越式排列。由于電子易遷移到導帶能級較低的半導體上而空穴易遷移到價帶能級較高的半導體上,導致電子與空穴均遷移到半導體2上,電子與空穴的分離效率低。圖3b為type-Ⅱ異質結,2種半導體的能帶呈現交錯式排列。電子從半導體1的導帶上遷移到半導體2的導帶上,電子在半導體2上累積;空穴從半導體2的價帶上遷移到半導體1的價帶上,空穴在半導體1上累積,最終實現了電子與空穴在空間上的有效分離。圖3c為type-Ⅲ異質結,2種半導體的能帶呈現中斷式排列,電子與空穴在界面間無遷移行為。綜合以上3種異質結,type-Ⅱ異質結是這3種異質結中提高電子-空穴對空間分離最有效的傳統異質結[33]。
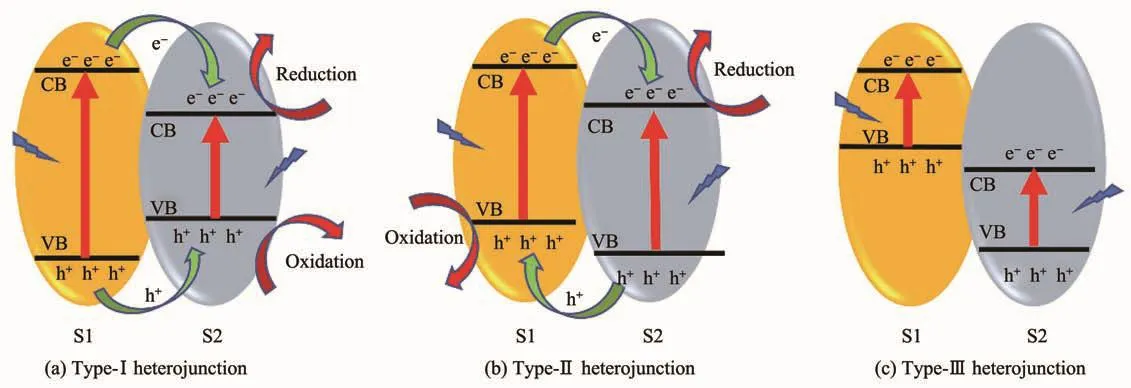
圖3 異質結的3種類型Fig.3 Three types of heterojunctions in a typical semiconductor hybrid nanocomposite
3 TiO2基Z型異質結
3.1 Z型異質結與type-Ⅱ的差異
除了以上3種傳統異質結外,TiO2-石墨烯異質結[34-36]、p-n 結[23,37-38]和 Z 型異質結[25,39-40]也具有分離電子與空穴的能力,且在電荷傳遞速度或氧化還原能力上優于type-Ⅱ異質結。其中,Z型異質結作為一種新型異質結,在能帶的排列上與type-Ⅱ異質結十分相似,均呈現為交叉式排列,而兩者的不同點在于電子的遷移方向不同(圖4)。圖4a為type-Ⅱ異質結的能帶排列與電子遷移機理,電子與空穴分別在半導體2的導帶和半導體1的價帶上累積,實現了在空間上的分離。然而,這種遷移方式削弱了光催化劑的氧化還原能力,即電子遷移到能級較低的導帶處,還原能力減弱;空穴遷移到能級較高的價帶處,氧化能力減弱。圖4b為Z型異質結的能帶排列與電子遷移機理,半導體2導帶上的電子與半導體1價帶上的空穴復合而湮滅,殘留的電子主要存在于半導體1的導帶上而空穴主要存在于半導體2的價帶上,同樣也實現了電子與空穴在空間上的分離。然而,相對于type-Ⅱ異質結,Z型異質結的優勢在于電子在較高的能級上累積而空穴在較低的能級上累積,氧化還原能力更強。Grela等[41]報道了Cu2O/TiO2復合物以Z型電子傳遞的方式,實現了CO2的還原以及阻止了Cu2O的光腐蝕效應。根據紫外光電子能譜圖(圖 5c)計算 Cu2O 的導帶(ECB,2)和價帶(EVB,2)位置分別為-1.27 和 0.76 eV,而 TiO2的導帶(ECB,1)和價帶(EVB,1)位置分別為-0.57和2.59 eV。按照圖5a的type-Ⅱ異質結的催化機理 (其中Egap,1和Egap,2分別為TiO2和Cu2O的帶隙),還原反應發生在TiO2的導帶上,氧化反應發生在Cu2O的價帶上,而水氧化產生羥基自由基(·OH)的氧化還原電勢為2.27 eV,Cu2O價帶上的空穴不足以氧化水產生·OH。然而,通過7-羥基香豆素的熒光光譜(圖5d)定量探測·OH,結果證實了·OH的存在。因此,可推測復合物并非type-Ⅱ異質結而是Z型異質結,氧化能力更強,水氧化反應發生在TiO2的價帶上(圖5b)。由這一案例可知,Z型異質結在氧化還原能力上優于type-Ⅱ異質結。

圖4 (a)type-Ⅱ異質結和(b)Z型異質結的能帶排列和電子遷移機理Fig.4 Band arrangement and electron migration mechanism of(a)type-Ⅱ heterojunctions and (b)Z-scheme heterojunctions

圖 5 Cu2O/TiO2復合物分別為(a)type-Ⅱ異質結和(b)Z 型異質結的光催化機理;(c)Cu2O (上)、純 TiO2 (中)、Cu2O/TiO2異質結構(下)的紫外光電子能譜,左右兩側的外推分別對應價帶和次級電子譜的起始值;(d)通過7-羥基香豆素的熒光光譜探測經λ≥305 nm光照射后Cu2O/TiO2表面·OH的存在以及相對應的·OH產量[41]Fig.5 (a)Type-Ⅱ mechanism and (b)direct Z-scheme mechanism of Cu2O/TiO2 composites;(c)Ultraviolet photoelectron spectra for Cu2O octahedral (top),pure TiO2 (center),and Cu2O/TiO2 heterostructure (bottom).Extrapolations to the left and right hand sides correspond to the onset values for the valence band and secondary electron spectra,respectively;(d)Fluorescence spectra of 7-hydroxycoumarin for probing·OH on the surface Cu2O/TiO2 during irradiation atλ≥305 nm and the corresponding production amount of·OH[41]
3.2 區分type-Ⅱ異質結和Z型異質結的方法
根據上述討論,在構建異質結時更傾向于得到Z型結構。然而,當復合物中2種半導體的能帶呈現交錯式排列時,很難去分辨復合物是屬于type-Ⅱ異質結還是Z型異質結。例如:在TiO2/g-C3N4納米復合物的研究中,Li等[42]采用簡單的飽和溶液法合成了TiO2@g-C3N4核殼納米棒陣列(圖6a),并通過第一性原理的計算和模擬,推測出TiO2導帶與g-C3N4價帶的能級差為1.34 eV,小于TiO2導帶與g-C3N4導帶的能級差1.44 eV,電子更容易從TiO2導帶向g-C3N4價帶遷移。因此,TiO2@g-C3N4核殼納米棒陣列符合Z型光催化機理,如圖6c所示。另外,Yu等[43]通過系統的理論計算,驗證了TiO2和g-C3N4之間的界面相互作用促進內建電場的形成,從而加速電子從TiO2向g-C3N4的轉移,這也印證了TiO2/g-C3N4屬于Z型異質結的光催化機理。然而,在Martin等[44]的研究中,合成的具有相同化學結構的TiO2/g-C3N4納米復合物(圖 6b)卻被認定為 type-Ⅱ異質結(圖 6d)。表1統計了現有研究中所報道的一系列TiO2/g-C3N4納米復合物。由表可知,g-C3N4和TiO2半導體復合時,有可能得到Z型異質結,也有可能得到type-Ⅱ異質結,至于造成這種結果的原因依然尚不明確。由于無法預知復合材料中異質結的種類,研究者常通過后續的測試和表征來區分它們,而區分的依據是3.1中所討論的2種異質結的差異:(1)電子傳遞的方向不同;(2)發生氧化還原的能帶位置不同。目前,用來區分type-Ⅱ異質結和Z型異質結的方法和測試包括:依靠氧化還原反應的電勢、能帶彎曲的方向和XPS偏移的方向來區分。

圖6 Z型異質結TiO2/g-C3N4納米棒陣列的SEM圖 (a)和光催化機理圖 (c)[42];type-Ⅱ異質結 TiO2/g-C3N4 的 TEM 圖 (b)和光催化機理圖 (d)[44]Fig.6 SEM image (a)and photocatalytic mechanism diagram (c)of Z-scheme heterojunction TiO2/g-C3N4 nanorods arrays[42];TEM image (b)and photocatalytic mechanism (d)of type-Ⅱ heterojunction TiO2/g-C3N4[44]
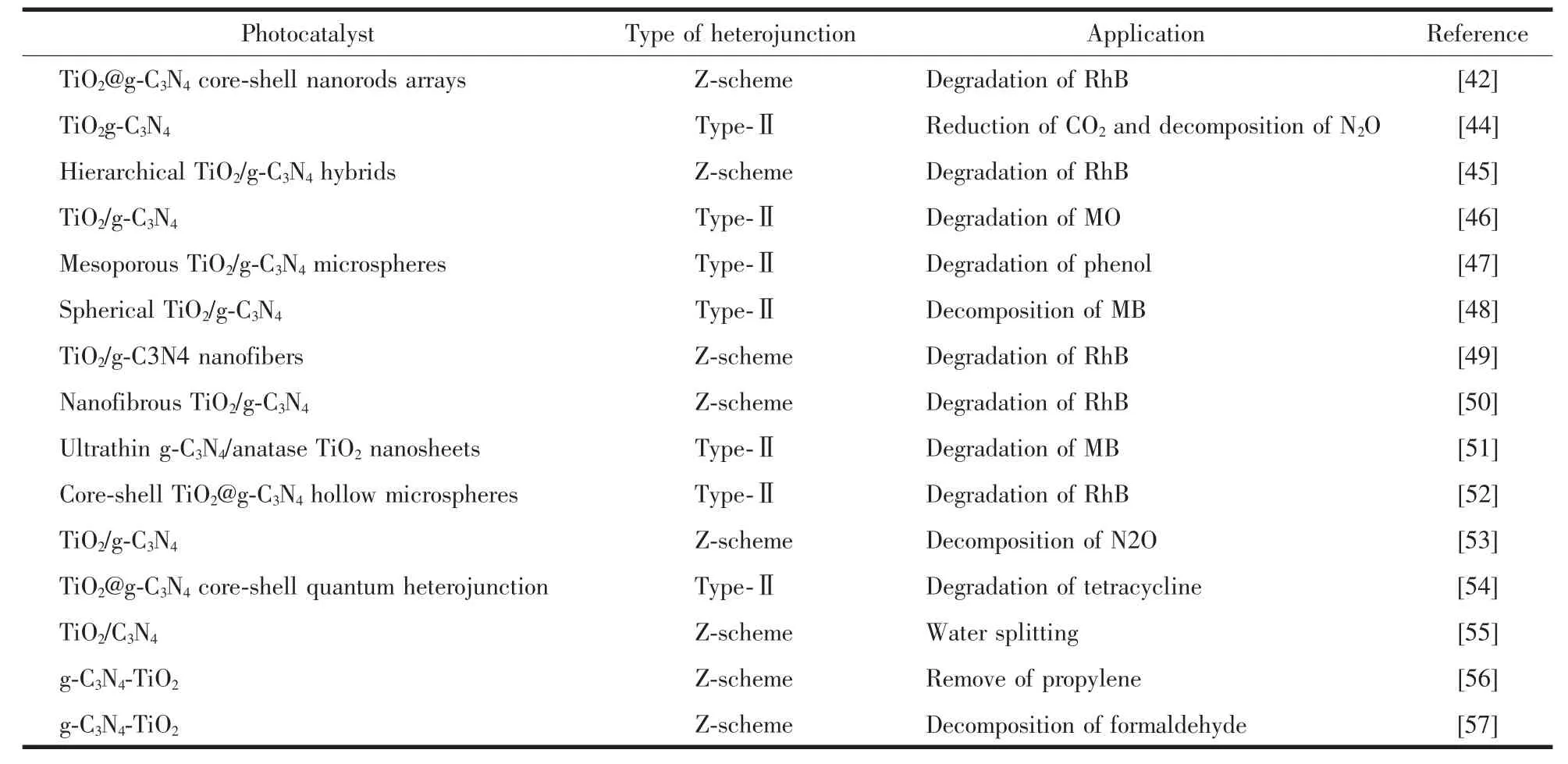
表1 不同TiO2/g-C3N4光催化劑的異質結類型和應用Table 1 Types of heterojunction and applications of different TiO2/g-C3N4 photocatalysts
3.2.1 通過氧化還原反應的電勢來區分
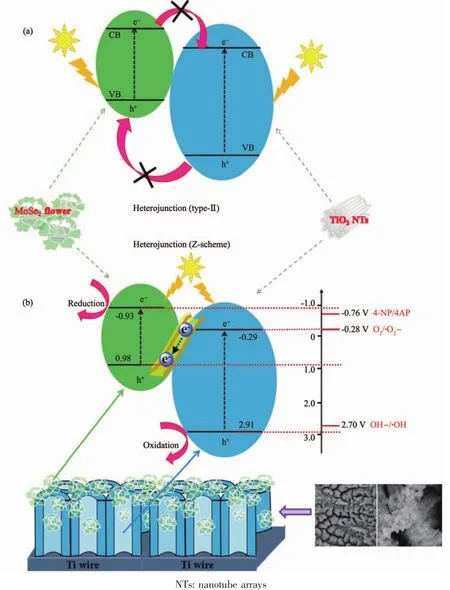
圖7 (a)type-Ⅱ異質結中電荷轉移和分離的過程;(b)提出了直接Z-scheme異質結MoSe2@TiO2納米管陣列(TNTs)復合物在人造太陽光照射下光催化降解4-NP的機理[58]Fig.7 (a)Scheme illustration for the charge transfer and separation in conventional type-Ⅱ heterojunction;(b)Proposed mechanism for the photocatalytic degradation of 4-NP over MoSe2@TiO2 nanotube arrays (TNTs)direct Z-scheme composite under artificial solar light irradiation[58]
Z型異質結的氧化還原能力大于type-Ⅱ異質結,與之相匹配的氧化還原反應的電勢范圍更寬。當反應物的氧化還原反電勢處在2個半導體的導帶或價帶之間,通過檢測該氧化還原反應產物的存在可以判斷異質結的種類:若產物存在,則光催化劑為Z型異質結。Yang等[58]選擇MoSe2和TiO2作為構建異質結的2種半導體。MoSe2的導帶和價帶位置分別為-0.93和0.98 V;TiO2的導帶和價帶位置分別為-0.29和2.91 V。跟據type-Ⅱ異質結的電荷傳遞方向(圖7a),能發生氧化還原反應的電勢范圍應在-0.29~0.98 V之間,而Z型異質結的電荷傳遞方向不同(圖7b),能發生氧化還原反應的電勢范圍應在-0.93~2.91 V。在光催化反應中,通過紫外-可見吸收光譜和以二甲基吡啶氮氧化物(DMPO)作為自由基捕獲劑的電子自旋共振譜圖,檢測到對硝基苯酚(4-NP)還原為對氨基苯酚(4-AP)以及超氧自由基(·O2)和·OH 的存在。其中 4-NP/4-AP 的標準電極電勢為-0.76 V,OH-/·OH的標準電極電勢為2.70 V。type-Ⅱ異質結不足以還原4-NP和氧化OH-,因此可以判斷MoSe2和TiO2復合形成了Z型異質結。這種方法是目前研究中最常用于確定異質結種類的方法,而其中檢測氧化還原反應和產物的手段較多,包括紫外-可見吸收光譜[58]、熒光光譜[56,59]、自由基捕獲實驗[60]以及電子自旋共振譜圖[58,61-63]。但這種方法存在一定局限性:(1)氧化還原反應的電勢必須處在2個半導體的導帶或價帶之間;(2)產物不存在時,無法判斷異質結的種類。
3.2.2 通過能帶彎曲的方向來區分
能帶彎曲是半導體材料在復合過程中常見的一種現象。半導體費米能級(EF)的差異導致電荷在半導體間的轉移,最終形成反方向的內建電場以及能帶彎曲[64]。能帶彎曲和內建電場會加速電子沿著電場的方向轉移,同時也會抑制反方向的電子轉移。Yu等[65]通過密度泛函理論(DFT)計算得到 TiO2(101)面和 CuInS2(004)面的功函數(Φ)分別為 6.6 和 5.0 eV,TiO2的費米能級低于 CuInS2的費米能級(圖 8(a,b))。因此當TiO2與CuInS2相接觸時,為平衡費米能級,電子從CuInS2向TiO2轉移而在靠近TiO2處留下帶負電區域,空穴從TiO2向CuInS2轉移而在靠近CuInS2處留下帶正電區域,同時TiO2的能帶向下彎曲,CuInS2的能帶向上彎曲(圖8c)。最終,電子只能從TiO2導帶轉移到CuInS2價帶上與空穴復合,從而構建出一種Z型光催化系統。費米能級與半導體的溫度、元素摻雜以及電子結構有關[66],理論計算得到的費米能級與實際結果仍然存在一定的偏差,因此通過能帶彎曲的方向去區分Z型異質結和type-Ⅱ異質結也存在一定的缺陷。
3.2.3 通過XPS偏移的方向來區分
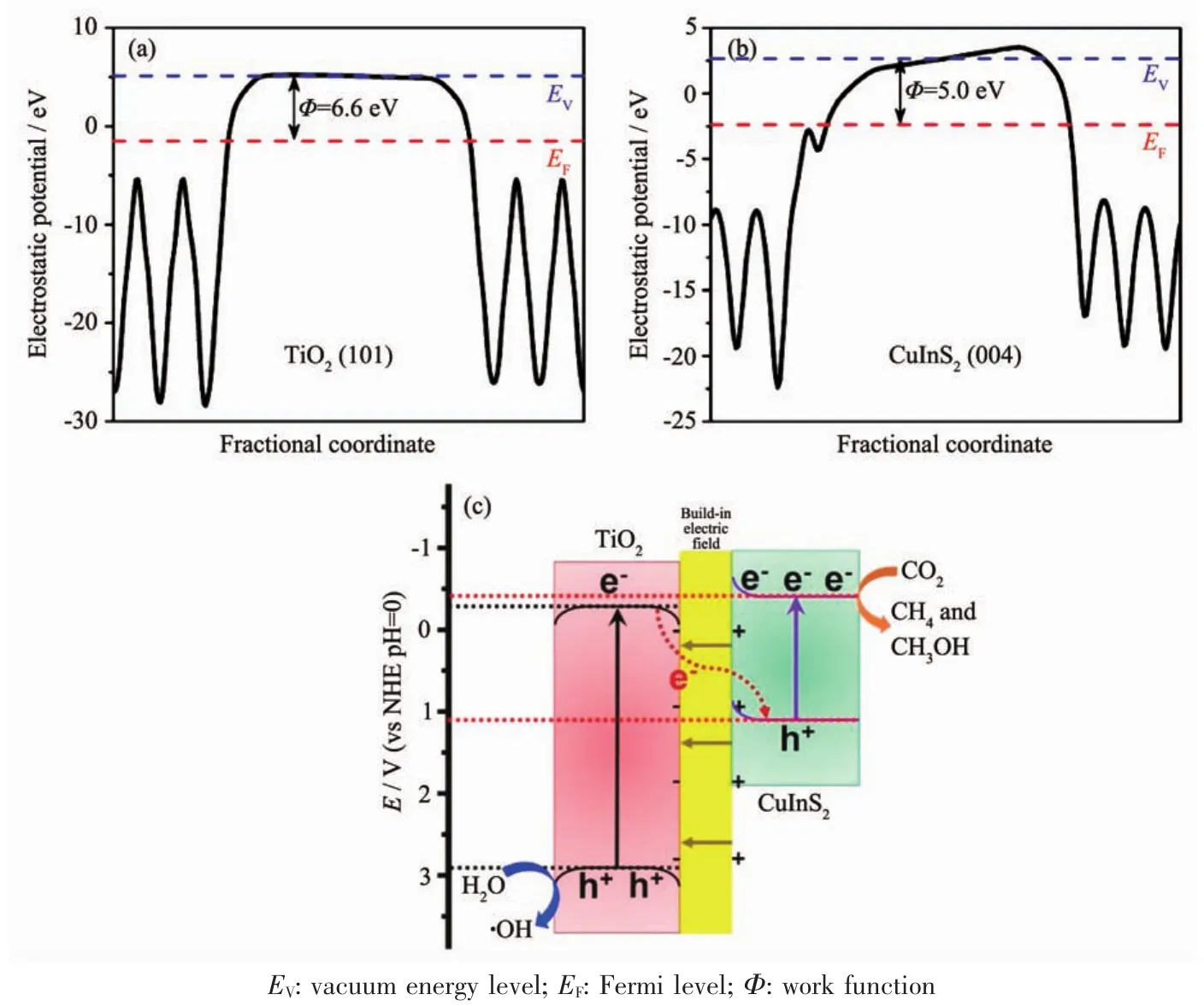
圖 8 計算(a)TiO2 (101)面和(b)CuInS2 (004)面的靜電勢;(c)在模擬太陽光照射下,TiO2/CulnS2復合物中電荷轉移和分離的示意圖[65]Fig.8 Calculated electrostatic potentials for(a)TiO2 (101)face and (b)CuInS2 (004)face;(c)Schematic illustration of the charge transfer and separation in TiO2/CulnS2 composites under simulated sunlight light irradiation[65]
異質結受光激發,電子在2種半導體間傳遞,最終導致一個半導體電子云密度的下降而另一個半導體電子云密度的升高,在X射線光電子能譜(XPS)中表現為特征峰的偏移。Z型異質結和type-Ⅱ異質結的電子遷移方向不同,對應在XPS中特征峰偏移的方向相反,因此通過XPS偏移方向也可以區分異質結的種類。Yu等[67]報道了一種原位輻射XPS方法,用于對直接Z型異質結TiO2/CdS的研究。365 nm的紫外光照射TiO2/CdS后,在Ti2p高分辨XPS譜圖(圖9b)中,特征峰向高能區偏移,證明了Ti原子周圍電子云密度的降低;在Cd3d高分辨XPS譜圖(圖9c)中,特征峰向低能區偏移,證明了Cd原子周圍電子云密度的增加。結合兩者推測出TiO2/CdS復合物符合Z型光催化體系(圖9f)。同時根據7-羥基香豆素的熒光光譜探測到復合物相較于單一組分易產生更多的·OH(圖9d),而按照 type-Ⅱ異質結的光催化機理(圖 9e),復合物不足以氧化 OH-產生·OH,進一步地證明了TiO2/CdS復合物是一種Z型異質結。由于Z型異質結賦予了復合物更強的氧化還原能力,所制備的TiO2/CdS復合薄膜對CO2的還原反應表現出高的催化活性,即CH4的轉化率達到11.9 mmol·h-1·m-2(圖 9a)。 XPS 圖譜中特征峰的偏移最直接的原因是電子云密度的變化,而造成電子云密度變化的原因不僅僅是電子的轉移。因此在利用XPS分辨異質結種類時,還需要結合其它方法加一驗證。
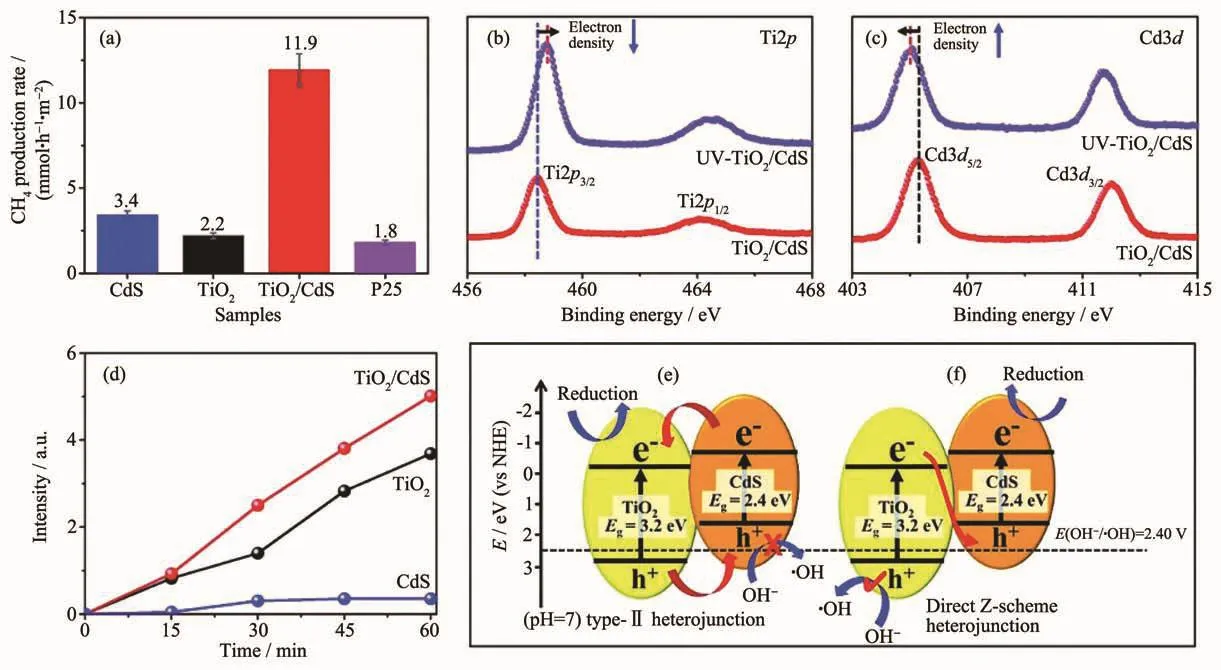
圖 9 (a)CdS、TiO2、TiO2/CdS、P25 樣品的光催化性能比較;(b,c)TiO2/CdS 在黑暗或 365 nm LED 燈照射下(UV-TiO2/CdS)的 Ti2p (b)和 Cd3d (c)的高分辨率 XPS 譜圖;(d)光照下,以 CdS、TiO2、TiO2/CdS 為光催化劑,7-羥基香豆素在 457 nm處光致發光強度隨時間的變化;TiO2/CdS復合材料作為type-Ⅱ(e)和直接Z-scheme(f)異質結的電荷載流子遷移機理示意圖[67]Fig.9 (a)Comparison of the photocatalytic performance of the CdS,TiO2,TiO2/CdS,and P25 samples;(b,c)High-resolution XPS for Ti2p (b)and Cd3d (c)of TiO2/CdS in the dark or under 365 nm LED irradiation (UV-TiO2/CdS);(d)Changes of the 7-hydroxycoumarin photoluminescence intensity at 457 nm using CdS,TiO2,and TiO2/CdSas photocatalysts under light irradiation over time;Schematic illustration of the charge-carrier migration mechanism according to the type-Ⅱ (e)and direct Z-scheme (f)heterojunction for the TiO2/CdS composite[67]
3.3 構建Z型異質結的新思路
在上述的討論中,研究者大多先合成材料,然后通過材料性質的表征來確定異質結的類型。Sun等[68]提供一種新的思路,通過改變制備方法有目的地得到了type-Ⅱ異質結或Z型異質結CdS/g-C3N4,如圖10所示。利用化學沉積法在g-C3N4上自由地沉積CdS納米顆粒,得到的是Z型異質結,而利用光沉積法將CdS納米顆粒有選擇性地沉積在g-C3N4的電子傳遞位點上,導致光生電子趨向于從g-C3N4轉移到CdS上,最終得到的是type-Ⅱ異質結。與此類似,我們發現構建的TiO2/CdS復合物的異質結種類與CdS在TiO2上的沉積方式也存在上述這種關系。譬如,離子層吸附和化學還原法是一種將CdS沉積在TiO2上的常用方法[67,69],這是一種典型的化學沉積方法,通過這種方法構建出的是Z型異質結;而光沉積法則利用紫外光激發的TiO2所具有的強還原性,將S8還原為S2-,繼而將反應體系中的Cd2+轉化為CdS而沉積在TiO2上[70-71],最終得到了type-Ⅱ異質結。
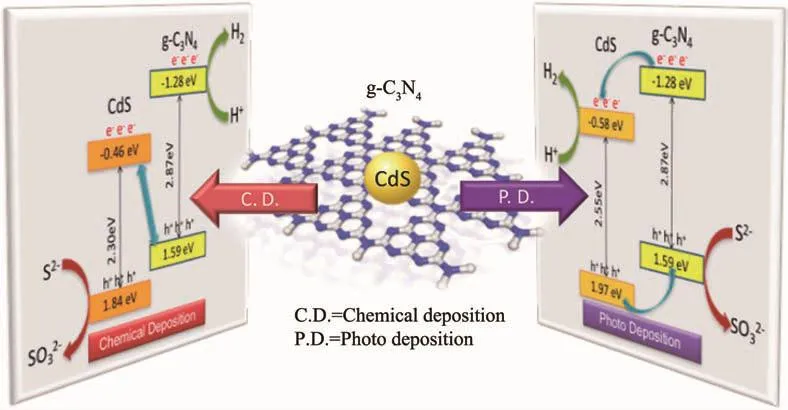
圖10 通過化學沉積和光沉積法分別制備出Z型異質結和type-Ⅱ異質結CdS/g-C3N4[68]Fig.10 Z-scheme heterojunction and type-Ⅱheterojunction CdS/g-C3N4 were prepared by chemical deposition and photo deposition,respectively[68]
另外,在最近的研究中,Dong等[72]發現TiO2/CdS復合物的異質結種類與CdS沉積在TiO2上的晶面也存在一定的關系。將TiO2選擇性地沉積在TiO2納米片的(001)晶面上,形成了 type-Ⅱ異質結;而將TiO2選擇性地沉積在TiO2納米片的(101)晶面上,形成了 Z 型異質結。 TiO2的(001)晶面(0.90 J·m-2)比(101)晶面(0.44 J·m-2)具有更高的能量密度[73],導致電子在(101)面上富集而空穴在(001)面上富集。 因此,(101)晶面作為一種電子供體易向CdS轉移電子,從而形成Z型異質結;(001)晶面作為一種電子受體易接收來自CdS導帶上的電子,從而形成type-Ⅱ異質結。受此啟發,TiO2的2種晶面同時存在時,分別來自這2種晶面的空穴和電子也會復合,從而形成一種 Z型異質結。 例如,Lv等[74]以暴露(001)高能晶面的TiO2修飾TiO2納米纖維,形成了Z型光催化反應機制。綜合而言,以上研究有目的地構建TiO2基Z型異質結提供了一些新思路,但它是否具有普適性,我們還尚未可知,需要進一步地驗證。
3.4 Z型異質結的分類
Z型異質結的概念最早是在1979年由Bard等在模擬植物光合作用的基礎上提出[75]。這種傳統的Z型異質結(圖11a)由2種沒有物理接觸的半導體以及氧化還原(Oxd/Red)介質組成,其中氧化和還原介質分別是電子的受體和供體。常用的氧化還原介質包括:IO3-/I-和Fe3+/Fe2+[76]。電子在傳統Z型異質結中的轉移過程為:來自半導體2上的光生電子還原氧化介質,還原介質接收來自半導體1上的空穴而被氧化,最終導致電子在半導體1導帶上累積而空穴在半導體2價帶上累計,實現了電子與空穴在空間上的分離。對于這種傳統的Z型光催化體系,其受限于液相氧化還原介質的影響而難以適應更復雜的光催化反應環境。
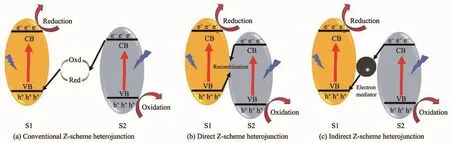
圖11 三種Z型異質結Fig.11 Three types of Z-scheme heterojunction
2006年,Tada等[77]基于對 CdS-Au-TiO2三組分光催化劑的研究,第一次提出了全固態Z型異質結的概念。前期,全固態Z型異質結主要是三元體系的間接Z型異質結(圖11c),包含在2種半導體和夾雜在中間的電子媒介,電子媒介一般由石墨烯[78-79]或貴金屬(Au[77,80]、Ag[81]、Pt[82]等)組成。 石墨烯具有高的電荷遷移率,貴金屬具有大的功函數,兩者都易接受來自半導體導帶上的電子。正是由于這種特性,固態電子媒介會促進導帶電勢較低的半導體上的光誘導電子與價帶電勢較高的另一半導體上的空穴結合,而氧化還原能力較強的電子和空穴仍保留在2個半導體上。與傳統Z型異質結類似,最終也形成了電子與空穴在空間上的分離,這種分離給催化劑帶來了更高的催化活性和氧化還原能力。譬如,Liu等[81]在Tada的基礎上構建了一種基于CdS納米線的三元CdS-Au-TiO2的Z型異質結。相對于CdS-TiO2和純的CdS,這種Z型異質結光催化劑展現出較快的析氫速率(1 910 μmol·g-1·h-1),同時也抑制了 CdS 的光腐蝕。另外,Li等[83]構建的g-C3N4/Pd/TiO2和Liu[78]等構建的g-C3N4-RGO-TiO2間接Z型異質結均表現出優于單組分和雙組分的催化活性。
在間接Z型異質結的基礎上,Yu等[57]于2013年首次提出了直接Z型異質結(圖11b)的概念。直接Z型異質結是二元體系,不包含電子媒介,2種半導體直接接觸,電子直接在2種半導體的界面間傳遞,也實現了電子與空穴在空間上的分離。半導體間的固-固接觸界面的性質決定了電子傳遞的阻力,而阻力的大小與接觸界面的形成方式有很大關系[39]。因此,固-固接觸界面的設計對于直接Z型異質結的構建具有重要意義。理論分析認為,由于界面缺陷可以作為電荷俘獲的中心,固-固接觸界面上的大量表面缺陷可以起到歐姆接觸的作用[84]。氧空位是金屬氧基半導體的一種固有缺陷,對調控界面狀態和捕獲半導體間的電荷具有重要的意義[85]。Yue等[86]通過液氮淬火法制備了表面富含氧空位的TiO2中空球,限制了光生載流子的復合以及提高了TiO2對可見光的吸收,催化劑的產氫量在3 h可見光照射下達到1 240.5μmol。Zhang等[39]在直接Z型三元硼碳氮化合物(BCN)-TiO2中,通過NaBH4還原形成界面氧空位層,促進了載流子在界面處的傳遞,展現出良好的可見光析氫速率(3.01 μmol·h-1),約為純 TiO2的7倍和純BCN的11倍。
4 TiO2基Z型異質結在光催化上的應用
TiO2基Z型異質結能有效地提高TiO2的光催化性能和對可見光的利用率,因此可以拓展TiO2在光催化領域上的應用。目前,光催化領域的研究熱點主要包括:污染物降解、水分解和CO2還原。合理地構建TiO2基Z型異質結,提高材料的光催化活性,可以有效地促進理論研究向實際應用的轉化,最終解決環境污染和能源危機兩大全球性問題。本文歸納整理了部分TiO2基Z型異質結在光催化領域中的應用(表2),并進一步討論TiO2基Z型異質結在污染物降解、水分解和CO2還原上的應用實例和研究進展。
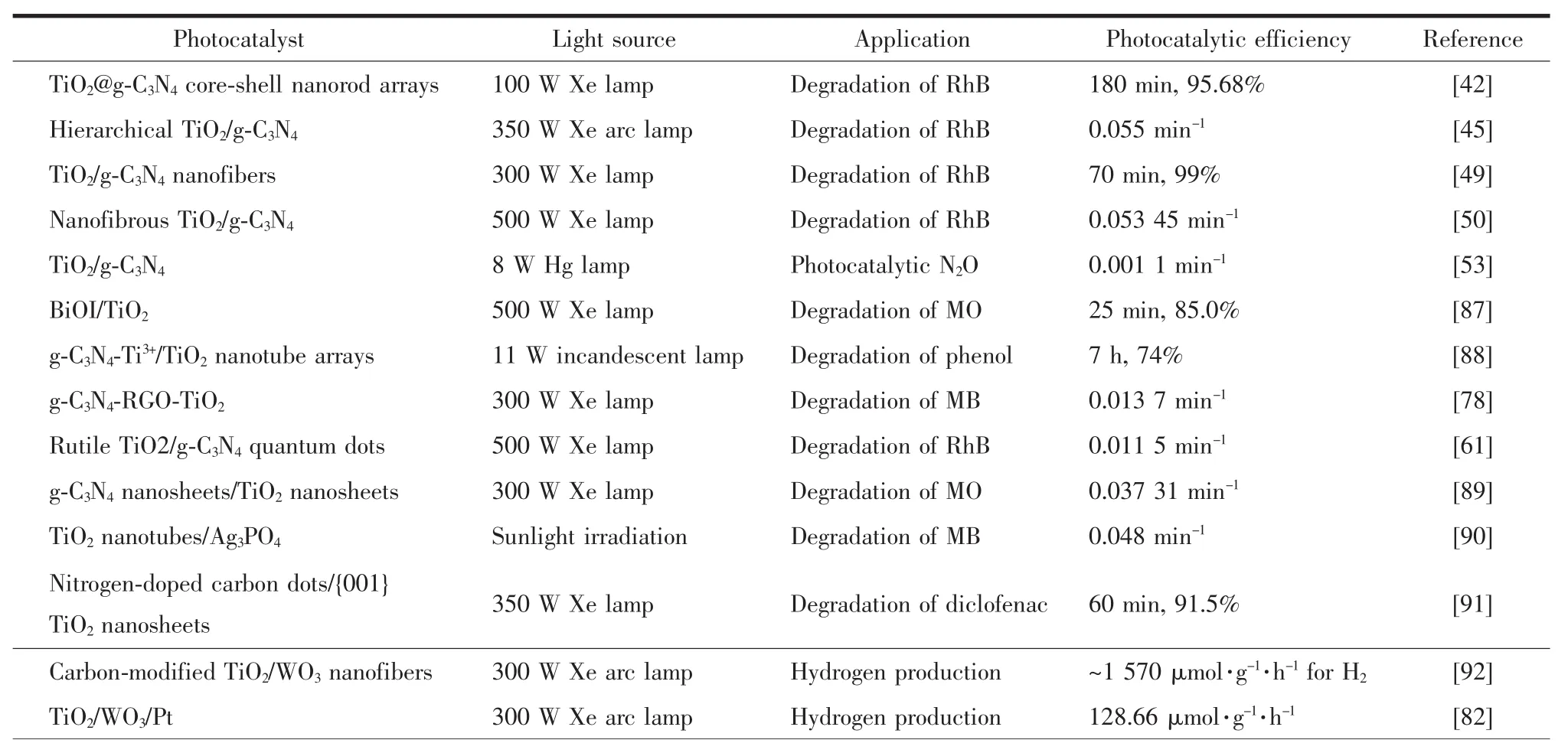
表2 TiO2基Z型異質結在光催化中的應用Table 2 Applications of TiO2 based Z-scheme heterojunctions in photocatalysis
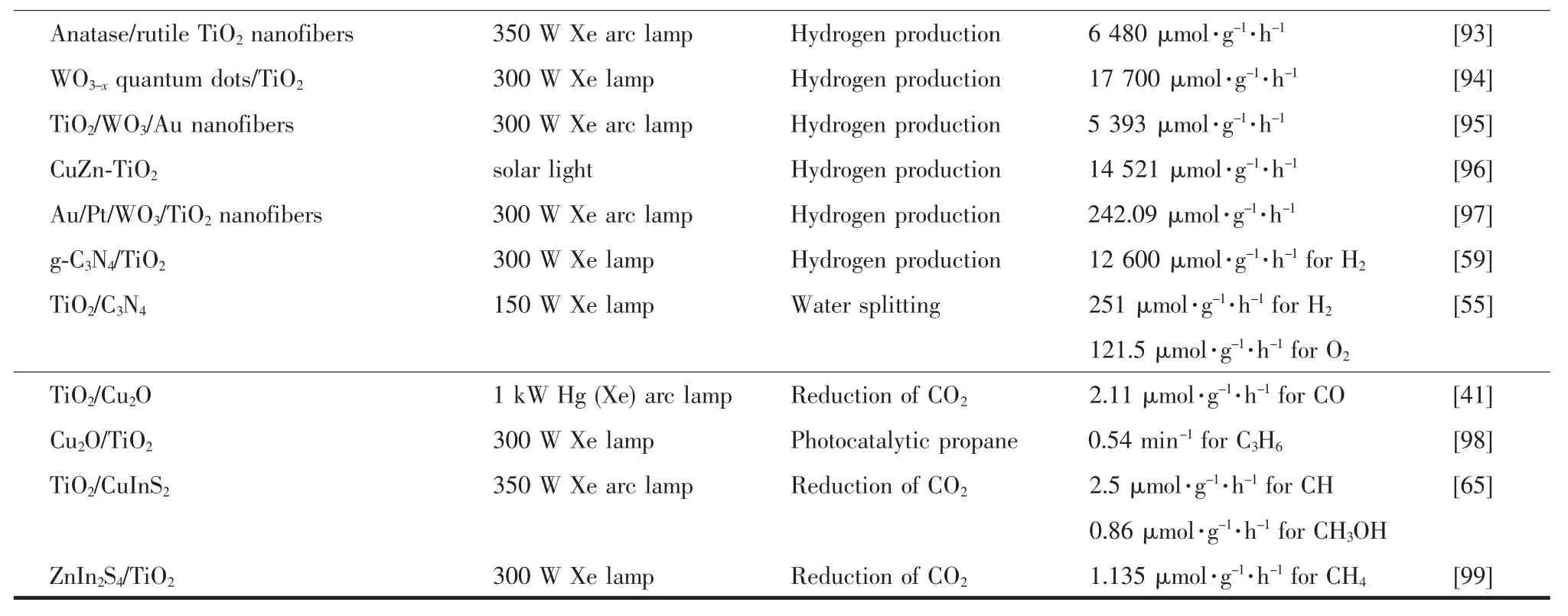
續表2
4.1 污染物降解
目前,研究報道的污染物主要包括水溶性染料[2,3,100]、重金屬離子[101-103]、苯酚類[47,88,104]、抗生素藥物[54]以及一些有毒有害的氣體[44,53,105]。光催化是一種能有效降解污染物的綠色且經濟的方法,光催化降解污染物的過程一般包含以下10個反應:

在上述反應中,空穴(hVB+)、·O2-和·OH 是 3 種主要的并可用于降解污染物的活性物質,其中·OH的氧化能力強(標準氧化還原電勢為+2.8 V),可以氧化大部分偶氮染料[100]。反應(10)為污染物的降解反應,3種活性物質均參與其中,且在降解反應中有著不同的貢獻程度,通常通過自由基的捕獲實驗可以判斷各活性物質對降解反應的貢獻程度。每一種活性物質都有相應的捕獲劑:空穴的捕獲劑有乙二醇胺(TEOA)和草酸銨(AO),·O2-的捕獲劑有苯醌(BQ)和抗壞血酸,·OH 的捕獲劑有異丙醇(IPA)。 反應(9)為電子-空穴對的復合,該反應的發生會減小電子和空穴的濃度,不利于反應物種的產生。反應機理可以印證,提高光催化劑催化活性的關鍵因素在于減小電子與空穴的復合幾率。根據以上結論,TiO2基Z型異質結將電子與空穴分離在不同的半導體上,實現了電子與空穴在空間上的分離,進而提高光催化降解污染物的效果。
Li等[42]通過三步熱沉積法(圖12a)制備了 TiO2@g-C3N4核殼納米棒陣列,并通過調控反應溶液中三聚氰胺(MEL)飽和溶液和去離子水的體積比,得到了一系列g-C3N4含量不同的復合物,包括CN30、CN50、CN70 和 CN100 (其中 30、50、70、100 分別代表MEL飽和溶液占去離子水體積的30%、50%、70%、100%)。圖12c為污染物降解的機理圖,Li等在DFT的理論基礎上進行了第一性原理的模擬,驗證了其機理符合Z型異質結機理。通過對RhB的光催化降解實驗的結果(圖12b)分析,發現在3 h的可見光照射下,CN70樣品對RhB的降解效果基本可以達到100%。另外,Wang等[50]以MEL為原料,通過靜電紡絲和煅燒處理得到了一系列納米纖維狀的TiO2/g-C3N4異質結光催化劑,其中TiO2在復合物中的質量分數為 0、5.10%、11.57%、20.54%、29.30%、40.36%和100%,分別對應著圖12e中的a~f,h為空白對照實驗。g-C3N4包裹TiO2納米纖維形成一種核殼結構(圖12d),這種光催化劑同樣也被推測為Z型異質結 (圖12f)。在人工模擬的太陽光照射下,TiO2質量百分數為29.30%的復合材料對RhB的降解效果最佳,即80 min內降解效率達到100%。從這2種材料的結構與降解效果來看,無論是TiO2@g-C3N4核殼納米棒陣列還是TiO2/g-C3N4異質結光催化劑,都被認定為Z型異質結,并且在可見光下對RhB都有較好的降解效果,這一結果也驗證了Z型異質結對材料的光催化性能起積極作用。
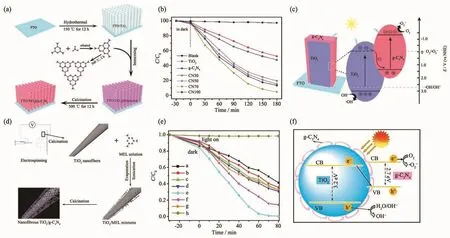
圖12 TiO2@g-C3N4核殼納米棒陣列的(a)合成過程,(b)在可見光下各催化劑對RhB的光催化降解曲線和(c)作為Z型光催化劑的降解機理圖[42];(d)納米纖維狀的TiO2/g-C3N4異質結光催化劑的制備流程,(e)TiO2組成比例不同的TiO2/g-C3N4樣品在復合太陽光下對RhB的光催化降解曲線和(f)Z型異質結TiO2/g-C3N4光催化劑的光催化機理[50]Fig.12 (a)Schematic illustration of synthesis process of TiO2@g-C3N4 core-shell nanorod arrays,(b)photocatalytic activity plots of TiO2 and TiO2@g-C3N4 nanorod arrays for degradation of RhB dye under visible light,and (c)degradation mechanism of g-C3N4@TiO2 in the form of Z-scheme[42];(d)Schematic representation of the fabrication of electrospun nanofibrous TiO2/g-C3N4 heterojunction photocatalysts,(e)photocatalytic degradation RhB aqueous solution over different TiO2/g-C3N4 photocatalysts under simulated solar light irradiation,and (f)schematic showing the Z-scheme photocatalytic mechanism of the nanofibrous TiO2/g-C3N4 heterojunction photocatalys[50]
目前,TiO2基Z型異質結光催化劑降解污染物的理論研究逐漸發展,在污染物降解上的應用也取得一定的進展,但要將理論延伸到應用中還需要克服許多技術難點,其中包括應付環境的復雜性,克服催化劑回收難的問題,提高催化劑的穩定性以及提高光能的利用率等。Wu等[106]利用蒙脫土(MMT)為載體,接枝纖維素為模板,低溫合成了cellulose-g-poly(4-vinylpyridine)/MMT/TiO2復合材料,即提高催化劑的吸附能力又解決了催化劑難回收的問題。同時,現階段也缺乏考察催化劑催化活性的統一評價標準,這主要是因為試驗過程中的影響因素較多,且很難保持一致,其中包括光源的輻射強度、溫度、pH、催化劑的用量等等。
4.2 光催化水分解
近年來,光催化技術在水分解領域中的應用引起了研究者們的廣泛關注。2014年,Martin等[107]以尿素為前驅體煅燒得到了g-C3N4,在光催化分解水的實驗中展現出高達26.5%的量子產率和高的制氫速率(全光譜照射下制氫速率為 20 000μmol·g-1·h-1, 可見光照射下制氫速率為 3 300 μmol·g-1·h-1)。利用光催化技術,可以創造一種理想的循環體系,即水分解產生氫氣,氫氣燃燒產生的水又可以進一步分解為氫氣,而完成這一循環的關鍵是尋找一種合適的光催化劑。光催化水分解包含2個半反應:(1)H+從光催化劑的導帶上得到電子,被還原生成H2;(2)H2O分子被光催化劑價帶奪取電子,被氧化生成O2。從能級圖上看[108],H+/H2標準氫電極電勢為 0,O2/H2O標準氫電極電勢為1.23 V。因此,選擇的光催化劑要滿足2個條件[6,109]:(1)催化劑的禁帶寬度要大于水的電解電壓 (1.23 V);(2)催化劑價帶和導帶的位置要分別與O2/H2O和H+/H2的電極電勢相適宜。
在光催化水分解的研究中,石墨烯基光催化劑[110-111]、金屬磷化物[4,112]、g-C3N4基光催化劑[113]、金屬氧化物[114]、TiO2基光催化劑[115]等都是現在的熱點材料。在眾多催化劑中,TiO2作為最早的水分解的光催化劑,展現出較高的制氫效率。目前商業化的TiO2(P25)在制氫效率上處于許多材料之上,但可見光利用率低的問題依然限制了TiO2在制氫中的應用。2011年,Science報道了Chen等[116]制備出黑色氫化的TiO2,他們在TiO2表面構造了一種無序化結構,提高了TiO2對太陽光的吸收,并在光催化制氫中表現出高的催化活性和穩定性,制氫速率為10 000 μmol·g-1·h-1,高于大部分光催化劑。Su 等[117]制備的TiO2/C 復合催化制氫效率達到 11 440 μmol·g-1·h-1。TiO2基Z型異質結在繼承TiO2的高催化活性的基礎上,同時又可以引入窄帶隙的半導體提高TiO2對可見光的吸收,并進一步地提高TiO2的光催化活性。譬如,Zhang等[95]采用了靜電紡絲的方法,制備了TiO2納米纖維(S0)和 TiO2/WO3復合納米纖維(S1),并在TiO2/WO3復合納米纖維修飾上Au的納米顆粒,通過調控前驅體 HAuCl4的質量分數 (0.3%(S2)和0.45%(S3)), 得到 Au含量比例不同的 TiO2/WO3/Au納米纖維。圖 13(a~c)呈現出 S2的納米纖維結構,通過 HRTEM(圖 13(d~g))可以明顯的觀察到 TiO2的(101)晶面、WO3的(200)晶面以及 Au 的晶格條紋。圖13h也說明了Au與TiO2之間存在良好的接觸,這為電子在兩者間的轉移創造了良好的前提條件。在紫外和可見光的照射下,測試光催化劑的制氫效率(圖 13i)和穩定性(圖 13j)。 結果顯示,TiO2/WO3相對于TiO2制氫速率提高到27.73μmol·h-1,再引入Au后,催化劑的制氫速率提高到182.93μmol·h-1。在穩定性上,S3樣品3次循環的制氫速率一致。該催化劑具有較高的制氫活性的原因包含以下4個:(1)催化劑的結構為間接Z型異質結(圖13k),減小了電子與空穴的復合幾率;(2)Au納米顆粒所具有的等離子共振效應,增加了催化劑對可見光的吸收;(3)Au作為電子媒介,接受來自TiO2上的電子;(4)甲醇等空穴捕獲劑的加入,進一步抑制了電子與空穴的復合。除了TiO2/WO3/Au光催化劑,許多TiO2基Z型異質結也表現出優異的制氫活性。其中含有0.5%(w/w)的Cu、Zn摻雜的CuZn-TiO2[96]在自然光的照射下,制氫速率達到了 14 521 μmol·g-1·h-1。 WO3-x量子點/TiO2[94]在300 W氙燈照射下,也表現出高達17 700 μmol·g-1·h-1的制氫速率。

圖 13 S2樣品的(a,b)SEM 圖,(c)低倍 TEM 圖以及(d~h)HRTEM 圖;不同樣品在紫外-可見光照射下的光催化制氫活性 (i)以及穩定性 (j);(k)Z型異質結TiO2/WO3/Au納米纖維光催化制氫的機理圖[95]Fig.13 (a,b)SEM images,(c)a low-resolution TEM image and (d~h)HRTEM images of as-prepared S2 sample;photocatalytic hydrogen production activity (i)and stability (j)of different samples under UV-Vis light irradiation;(k)schematic diagram of the photocatalytic H2 generation over the Z-scheme heterojunction TiO2/WO3/Au composite nanofibers[95]
構建TiO2基Z型異質結有利于解決TiO2可見光利用率低和電子-空穴易復合等缺點。另外,研究者在進行水分解的實驗中,會加入空穴捕獲劑,其目的是讓空穴被捕獲劑消耗掉,間接地減小電子與空穴的復合幾率。常用的空穴捕獲劑有硫化鈉(Na2S)、亞硫酸鈉(Na2SO3)[118]、三乙醇胺(TEOA)[119]、甲醇和乳酸[120]等。 同時,也加入貴金屬Pt[107,121,122]作為助催化劑,加速電子向外部遷移,有利于氫氣的產生。
4.3 CO2還原
CO2是大氣的主要成分,但化石燃料燃燒排放的大量CO2是引起溫室效應的主要原因。1979年,Inoue等[123]首次采用光電技術將CO2還原為有機化合物,如甲酸、甲醛、甲醇和甲烷。這一方案的提出既解決了CO2的過量排放問題,又使還原生成的有機化合物作為新的能源被繼續利用。近年來,隨著太陽能資源的開發和利用,通過光催化實現CO2還原成為研究的熱點領域之一。我們總結整理了相關的研究工作,提出了CO2還原存在以下7個還原反應[8,124-125]:
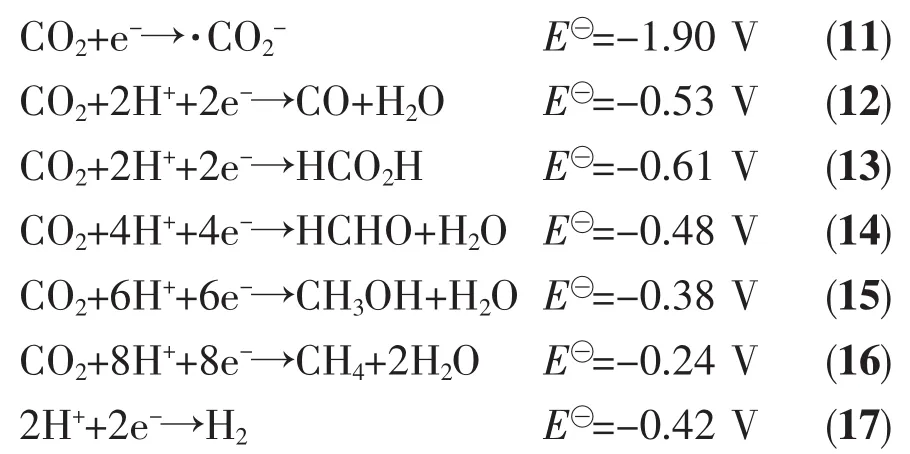
圖14 (a)三維直接Z型光催化劑ZnIn2S4納米片/TiO2納米帶的制備示意圖;(b)甲烷的生成速率圖;(1)ZnIn2S4納米片,(2)ZIS-0.25/TO (ZnIn2S4/TiO2的物質的量比值 n Zn In2 S4/n TiO2=0.25),(3)ZIS-0.33/TO (n ZnIn2 S4/n TiO2=0.33),(4)ZIS-0.50/TO(n ZnIn2 S4/n TiO2=0.50),(5)ZIS-1/TO (n ZnIn2 S4/n TiO2=1)和(6)TiO2納米帶;(c)紫外和可見光照射下的 ZnIn2S4納米片/TiO2納米帶光催化機理圖[99]Fig.14 Schematic illustration (a)of the fabrication of 3D ZnIn2S4 nanosheets/TiO2 nanobelts direct Z-scheme photocatalysts;(b)CH4 generation velocity over(1)ZnIn2S4 nanosheets,(2)ZIS-0.25/TO (n ZnIn2 S4/n TiO2(molar radio of ZnIn2S4 to TiO2)=0.25),(3)ZIS-0.33/TO (n ZnIn2 S4/n TiO2=0.33),(4)ZIS-0.50/TO (n Zn In2 S4/n TiO2=0.50),(5)ZIS-1/TO (n ZnIn2 S4/n TiO2=1)and (6)TiO2 nanobelts;(c)Schematic diagrams for photocatalysis of ZnIn2S4 nanosheets/TiO2 nanobelts under UV-Vis irradiation[99]
CO2單電子捕獲的標準氫電極電勢(E?)為-1.90 V(pH=7.0),一般光催化劑的導帶所處的能級均低于-1.90 V,導帶上的電子很難被CO2所捕獲,因此單電子還原過程很難實現,需要尋求其它反應途徑。反應(12~16)為多電子還原,反應的 E?在-0.5 V 左右,反應相對容易發生。而反應發生的先后順序與E?有關,電勢越負,反應越難進行,因此多電子還原反應中,CO2的還原產物出現的先后順序為CH4、CH3OH、CO和HCO2H。另外,多電子反應的E?都比較接近,因此各反應間存在競爭關系,而在水體系下的CO2還原,也需要考慮制氫反應(17)與其它反應的競爭,最終各反應的相互競爭導致CO2還原的選擇性不高,但CO2還原的潛在應用價值依然吸引著研究者們不斷地去尋找合適的光催化劑并應用在CO2還原上。隨著光催化CO2還原的持續發展,相繼報道出許多光催化劑,金屬有機框架(MOF)光催化劑[125]、金屬復合光催化劑[123]、g-C3N4基光催化劑[126]、石墨烯基光催化劑[127]和TiO2基光催化劑[41,65,98-99,124]等,TiO2基Z型異質結作為其中一種光催化劑對CO2還原有較高的催化活性。Yang等[99]通過水熱法將超薄的二維ZnIn2S4納米片,復合在一維的TiO2納米帶上,形成了一種三維的Z型光催化劑ZnIn2S4/TiO2(圖 14a)。 ZnIn2S4的能帶間隙為 2.65 eV,它的截止吸收波長為468 nm,因此在Z型異質結中作為可見光的響應物質。根據ZnIn2S4和TiO2的能帶分布(圖 14c),TiO2導帶上的電子與 ZnIn2S4價帶上的空穴復合,最終保留著TiO2價帶上的空穴和ZnIn2S4導帶上的電子。ZnIn2S4導帶上的電子所處的電勢為-0.65 eV,低于CO2多電子還原的電勢。因而,從熱力學角度而言,反應(12~16)的是可能發生的。在考察光催化劑還原CO2生成CH4的速率的實驗中(圖14b),與單一的材料近乎為零的生成速率相比較而言,Z型異質結的CH4生成速率有明顯的提高。同時,ZnIn2S4與TiO2的比例也是影響CH4的生成速率的關鍵因素,當ZnIn2S4與TiO2的物質的量之比為1∶3 時,CH4的生成速率達到最高, 為 1.135 μmol·g-1·h-1。
TiO2基Z型異質結在不降低TiO2氧化還原能力的基礎上,通過引入窄帶隙的半導體,增強對可見光的吸收,以及通過調控異質結的能帶結構去調節光生電子的能級位置,有選擇地進行CO2的還原反應。當前,TiO2基Z型異質結在光催化CO2還原上的應用研究較少,但其依然在光催化CO2還原上具有很大的應用潛力。產物選擇性低、光催化劑的穩定性差和光能轉換率低等是阻礙其實際應用的主要因素,尋求突破這些阻礙的方法成為現階段研究的主要目的。
5 結 論
光催化是一種將光能轉換為化學能的綠色安全的技術,在解決環境污染和能源危機這兩大全球性問題上具有廣闊的前景。光催化劑TiO2基Z型異質結作為新型催化劑在繼承TiO2的優勢基礎上,還具有氧化還原能力強、電子-空穴易分離和可見光利用率高(在引入窄帶隙的半導體時)等性質,并在光催化降解污染物、水分解和CO2還原上得到了廣泛的應用。
本文綜述了TiO2光催化劑、TiO2異質結光催化劑、TiO2基Z型異質結光催化劑的能帶排列與電荷轉移規則,比較了type-Ⅱ異質結和Z型異質結的異同點,并在此基礎上介紹了3種區分彼此的方法,最后歸納整理了部分TiO2基Z型異質結在光催化降解污染物、水分解和CO2還原上的應用。綜合以上討論,TiO2基Z型異質結具有許多獨特的優勢,但依然存在一些問題:(1)對探索Z型異質結的光催化機理,依然缺乏有效的手段和準確的理論支撐;(2)Z型異質結分離電子和空穴的前提是電子與空穴的復合,這樣會導致催化劑表面載流子的濃度下降,從而降低催化活性;(3)如何有目的地構建TiO2基Z型異質結而不是type-Ⅱ異質結,依然是一個難題。

