康復新液抗念珠菌性陰道炎的藥效研究△
楊亞超,蘇劉艷,劉一丹,莊馨瑛,王睿睿,張祎*
1.云南中醫藥大學 中藥學院,云南 昆明 650500;2.云南省民族特色養生理論與健康產品工程實驗室,云南 昆明 650500;3.昆明制藥集團股份有限公司,云南 昆明 650500
真菌感染性疾病,尤其是淺部真菌感染,在我國屬于常見病、多發病。其中念珠菌性陰道炎是一種常見的生殖道感染性疾病,其感染率可達11.8%。念珠菌性陰道炎,又稱霉菌性陰道炎,其致病菌以白色念珠菌Candidaalbicans為主,占比多達80%~90%。白色念珠菌廣泛存在于自然界中,其為條件致病菌,存在于正常人的皮膚、口腔及陰道中,但并不致病;當機體免疫力下降時,該菌就會大量繁殖并侵襲機體繼而誘發系列疾病。近些年來,由于抗菌藥的不規范使用[1]和激素、免疫抑制劑在臨床上的大量應用[2],導致機體菌群失調和免疫力降低,皮膚、黏膜、內臟等發生真菌感染的概率大幅增高,念珠菌性陰道炎的發病率也居高不下。
中醫認為,念珠菌性陰道炎多因濕熱生蟲、蟲蝕陰中所致,屬外感濕濁穢毒之邪。其主要病因是脾氣之虛、肝氣之郁、濕氣之浸、熱氣之逼、帶脈之傷所致。此外,尚可因攝生不慎、洗浴用具不潔感染濕毒,直犯陰器,侵于任帶二脈,致任脈不固,帶脈失約,穢液下流而發。美洲大蠊為昆蟲綱翅亞綱蜚蠊目蜚蠊科大蠊屬昆蟲,俗稱“蟑螂”,在我國分布廣泛,入藥始載于《神農本草經》[3],其功效為散瘀消結、解毒利尿,臨床常外用治療蛇蟲咬傷、癰瘡腫毒、腳氣水腫、氣喘、小便淋濁等癥。生物學家發現,美洲大蠊進化史漫長,繁殖能力強,生活環境較為復雜,攜帶50多種致病或非致病菌,但自身卻不被感染,說明其具有較強的抗菌性[4]。康復新液是美洲大蠊干燥蟲體的乙醇提取物,有學者對其成分進行了分析,鑒定了十余個化合物[5],發現其含氮化合物具有促創面愈合的活性[6]。有文獻報道康復新液具有廣譜抑菌、促細胞生長、鎮痛、改善微循環、增強免疫、抗腫瘤、抗病毒、抗真菌等作用[7]。
本研究擬通過體外實驗檢測康復新液對白色念珠菌的抗菌作用,通過復制念珠菌性陰道炎小鼠模型,進行康復新液抗念珠菌性陰道炎的初步藥效學研究;以期為臨床提供治療念珠菌性陰道炎的候選藥物,同時為開發利用美洲大蠊藥用資源提供新的思路。
1 材料
1.1 藥物
康復新液購自昆明賽諾制藥股份有限公司,批號:17033022。氟康唑分散片購自南昌弘益藥業有限公司,批號:171128。
1.2 供試菌種
白色念珠菌標準株ATCC10231購自中國科學院昆明植物研究所;23#臨床耐藥株由昆明醫科大學第一附屬醫院皮膚科主任李玉葉教授贈送(由艾滋病患者體內提取分離培養,對唑類抗真菌藥具有較強的耐藥性)。供試菌種使用前接種到沙氏瓊脂培養基上,37 ℃恒溫培養24 h,備用。
1.3 動物
SPF級雌性Balb/c小鼠120只,4周齡,體質量18~22 g,購自昆明醫科大學實驗動物學部,動物合格證號:SCXK(滇)K2015-0002,飼養于云南中醫藥大學動物實驗室。
1.4 主要儀器與試劑
連續波長酶標儀(SPECTRAMAX PLUS384型,Molecular Devices美谷分子儀器有限公司),生物顯微鏡(E200MV型,南京尼康江南光學儀器有限公司),恒溫恒濕真菌培養箱(HWS-250BX型,天津市泰斯特儀器有限公司)。苯甲酸雌二醇(E2,江西博萊大藥廠有限公司,批號:20180820,規格:1 mL∶1 mg),環磷酰胺(CAYMAN CHEMICAL COMPANY,批號:0491131-9,規格:10 g),沙氏瓊脂培養基(廣東環凱微生物科技有限公司,批號:1073561,規格:250 g),沙氏液體培養基(廣東環凱微生物科技有限公司,批號:1069251,規格:250 g),YPD瓊脂培養基,無菌PBS(Phosphate Buffered Saline),gibco[賽默飛世爾(蘇州)儀器有限公司,生產批號:8117302,規格:500 mL]。
2 方法
2.1 康復新液抗白色念珠菌體外實驗研究
采用微量稀釋法,選用標準株ATCC10231和23#臨床耐藥株。實驗前用沙氏液體培養基將供試菌種密度調為1×105個/mL。用沙氏液體培養基稀釋康復新液原液,陽性藥物氟康唑稀釋成初質量濃度為1000 μg·mL-1,采用5倍倍比稀釋6個濃度梯度的方式制備不同濃度的藥物受試液。96孔板中依次加入100 μL不同濃度藥液和100 μL菌懸液,并混合均勻。同時設定陽性對照組(只加培養液和菌液)、空白對照組(只加培養液不加菌液)及陽性藥物對照組,臨床用藥以氟康唑最為廣泛,且效果最佳,因此選用氟康唑為本實驗陽性對照藥物。每組重復3個復孔,37 ℃恒溫培養24 h,全自動酶標儀檢測625 nm波長處的吸光度(A)值,重復讀取3次取平均值。按公式(1)(2)計算白色念珠菌的半數有效濃度EC50值,以此判斷康復新液的抗菌抑菌作用。

(1)
半數抑菌濃度(EC50)=10[lg(c)+(a-50)/(a-b)×lg(1/5)]
(2)
式中:c為抑菌率大于50%對應上述梯度濃度中的最小濃度,a為c對應的抑菌率,b為僅小于a的抑菌率。
2.2 康復新液抗念珠菌性陰道炎實驗研究
2.2.1 動物分組 小鼠適應性喂養1周,按隨機數表法分為4組,每組30只,分別為對照組、真菌感染模型組、康復新液治療組、氟康唑治療組。實驗前每只小鼠用無菌PBS陰道灌洗并將灌洗液進行培養,選擇灌洗液培養皿中無白色念珠菌生長的小鼠用于正式實驗。
2.2.2 模型復制及給藥 參考夏德超等[8]和孔小鋒等[9]模型復制方法并進行適度改良后建立白色念珠菌陰道感染小鼠模型。1)預處理:接種前4 d開始每鼠分別皮下注射E2(1 mg·mL-1)0.025 mL,1次/d,連續注射4 d,造成小鼠假發情,陰道擴張,之后每2 d注射1次,直至實驗結束;接種前3 d開始每鼠腹腔注射環磷酰胺(100 mg·kg-1)10 mL·kg-1,1次/d,連續注射3 d,造成小鼠自身免疫缺陷,之后每3 d注射1次(75 mg·kg-1)10 mL·kg-1,直至實驗結束。2)真菌接種:陰道接種前用無菌PBS將白色念珠菌標準株密度調為2.5×107個/mL,用微量加樣器吸取菌懸液20 μL,注入模型組和治療組小鼠的陰道內,原位停留1~2 min,防止菌液溢出;空白對照組陰道內注入20 μL無菌PBS。接種后的第2天、第4天和第7天,每組取3只小鼠用無菌PBS陰道灌洗,將灌洗液進行培養,評價念珠菌性陰道炎動物模型是否成功。3)給藥:模型成功建立24 h后,康復新液治療組陰道灌洗給予相應藥液100 μL/只,氟康唑治療組灌胃給藥(2 mg·kg-1),同時陰道灌洗無菌PBS 100 μL/只,對照組、模型組陰道灌洗無菌PBS 100 μL/只,連續給藥7 d,每天按照檢測指標評價抗菌活性。
2.2.3 指標檢測
2.2.3.1 全身及陰道局部情況觀察 每個灌洗日進行全身情況觀察,記錄小鼠體質量,并做陰道局部癥狀評分。評分標準為0分:外陰陰道無紅腫及分泌物增多;1分:外陰陰道輕微紅腫,無分泌物增多;2分:外陰陰道明顯紅腫伴分泌物增多;3分:外陰陰道明顯紅腫,出現潰瘍,并伴分泌物增多;4分:死亡。
2.2.3.2 灌洗液鏡檢及菌落培養計數 每個灌洗日陰道用100 μL無菌PBS灌洗,灌洗液置于潔凈無菌的EP管中,取10 μL灌洗液鏡下觀察菌絲生成情況;灌洗液用無菌PBS稀釋10倍,取10 μL接種于YPD瓊脂培養基,37 ℃培養24 h后,進行菌落觀察并計數(Colony-Forming Units,CFU,即菌落形成單位,以個/mL為單位計數)。
2.3 統計學分析
3 結果
3.1 康復新液體外對白色念珠菌的影響
按照2.1方法計算康復新液的半數有效濃度(EC50)值,以此判斷康復新液的抗菌作用。實驗結果表明,康復新液對白色念珠菌標準株有一定的抑制效果,半數有效濃度大約為康復新液原液2倍稀釋濃度;康復新液對臨床耐藥株的抑制效果較好,半數有效濃度大約為康復新液原液6倍稀釋濃度。陽性藥物氟康唑對白色念珠菌標準株有良好的抑制效果,EC50為30.69 μg·mL-1;氟康唑對臨床耐藥株的EC50大于1000 μg·mL-1,無抑制效果,具體結果見表1。

表1 康復新液體外對白色念珠菌的抑制作用
3.2 康復新液抗念珠菌性陰道炎實驗
3.2.1 康復新液對念珠菌性陰道炎模型小鼠一般情況的影響 實驗結果表明,與對照組相比,真菌感染模型組小鼠行動呆滯、體表毛發均有脫毛嗆毛現象;與真菌感染模型組相比,康復新液、氟康唑治療組小鼠行動敏捷、毛發光滑、無脫毛嗆毛現象,具體結果見圖1。
3.2.2 康復新液對念珠菌性陰道炎模型小鼠體質量的影響 實驗結果表明,與對照組相比,真菌感染模型組小鼠體質量整體呈下降趨勢,造模第13天、第14天體質量明顯下降(P<0.05);與真菌感染模型組相比,康復新液治療組小鼠給藥第5天、第6天、第7天體質量顯著上升(P<0.05),氟康唑治療組小鼠給藥第3天、第5天、第6天、第7天體質量顯著上升(P<0.05),具體結果見圖2。
3.2.3 康復新液對念珠菌性陰道炎模型小鼠外陰外觀及陰道局部炎癥的影響 實驗結果表明,與對照組相比,真菌感染模型組小鼠接種白色念珠菌后第2天開始外陰紅腫明顯、分泌物明顯增多,且在接種后第2天、第4天、第7~14天陰道炎癥評分顯著上升(P<0.01);與真菌感染模型組相比,康復新液、氟康唑治療組小鼠給藥第5、6、7天外陰紅腫緩解、分泌物減少、陰道局部炎癥評分下降(P<0.01),具體結果見圖3~4。
3.2.4 康復新液對念珠菌性陰道炎模型小鼠陰道菌落的影響 實驗結果表明,與對照組相比,真菌感染模型組小鼠陰道白色念珠菌定植菌落數顯著增多(P<0.01);康復新液、氟康唑治療組與真菌感染模型組相比,小鼠陰道內白色念珠菌定植明顯減少,灌洗液培養菌落數明顯減少(P<0.01),具體結果見圖5~6。

圖1 康復新液對念珠菌性陰道炎模型小鼠一般情況的影響
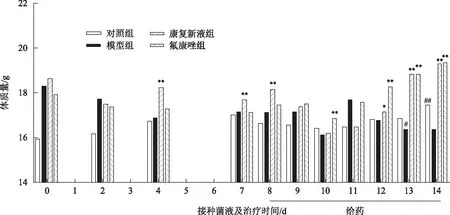
注:與對照組相比,#P<0.05,##P<0.01;與模型組相比,*P<0.05,**P<0.01;下同。圖2 康復新液對念珠菌性陰道炎模型小鼠體質量的影響

圖3 康復新液對念珠菌性陰道炎模型小鼠外陰外觀的影響
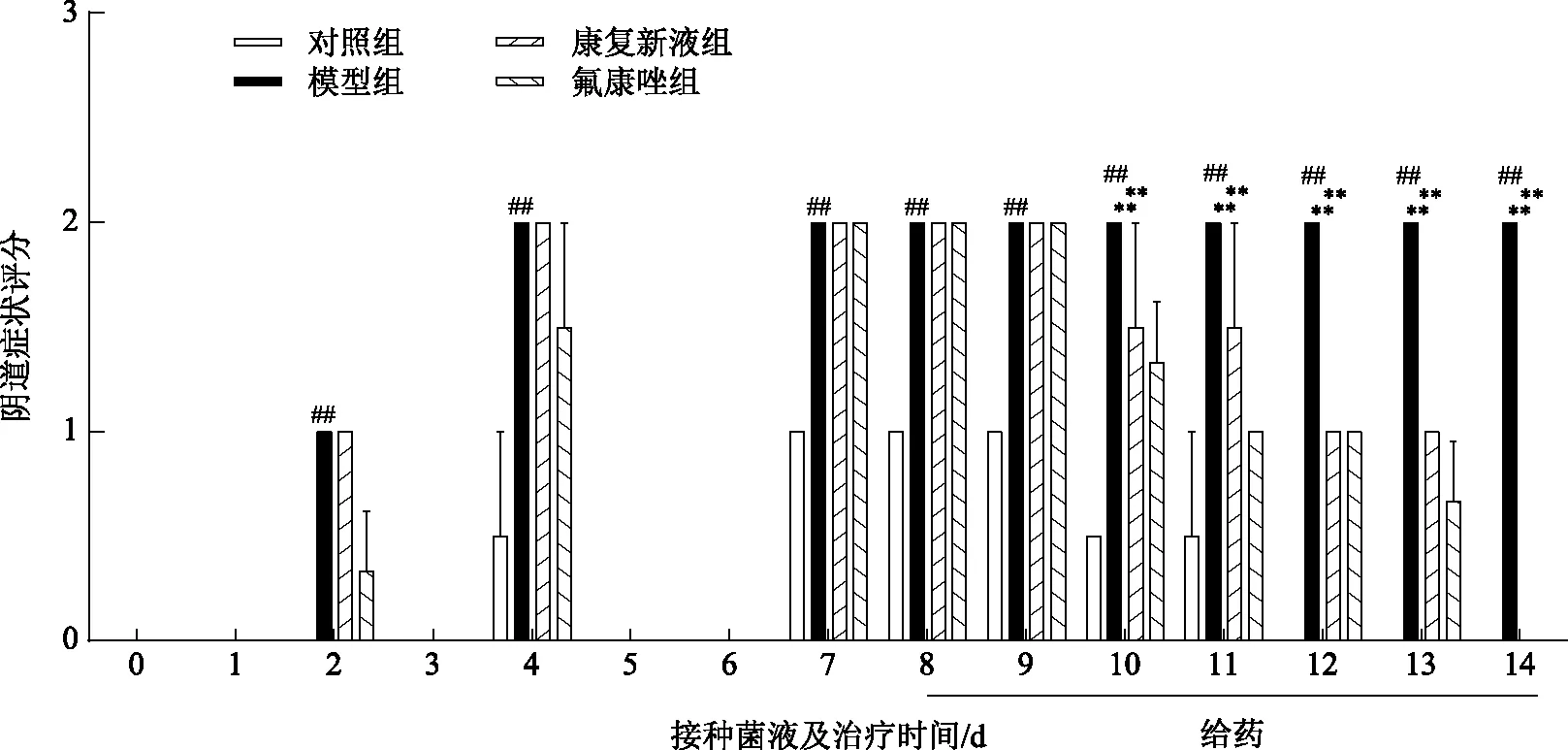
注:各時間點部分分組內3只小鼠陰道炎癥評分相同,故統計學標準差為0;第0天各組炎癥評分均為0,第2天、第12天、第13天、第14天對照組炎癥評分為0,第14天康復新液、氟康唑組炎癥評分為0,故圖中不予顯示。圖4 康復新液對念珠菌性陰道炎模型小鼠陰道局部炎癥的影響

圖5 康復新液對念珠菌性陰道炎模型小鼠陰道菌落定植情況的影響
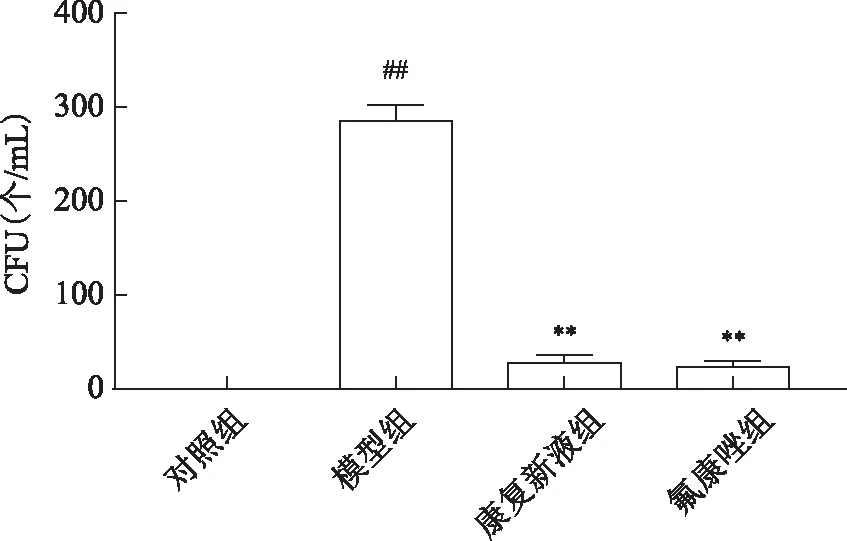
圖6 康復新液對念珠菌性陰道炎模型小鼠陰道定植菌落數的影響
4 討論
中醫認為念珠菌性陰道炎患者多為素有肝經濕熱,或肝郁脾虛、化熱生濕,久則濕熱之邪化為濕毒并隨經下注,蘊結陰器,又濕熱蘊積生蟲發為陰癢,甚則灼痛,帶下異常或伴心煩不寐,胸悶不適,口苦而膩,納谷不香等,舌質紅、苔黃膩,脈玄數或滑數。運用中醫藥思維,尋找相應中藥及復方用來預防和治療陰道炎疾病具有很好的發展前景。
目前治療念珠菌性陰道炎的藥物如甲硝唑、環丙沙星等,微生態治療制劑如地衣芽孢桿菌,還有中藥洗劑如苦參洗劑等,不過存在可誘發耐藥性、復發率高、用藥不便、制劑困難等不足。因此,尋找更加安全、有效的治療藥物具有重要意義。目前可供臨床選擇的治療念珠菌性陰道炎的藥物主要有兩性霉素B、氟胞嘧啶、氟康唑、酮康唑、依曲康唑等幾種藥物,其中氟康唑因其良好的生物利用度和較少的不良反應,成為臨床應用最廣泛的抗真菌藥物[10];但在長期治療和重復給藥過程中,誘使白色念珠菌快速產生耐藥性,導致氟康唑耐藥程度越來越嚴重,而且大部分耐氟康唑真菌對其他抗真菌藥物具有交叉耐藥性,使得目前的抗真菌藥物對越來越多的耐藥菌束手無策,這是導致臨床治療失敗的主要原因。鑒于目前臨床抗真菌用藥選擇范圍小、不良反應大、耐藥性產生以及臨床治療失敗等原因,尋找新的抗菌譜廣、抗菌效果好、不良反應小的中藥制劑已經成為臨床抗真菌治療的發展方向之一。
康復新液屬于純天然昆蟲提取物,與傳統化學藥相比,來源豐富、藥用價值高、不良反應低、安全性高、使用方便,不易產生耐藥性[11-12],且康復新液具有廣泛抑菌、抗真菌、抗病毒、促生長、鎮痛、改善微循環、增強免疫、抗腫瘤的作用。研究康復新液對陰道炎菌群的抑制或殺滅作用不僅為開發利用美洲大蠊藥用資源提供了新的思路,也為臨床上治療念珠菌性陰道炎提供了新的候選藥物,減少廣大女性患者的痛楚。本研究對于合理、持續地開發利用美洲大蠊這一天然藥物資源具有重要的意義。
近年來對康復新液的研究越來越多,其藥物制劑在臨床上的應用也越來越廣泛,主要用于胃、十二指腸潰瘍、褥瘡、外傷、燒傷、燙傷等疾病的治療。康復新液是美洲大蠊干燥蟲體的乙醇提取物,其作為一種十分古老的昆蟲,是傳統的中藥材[13],味咸、性寒;治血瘀癥、寒熱、破積聚、喉咽痹、內寒無子[14],常以干燥或鮮成蟲入藥,藥用歷史悠久[15]。研究發現康復新液在臨床皮膚科、鼻科、外科、婦科和口腔科的疾病治療中取得了新進展[11],拓寬了康復新液的適應癥范圍,提升了康復新液的藥用價值。目前國內學者側重于美洲大蠊提取物藥用價值的開發和臨床應用[16],國外學者則偏重于各種化學成分的提取、鑒定、基因表達及分子生物學研究[17]。
本研究通過體外抑菌實驗簡便快捷地確認康復新液具有抗白色念珠菌標準株和23#臨床耐藥株作用,進而聯合體內動物實驗,以標準株感染小鼠陰道,造成穩定的念珠菌性陰道炎動物模型,進一步確證了康復新液抗白色念珠菌標準株作用。雖有研究證明康復新液對白色念珠菌具有抑制作用[7,18],但是目前并未有報道明確表明康復新液抗白色念珠菌臨床耐藥株及其作用機制。后續將以臨床耐藥株為主要菌株,進一步確證康復新液抗臨床耐藥株作用。

