基于最大截面特征的病變宮頸細胞核的自動篩查
韓穎 趙萌 陳勝勇 王照錫

摘 要:針對基于細胞圖像分割的病變宮頸細胞篩查中由于細胞精細分割復雜而不能實現篩查自動化的問題,提出一種省略精細分割步驟的宮頸細胞分類算法。首先,定義一種新的用于描述像素值分布的特征——最大截面(MAXSection)特征,將該特征與反向傳播(BP)神經網絡和Selective Search算法結合,實現細胞核感興趣區域(ROI)的準確提取(最高正確率100%);其次,基于最大截面特征定義了兩個參數——估計長與估計寬,用于描述病變細胞核的形態變化;最后,根據宮頸細胞發生癌變時其核會絕對增大的特點,利用以上兩參數實現病變細胞核(估計長與估計寬中至少一個參數大于65)與正常細胞核(估計長與估計寬均小于等于65)的分類。實驗結果表明,該自動篩查算法的準確率為98.89%,敏感度為98.18%,特異度為99.20%。該算法可以完成從輸入整幅巴氏涂片到輸出最終篩查結果的全部過程,實現病變宮頸細胞篩查的自動化。
關鍵詞:病變宮頸細胞篩查;精細分割;反向傳播神經網絡;Selective Search算法
中圖分類號:TP391.7
文獻標志碼:A
文章編號:1001-9081(2019)04-1189-07
Abstract: Aiming at the problem that the complexity of cervical cell image fine segmentation makes it difficult to achieve automatic abnormal cell screening based on cell image segmentation, a cervical cell classification algorithm without fine segmentation step was proposed. Firstly, a new feature named MAXimum Section (MAXSection) was defined for describing the distribution of pixel values, and was combined with Back Propagation (BP) neural network and Selective Search algorithm to realize the accurate extraction of nucleus Region Of Interest (ROI) (the highest accuracy was 100%). Secondly, two parameters named estimated length and estimated width were defined based on MAXSection to describe morphological changes of abnormal nucleus. Finally, according to the characteristic of absolute enlargement of cervical nucleus when cervical cancer occurs, the classification of abnormal nucleus (at least one parameter of estimated length and width is greater than 65) and normal nucleus (estimated length and width are both less than 65) can be realized by using the above two parameters. Experimental results show that the proposed algorithm has screening accuracy of 98.89%, sensitivity of 98.18%, and specificity of 99.20%. The proposed algorithm can complete the total process from the input of whole Pap smear image to the output of final screening results, realizing the automation of abnormal cervical cell screening.
Key words: abnormal cervical cell screening; fine segmentation; Back Propagation (BP) neural network; Selective Search algorithm
0?引言
世界衛生組織國際癌癥研究機構(International Agency for Research on Cancer)統計數據顯示,全球范圍內宮頸癌的發病率、患病率和死亡率在所有女性罹患的癌癥中均位居前五[1]。2018年2月,國家癌癥中心發布了最新的全國癌癥統計數據:在我國,宮頸癌的發病率在所有女性罹患的惡性腫瘤中排名第六[2]。而宮頸癌的發生和發展有一個漸進的演變過程,早期的癌前病變的治愈率非常高,因此宮頸癌的預防與篩查顯得尤為重要。基于巴氏涂片或液基細胞學涂片的細胞學篩查被認為是最常用且有效的方法,其操作簡單、成本低廉,通過人工或者計算機輔助手段完成宮頸病變篩查。人工閱片方法受限于閱片人的臨床經驗及閱片人其他的主觀意識等因素,與計算機輔助閱片相比,其工作效率較低。對計算機輔助細胞學檢查的研究從20世紀開始,通過結合計算機技術與病理學知識,診斷由于細胞病變而引發的癌癥。
計算機輔助宮頸細胞病變篩查的本質是通過提取并分析細胞或細胞核的形態學特征,來確定細胞是否發生癌變。大多數傳統的宮頸細胞篩查方法往往是基于細胞的精確分割結果[3],從而提取到基于分割結果的細胞形態特征,如長軸、短軸、面積、形狀等,對細胞的形態進行定量分析,結合閾值法[4]、聚類法[5]、支持向量機(Support Vector Machine, SVM)[6-8]、神經網絡[9-12]或多分類器融合[13-15]等方法完成細胞識別。利用這種基于精細分割結果的特征對細胞進行分類,其分類準確率必然受到分割結果準確性的直接影響,尤其在出現欠分割問題時,細胞形態特征值不準確甚至錯誤,會對接下來的分類產生嚴重的負面影響。在未涉及分割算法的研究中,基于細胞形態學的定量特征可直接獲取,即真實的分割數據默認存在[16-18]。由于宮頸涂片染色與制片技術的差異性、宮頸細胞形態的多樣性等原因,宮頸細胞的精細分割結果魯棒性不佳,其仍然是一個具有挑戰性的研究課題。隨著深度學習的發展,深度特征作為一種在大數據中自動學習而得到的特征在分類領域中取得了不錯的成績。深度特征不受分割精度影響,Zhang等[19-21]將其應用于宮頸細胞識別中。但是,由于醫學圖像樣本數量往往不能滿足深度學習的需求,數據擴增、遷移學習等策略普遍應用,增加了算法的復雜度。
為避免宮頸細胞分割對分類結果的影響,省略傳統分割步驟的細胞核分類算法應運而生。Zhao等[22]通過對整幅圖像進行平均分割,并根據各個分割塊的圖像特征完成細胞核的分類。受此文啟發,本文提出一種基于最大截面(MAXimum Section, MAXSection)特征病變宮頸細胞核的自動篩查算法,旨在對包含細胞團簇的巴氏涂片進行病變細胞篩查,實現從輸入整幅巴氏涂片圖片到輸出最終宮頸癌細胞的篩查結果的全部過程。首先從整幅巴氏涂片圖像中提取感興趣區域(Region Of Interest, ROI),并根據其中像素值的分布,定義了名為最大截面的特征,該特征結合反向傳播(Back Propagation, BP)神經網絡實現細胞核ROI篩選。為彌補省略細胞精細分割步驟而缺少的細胞核定量特征,利用基于最大截面特征的估計長與估計寬來描述細胞核的形態。該算法在避開宮頸細胞分割難題的同時,準確地實現了基于細胞核形態變化的宮頸癌細胞篩查。
1?病變宮頸細胞核篩查模型
宮頸細胞篩查的目的是識別出病變細胞,進而實現宮頸癌的預防與治療。本文通過對宮頸細胞核形態變化的分析,提出了一種基于最大截面特征的病變宮頸細胞篩查算法。該算法可分為兩個部分:1)基于BP神經網絡的細胞核篩選;2)基于統計閾值的細胞核分類。首先利用Selective Search算法提取可能包含細胞核的ROI并構建數據庫;之后,定義了一個名為最大截面的特征用于描述ROI像素的分布,并以此作為輸入,訓練和測試BP神經網絡;進而,利用訓練好的網絡預測未分類ROI的類別(細胞核或非細胞核);最后,定義了兩個基于最大截面特征的參數——估計長與估計寬用于描述細胞核的大小,統計分析正常細胞核與病變細胞核估計長度與估計寬度的值并確定閾值,并根據該閾值將細胞核分為病變細胞核與正常細胞核,實現對病變宮頸細胞的篩選。本文算法流程如圖1所示,該算法完成了從輸入未經處理的巴氏涂片到輸出篩查結果的全部過程。
1.1?Selective Search算法
Selective Search算法[23]最初是由Uijlings等提出的,用于為目標識別提取ROI,即在圖像中尋找并定位可能包含目標的區域。Selective Search將基于圖的圖像分割算法和分層算法相結合,基于初始分割域之間的相似性,一次完成多尺度多目標的提取,具體步驟如下:
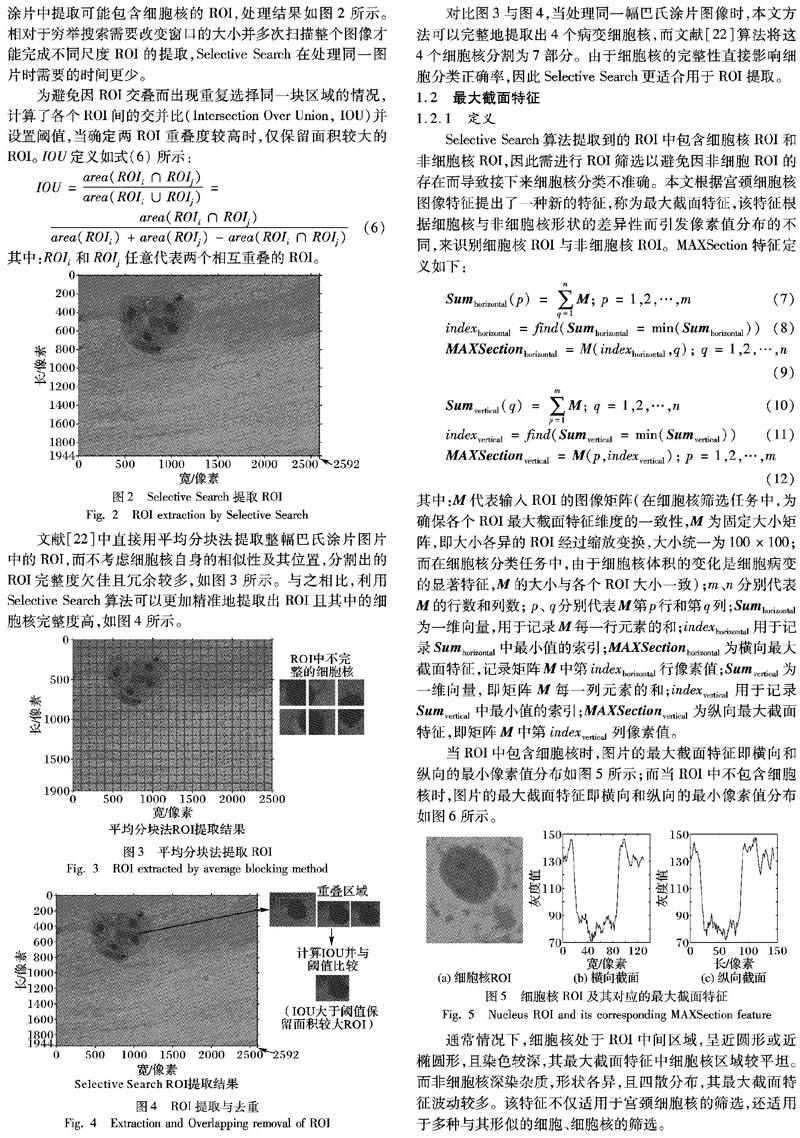
通常情況下,在整幅未處理的巴氏涂片圖片中包含著大小各異、形狀不規則且染色深淺不同的宮頸細胞核,為完成接下來的基于細胞核形態變化的宮頸癌細胞篩查,本文首先采用適合于多尺度圖像處理的Selective Search算法從整幅巴氏涂片中提取可能包含細胞核的ROI,處理結果如圖2所示。相對于窮舉搜索需要改變窗口的大小并多次掃描整個圖像才能完成不同尺度ROI的提取,Selective Search在處理同一圖片時需要的時間更少。
為避免因ROI交疊而出現重復選擇同一塊區域的情況,計算了各個ROI間的交并比(Intersection Over Union, IOU)并設置閾值,當確定兩ROI重疊度較高時,僅保留面積較大的ROI。IOU定義如式(6)所示:
文獻[22]中直接用平均分塊法提取整幅巴氏涂片圖片中的ROI,而不考慮細胞核自身的相似性及其位置,分割出的ROI完整度欠佳且冗余較多,如圖3所示。與之相比,利用Selective Search算法可以更加精準地提取出ROI且其中的細胞核完整度高,如圖4所示。
對比圖3與圖4,當處理同一幅巴氏涂片圖像時,本文方法可以完整地提取出4個病變細胞核,而文獻[22]算法將這4個細胞核分割為7部分。由于細胞核的完整性直接影響細胞分類正確率,因此Selective Search更適合用于ROI提取。
1.2?最大截面特征
1.2.1?定義
Selective Search算法提取到的ROI中包含細胞核ROI和非細胞核ROI,因此需進行ROI篩選以避免因非細胞ROI的存在而導致接下來細胞核分類不準確。本文根據宮頸細胞核圖像特征提出了一種新的特征,稱為最大截面特征,該特征根據細胞核與非細胞核形狀的差異性而引發像素值分布的不同,來識別細胞核ROI與非細胞核ROI。MAXSection特征定義如下:
其中:M代表輸入ROI的圖像矩陣(在細胞核篩選任務中,為確保各個ROI最大截面特征維度的一致性,M為固定大小矩陣,即大小各異的ROI經過縮放變換,大小統一為100×100;而在細胞核分類任務中,由于細胞核體積的變化是細胞病變的顯著特征,M的大小與各個ROI大小一致);m、n分別代表M的行數和列數; p、 q分別代表M第p行和第q列;Sumhorizontal為一維向量,用于記錄M每一行元素的和;indexhorizontal用于記錄Sumhorizontal中最小值的索引;MAXSectionhorizontal為橫向最大截面特征,記錄矩陣M中第indexhorizontal行像素值;Sumvertical為一維向量,即矩陣M每一列元素的和;indexvertical用于記錄Sumvertical中最小值的索引;MAXSectionvertical為縱向最大截面特征,即矩陣M中第indexvertical列像素值。
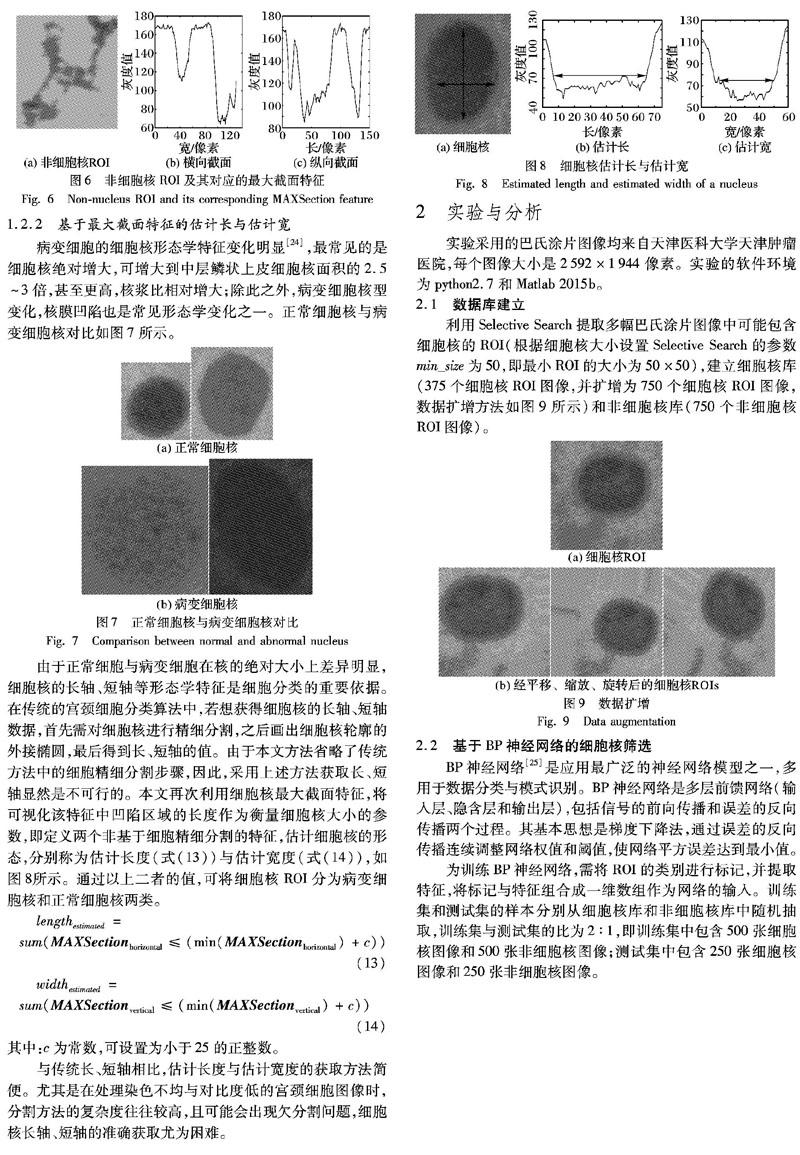
當ROI中包含細胞核時,圖片的最大截面特征即橫向和縱向的最小像素值分布如圖5所示;而當ROI中不包含細胞核時,圖片的最大截面特征即橫向和縱向的最小像素值分布如圖6所示。
通常情況下,細胞核處于ROI中間區域,呈近圓形或近橢圓形,且染色較深,其最大截面特征中細胞核區域較平坦。而非細胞核深染雜質,形狀各異,且四散分布,其最大截面特征波動較多。該特征不僅適用于宮頸細胞核的篩選,還適用于多種與其形似的細胞、細胞核的篩選。
1.2.2?基于最大截面特征的估計長與估計寬
病變細胞的細胞核形態學特征變化明顯[24],最常見的是細胞核絕對增大,可增大到中層鱗狀上皮細胞核面積的2.5~3倍,甚至更高,核漿比相對增大;除此之外,病變細胞核型變化,核膜凹陷也是常見形態學變化之一。正常細胞核與病變細胞核對比如圖7所示。
由于正常細胞與病變細胞在核的絕對大小上差異明顯,細胞核的長軸、短軸等形態學特征是細胞分類的重要依據。在傳統的宮頸細胞分類算法中,若想獲得細胞核的長軸、短軸數據,首先需對細胞核進行精細分割,之后畫出細胞核輪廓的外接橢圓,最后得到長、短軸的值。由于本文方法省略了傳統方法中的細胞精細分割步驟,因此,采用上述方法獲取長、短軸顯然是不可行的。本文再次利用細胞核最大截面特征,將可視化該特征中凹陷區域的長度作為衡量細胞核大小的參數,即定義兩個非基于細胞精細分割的特征,估計細胞核的形態,分別稱為估計長度(式(13))與估計寬度(式(14)),如圖8所示。通過以上二者的值,可將細胞核ROI分為病變細胞核和正常細胞核兩類。
與傳統長、短軸相比,估計長度與估計寬度的獲取方法簡便。尤其是在處理染色不均與對比度低的宮頸細胞圖像時,分割方法的復雜度往往較高,且可能會出現欠分割問題,細胞核長軸、短軸的準確獲取尤為困難。
2?實驗與分析
實驗采用的巴氏涂片圖像均來自天津醫科大學天津腫瘤醫院,每個圖像大小是2592×1944像素。實驗的軟件環境為python2.7和Matlab 2015b。
2.1?數據庫建立
利用Selective Search提取多幅巴氏涂片圖像中可能包含細胞核的ROI(根據細胞核大小設置Selective Search的參數min_size為50,即最小ROI的大小為50×50),建立細胞核庫(375個細胞核ROI圖像,并擴增為750個細胞核ROI圖像,數據擴增方法如圖9所示)和非細胞核庫(750個非細胞核ROI圖像)。
2.2?基于BP神經網絡的細胞核篩選BP神經網絡[25]
是應用最廣泛的神經網絡模型之一,多用于數據分類與模式識別。BP神經網絡是多層前饋網絡(輸入層、隱含層和輸出層),包括信號的前向傳播和誤差的反向傳播兩個過程。其基本思想是梯度下降法,通過誤差的反向傳播連續調整網絡權值和閾值,使網絡平方誤差達到最小值。
為訓練BP神經網絡,需將ROI的類別進行標記,并提取特征,將標記與特征組合成一維數組作為網絡的輸入。訓練集和測試集的樣本分別從細胞核庫和非細胞核庫中隨機抽取,訓練集與測試集的比為2∶1,即訓練集中包含500張細胞核圖像和500張非細胞核圖像;測試集中包含250張細胞核圖像和250張非細胞核圖像。
為體現最大截面特征在細胞核篩選任務中的優越性本文利用準確率(式(15))、敏感度(式(16))和特異度(式(17))三個指標來衡量。分別將方向梯度直方圖(Histogram of Oriented Gradient, HOG)特征(實驗一)、局部二值模式(Local Binary Pattern, LBP)特征(實驗二)、Gabor濾波特征(實驗三)和最大截面特征(實驗四)與樣本標記組合為一維數組作為BP神經網絡的輸入,對網絡進行訓練和測試。HOG特征將圖像局部區域的梯度方向直方圖作為特征,而梯度信息主要存在于圖像邊緣。一般情況下,細胞核染色相對于胞漿深,細胞核邊緣明顯,適合提取HOG特征。LBP特征是一種用來描述圖像局部特征的算子,具有灰度不變性和旋轉不變性等顯著優點。其中,灰度不變性即對灰度變化具有魯棒性,適用于染色以及光照不均的巴氏涂片圖片。Gabor濾波對圖像的邊緣敏感,能夠提供良好的方向選擇和尺度選擇特性,而且對于光照變化不敏感,能夠提供對光照變化良好的適應性,利用其提取到的紋理特征適合描述光照不均條件下的細胞核邊緣信息。
準確率=分類正確樣本個數樣本總數(15)
敏感度=預測正確陽性樣本個數真實陽性樣本總數(16)
特異度=預測正確陰性樣本個數真實陰性樣本總數(17)
重復各個隨機實驗10次,并記錄數據。采用預測值與類別標記值之差作為誤差來衡量測試的精度,設置誤差容忍度為±0.5,即當誤差小于±0.5,判定識別正確,并統計準確率。實驗1~4的數據記錄于表1,準確率與魯棒性比較如圖10,實驗數據對比如表2所示。
由實驗數據可知,利用最大截面特征訓練的BP神經網絡,其測試結果的準確率與魯棒性均優于HOG特征、LBP特征以及Gabor濾波特征,最高準確率為100%。當測試準確率最高時,保存BP神經網絡的各項參數與權值,其中基于最大截面特征的BP神經網絡分類器的具體設置如表3所示。基于最大截面特征的細胞核篩選優于文獻[22]算法利用LBP特征中的一致性旋轉不變模式(Rotation Invariant Uniform-LBP, RIU-LBP)完成的背景塊與異常塊篩選(背景去除準確率為99.97%,異常塊篩選準確率為 99.29%)。
輸入層神經元個數即為最大截面特征維度,由橫向最大截面特征(100×1)與縱向最大截面特征(100×1)拼接而成;隱含層神經元個數計算方法如式(18)所示:
2.3?基于統計閾值的細胞核分類
由于正常細胞與病變細胞在核的絕對大小上差異明顯,本文統計了細胞核數據集中195張(135張正常細胞核和60張病變細胞核)ROI估計長度與估計寬度的數值,正常細胞核的估計長與估計寬數值統計如圖11,病變細胞核估計長與估計寬二者的最大值統計如圖12。根據統計結果及實驗可知,當閾值設置為65時(估計長與估計寬均小于65時,判定細胞核為正常細胞核,否則判定為病變細胞核),細胞核分類的準確度最高。利用該方法對180張細胞核圖片進行篩查,其篩查準確率為98.89%。誤判為正常細胞核的病變細胞核如圖13(a)所示,誤判為病變細胞核的正常細胞核如圖13(b)所示。二者的誤判原因均為細胞核染色不均,進而造成估計長與估計寬不準確。
根據BP神經網絡的準確率與病變細胞核篩查準確率得出該算法的最高準確率為98.89%。該算法實現了基于宮頸細胞核的宮頸癌篩查,自動完成從整幅巴氏涂片到篩查結果的全部過程。采用準確率、敏感度度和特異度作為評價指標,對本文算法與其他宮頸細胞核二分類算法進行比較,結果列入表4。
從表4可知,在宮頸細胞二分類任務中,本文算法的準確度在5個算法的位列第二,僅低于文獻[22]算法0.09個百分點。
而對于宮頸細胞篩查而言,將異常細胞判定為正常細胞導致的后果更為嚴重,因此,敏感度是一個十分重要的衡量指標。從這個角度而言,本文算法優于其他4種算法。
3?結語
本文提出了基于最大截面特征與BP神經網絡的宮頸細胞病變細胞核自動篩查算法,該算法包括細胞核識別和病變細胞核篩查兩個步驟。與傳統的基于細胞精細分割結果的宮頸細胞分類算法相比,該算法實現了從輸入整幅未經處理的巴氏涂片到輸出最終篩查結果的全部過程。其優點在于:一方面,省略了傳統算法中的細胞分割步驟,很大程度上降低了該算法的復雜度;另一方面,消除了分割結果對分類準確度的影響。實驗結果表明,利用最大截面特征訓練得到的BP神經網絡的測試結果的準確性與魯棒性均優于其他特征。對于
整幅巴氏涂片圖像該算法能夠自動且精確地篩選出細胞核,并有效地篩查出病變細胞核,實用性強。目前,算法僅能夠將細胞核分為病變細胞核與正常細胞核,因此,對細胞核的多分類是本研究接下來要繼續的工作。另外,在提取ROI時,Selective Search參數自適應也是值得研究的問題。
參考文獻(References)
[1] CANCER TODAY. [EB/OL]. [2018-05-10]. http://gco.iarc.fr/today/explore.
[2] 陳萬青, 孫可欣, 鄭榮壽, 等. 2014年中國分地區惡性腫瘤發病和死亡分析[J]. 中國腫瘤, 2018, 27(1): 1-14. (CHEN W Q, SUN K X, ZHENG R S, et al. Report of cancer incidence and mortality in different areas of China, 2014[J]. China Cancer, 2018, 27(1): 1-14.)
[3] 劉一鳴, 張鵬程, 劉祎, 等.基于全卷積網絡和條件隨機場的宮頸癌細胞學圖像的細胞核分割[J]. 計算機應用, 2018, 38(11): 3348-3354. (LIU Y M, ZHANG P C, LIU Y, et al. Segmentation of cervical nuclei based on fully convolutional network and conditional random field[J]. Journal of Computer Applications, 2018, 38(11): 3348-3354.)
[4] 張鑫. 一種基于圖像內容的粗略分類方法研究[D]. 南昌: 南昌航空大學, 2015: 44-48. (ZHANG X. A method of research of general classification methods on image[D]. Nanchang: Nanchang Hangkong University, 2015: 44-48.)
[5] GENTAV A, AKSOY S, NDER S. Unsupervised segmentation and classification of cervical cell images[J]. Pattern Recognition, 2012, 45(12): 4151-4168.
[6] 魯武警. 基于Snake分割和SVM的宮頸細胞識別研究[D]. 濟南: 山東大學, 2015: 45-52. (LU W J. Study of cervical cell recognition based on Snake segmentation and SVM[D]. Jinan: Shandong University, 2015: 45-52.)
[7] CHEN Y F, HUANG P C, LIN K C, et al. Semi-automatic segmentation and classification of Pap smear cells[J]. IEEE Journal of Biomedical & Health Informatics, 2014, 18(1): 94-108.
[8] 趙理莉, 孫燎原, 殷建平, 等. 結合層次法與主成分分析特征變換的宮頸細胞識別[J]. 國防科技大學學報, 2017, 39(6): 45-50. (ZHAO L L, SUN L Y, YIN J P, et al. Cervical cell recognition based on hierarchical method and principal component analysis feature transformation[J]. Journal of National University of Defense Technology, 2017, 39(6): 45-50.)
[9] 呂緒洋. 宮頸細胞病理圖像的分類識別方法研究[D]. 桂林: 廣西師范學院, 2016: 22-33. (LYU X Y. The classification of cervical cell pathological image recognition method research[D]. Guilin: Guangxi Teachers Education University, 2016: 22-33.)
[10] 王爽. 宮頸細胞圖像分割與識別算法研究[D]. 青島: 山東科技大學, 2017: 40-47. (WANG S. Study on recognition and segmentation technology of cervical cell image[D]. Qingdao: Shandong University of Science and Technology, 2017: 40-47.)
[11] 關濤. 光學顯微宮頸細胞圖像的分割與識別方法研究[D]. 長沙: 國防科學技術大學, 2015: 103-116. (GUAN T. Segmentation and classification of optical microscopic cervical cell images[D]. Changsha: National University of Defense Technology, 2015: 103-116.)
[12] CHANKONG T, THEERA-UMPON N, AUEPHANWIRIYAKUL S. Automatic cervical cell segmentation and classification in Pap smears[J]. Computer Methods and Programs in Biomedicine, 2014, 113(2): 539-556.
[13] 李文杰. 一種多分類器融合的單個宮頸細胞圖像分割、特征提取和分類識別方法研究[D]. 桂林: 廣西師范大學, 2016: 47-58. (LI W J. Based on multiple fusion of single cervical cell image segmentation, feature extraction and classification recognition method research[D]. Guilin: Guangxi Normal University, 2016: 47-58.)
[14] LING Z, HUI K, CHIEN T C, et al. Automation-assisted cervical cancer screening in manual liquid-based cytology with hematoxylin and eosin staining[J]. Cytometry Part A, 2014, 85(3): 214-230.
[15] JIE S, XUAN X, HE Y, et al. Automatic detection of cervical cancer cells by a two-level cascade classification system[J]. Analytical Cellular Pathology, 2016, 2016(4): 9535027.
[16] ZHAO L, LI K, YIN J, et al. Complete three-phase detection framework for identifying abnormal cervical cells[J]. IET Image Processing, 2017, 11(4): 258-265.
[17] SARWAR A, SHARMA V, GUPTA R. Hybrid ensemble learning technique for screening of cervical cancer using Papanicolaou smear image analysis[J]. Personalized Medicine Universe, 2015, 4: 54-62.
[18] 劉艷紅, 羅曉曙, 陳錦, 等. 宮頸細胞圖像的特征提取與識別研究[J]. 廣西師范大學學報(自然科學版), 2016, 34(2): 61-66. (LIU Y H, LUO X S, CHEN J, et al. Research on cervical cell image feature extraction an recognition[J]. Journal of Guangxi Normal University (Natural Science Edition), 2016, 34(2): 61-66.)
[19] ZHANG L, LU L, NOGUES I, et al. DeepPap: deep convolutional networks for cervical cell classification[J]. IEEE Journal of Biomedical and Health Informatics, 2017, 21(6): 1633-1643.
[20] 盧磊, 羅曉曙, 孫妤喆, 等. 基于聯合特征PCANet的宮頸細胞圖像識別方法: CN106778554A [P]. 2017-05-31. (LU L, LUO X S, SUN Y Z, et al. Research of cervical cell image classification based on feature-united PCANet: CN106778554A [P]. 2017-05-31.)
[21] 郝占龍, 羅曉曙, 趙書林.基于同層多尺度核CNN的單細胞圖像分類[J]. 計算機工程與應用, 2018, 54(15): 181-184. (HAO Z L, LUO X S, ZHAO S L. Single cell image classification based on same layer multi scale kernel CNN[J]. Computer Engineering and Applications, 2018, 54(15): 181-184.)
[22] ZHAO M, WU A, SONG J, et al. Automatic screening of cervical cells using block image processing [EB/OL]. [2018-05-10]. https://doi.org/10.1186/s12938-016-0131-z.
[23] UIJLINGS J R, SANDE K E, GEVERS T, et al. Selective search for object recognition[J]. International Journal of Computer Vision, 2013, 104(2): 154-171.
[24] 彭振武.宮頸細胞學看細胞到底要看什么?[EB/OL]. [2018-06-13]. https://www.91360.com/201701/60/31313.html. (PENG Z W. What can be seen in the cell according to cervical cytology? [EB/OL]. [2018-06-13]. https://www.91360.com/201701/60/31313.html.)
[25] HECHT-NIELSEN R. Theory of the backpropagation neural network[C]// IJCNN 1989: Proceedings of the 1989 International Joint Conference on Neural Networks. Piscataway, NJ: IEEE, 1989: 593-605.

