胰島素傳遞體體外HPLC分析
龔菊梅, 劉修樹, 范高福, 劉龍云, 湯 潔, 范雪梅, 王義明
(1.合肥職業技術學院,安徽 合肥 230038; 2.清華大學 化學系,北京 100084)
傳遞體作為一種新型透皮給藥制劑[1],是在非封閉式給藥的方式下,在角質層水合梯度的驅動下,結合自身具備的高度變形作用,高效穿透比其自身小數倍的皮膚孔道,到達真皮,隨后是更深的組織,再經由淋巴系統進入血液從而使一些難以透皮的大分子藥物成功進入皮膚甚至進入體循環[2]。
本實驗采用高效液相色譜法對胰島素傳遞體體外測定分析方法進行研究,HPLC法在用于胰島素體外分析方法的建立上具有優勢明顯,具有準確度高,穩定性好、靈敏度強、重復性好等特點[3-4]。在方法的選擇上參考脂質體的分析方法和質量檢查項目,設計合理的胰島素傳遞體體外分析的方法學內容,主要包括色譜條件的選擇、系統適應性和方法專屬性條件的確定、精密度和準確度的判斷[5]、回收率[6]與包封率[7]方法的選擇和考察等,通過高效液相色譜儀建立合理的胰島素傳遞體體外分析的方法。同時驗證了此方法學的可行性和準確性,從而為胰島素傳遞體的處方設計、理化性質、體內分析和質量控制等后續研究提供堅實的理論基礎。
1 材料與方法
1.1 供試材料
L-2000高效液相色譜儀(日本日立公司);XS-105電子天平(梅特勒-托利多公司);Labway Science Micro 22R型高速冷凍離心機(北京博威興業科技發展有限公司);TYP-2型藥物透皮擴散試驗儀(上海黃海藥檢儀器有限公司);PHS-3C pH計(北京博遠祥德科學儀器有限公司)。胰島素對照品(sigma公司,批號:20121023);胰島素原料藥(sigma公司,批號:20130510);豬膽酸鈉(北京奧博星生物技術有限責任公司);葡聚糖凝膠G-50(分析純,北京索萊寶科技有限公司);三乙醇胺(分析純,天津市博迪化工有限公司);乙腈(色譜純,色譜純,德國merck公司);乙醇(分析純,北京化學試劑公司);磷酸二氫鈉(分析純,北京化工廠);卡波姆(Noveon公司)。
1.2 實驗方法
1.2.1 色譜條件與系統適應性試驗 色譜柱選用Phenomenex Luna C18 column (250 mm×4.6 mm, 5 μm),流動相:A 0.05 mol/L磷酸二氫鈉溶液(pH 3.0),B 乙腈;梯度洗脫如下: 0~6 min,26%~32% B;6~10 min,32% B;10~16 min,32%~38% B;16~22 min,38% B 流速:1 mL/min;柱溫:30 ℃;檢測波長:214 nm。
1.2.2 標準儲備液制備 精密稱取胰島素4.00 mg,加0.05 mol/L磷酸二氫鈉溶液(pH 3.0)定容于10 mL容量瓶中,配制成400 μg/mL的對照品儲備液,置4 ℃冰箱中保存備用。
1.2.3 對照品溶液的配制 精密量取胰島素對照品儲備液1 mL至5 mL容量瓶中,加0.05 mol/L磷酸二氫鈉溶液(pH 3.0)溶解并定容,得到濃度為80 μg/mL的胰島素對照品溶液。
1.2.4 供試品溶液配制 吸取胰島素傳遞體適量,置于10 mL容量瓶中,加入一定量乙醇破乳,用0.05 mol/L磷酸二氫鈉溶液(pH 3.0)稀釋至刻度,搖勻,制得供試品溶液。精密量取空白傳遞體0.5 mL,按上述方法破乳定容后,即得空白供試品溶液。
1.2.5 方法專屬性考察 分別取胰島素對照品溶液、空白傳遞體溶液和胰島素傳遞體供試品溶液各20 μL注入高效液相色譜儀,比較3組色譜圖,考察所用輔料對胰島素的含量測定是否有干擾,并記錄色譜圖。
1.2.6 線性關系考察 分別精密量取“2.2”節下對照品儲備液溶液(400 μg/mL),用0.05 mol/L磷酸二氫鈉溶液(pH 3.0)配制成400、200、100、50、25、12.5、6.25 μg/mL的對照品溶液,分別過0.45 μm濾膜,進樣,記錄峰面積,并以峰面積(Y)為縱坐標,質量濃度(C)為橫坐標得到標準曲線。
1.2.7 系統適應性試驗 取“線性關系考察”節下的對照品溶液,重復進樣5次,記錄峰面積和保留時間,計算RSD值。
1.2.8 精密度實驗 精密量取對照品儲備液適量,用磷酸二氫鈉溶液(pH 3.0)配制200、100、50 μg/mL的高、中、低3 個質量濃度的溶液,各3 份,參照“2.1”節下的色譜條件在1 d內進樣3次,每次20 μL,記錄峰面積,計算日內精密度;每天測定1 次,連續3 d,記錄峰面積,計算日間精密度。
1.2.9 回收率實驗 分別精密量取400、500、600 μL對照品儲備液(400 μg/mL)至2 mL容量瓶中,分別加500 μL的空白傳遞體,加入500 μL的乙醇破乳后,再用pH 3.0的磷酸鹽緩沖液定容至刻度,即得濃度分別為80、100、120 μg/mL含空白傳遞體的胰島素溶液。按“2.1”節下的色譜條件連續進樣20 μL,平行3次,記錄峰面積,計算回收率。
1.2.10 包封率及載藥量的測定 取3份胰島素傳遞體樣品,每份各1 mL分別置于1.5 mL的離心管中,于4 ℃,20 000 rpm,30 min條件下離心,取上清液約400 μL,定容至1 mL,經HPLC分析,計算傳遞體中未被包封的胰島素質量M1;另取胰島素傳遞體溶液400 μL,加入適量乙醇破乳后定容至1 mL,進樣分析,計算體系中總胰島素的含量M0,計算3 份樣品中胰島素傳遞體包封率(EE)[9-10],計算RSD值。
2 結果與分析
2.1 方法專屬性考察
通過對胰島素對照品溶液、空白傳遞體溶液和胰島素傳遞體供試品溶液的考察,所得色譜圖如圖1所示。
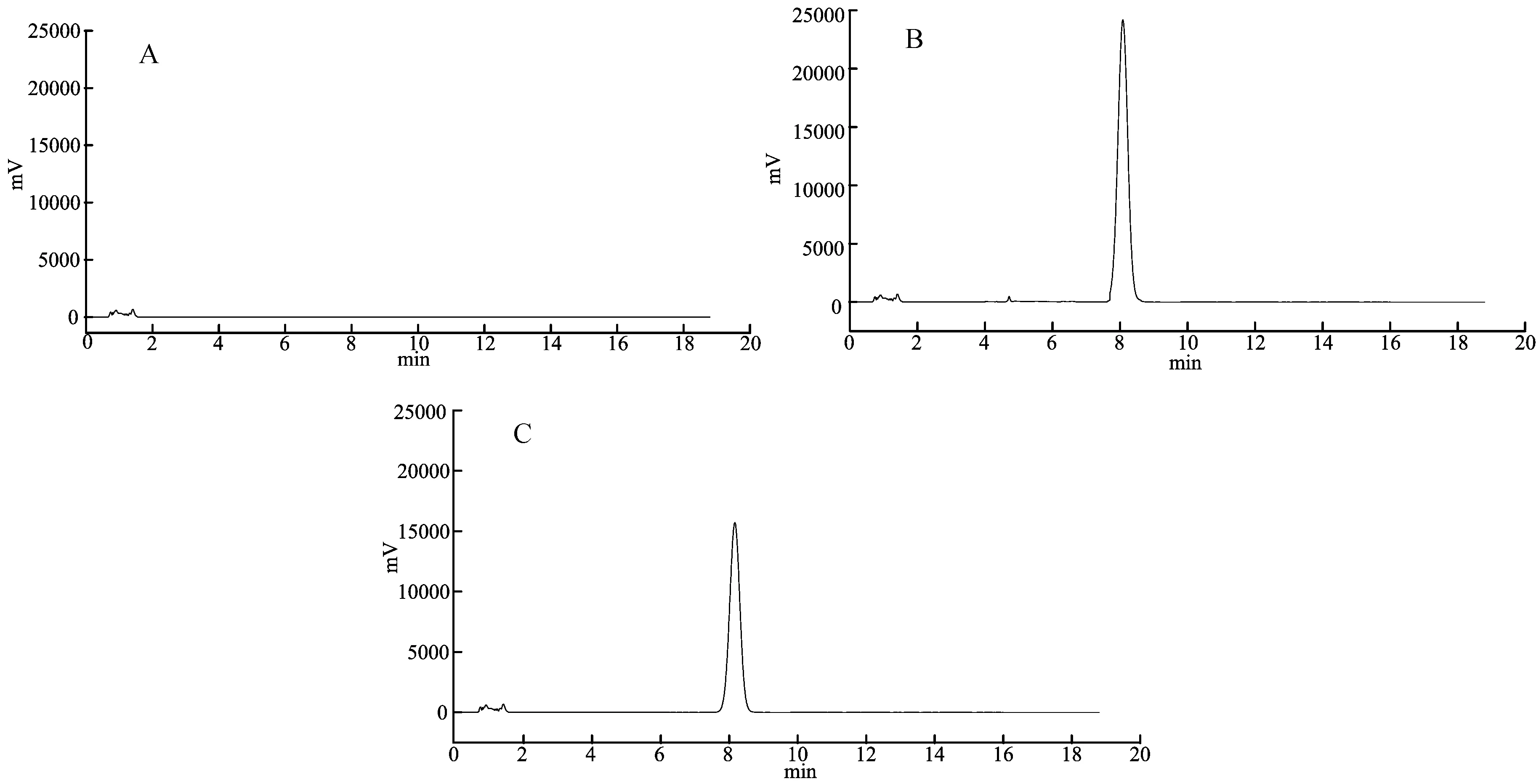
注:A空白傳遞體、B胰島素標準品、C胰島素傳遞體
由圖1可知,胰島素對照品溶液、空白傳遞體溶液和胰島素傳遞體供試品溶液的色譜圖中,胰島素的保留時間均在8.0~9.0 min,主藥峰與輔料峰良好分離,輔料對胰島素測定無干擾,表明此方法專屬性好。因此,此色譜條件可用于胰島素傳遞體中主藥含量的測定。
2.2 線性關系考察
胰島素溶液標準曲線見表1,標準曲線見圖2,線性回歸方程為Y=36 595X-288 707,R2=0.999 6,胰島素在6.25~400 μg/mL的濃度范圍內與峰面積呈良好的線性關系。

表1 胰島素溶液標準曲線測定結果
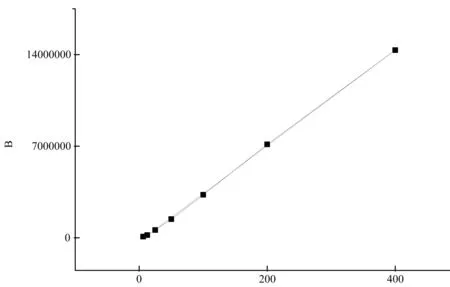
圖2 胰島素標準曲線
2.3 系統適應性試驗
通過胰島素對照品5次重復進樣后記錄的峰面積和保留時間的數值,計算得到的胰島素峰面積和保留時間的RSD值為1.02%、0.75%,均符合要求,說明該方法下的儀器系統適應性良好。
2.4 精密度實驗
日內和日間精密度結果見表2,結果表明該方法精密度符合方法學要求,可用于含量測定。
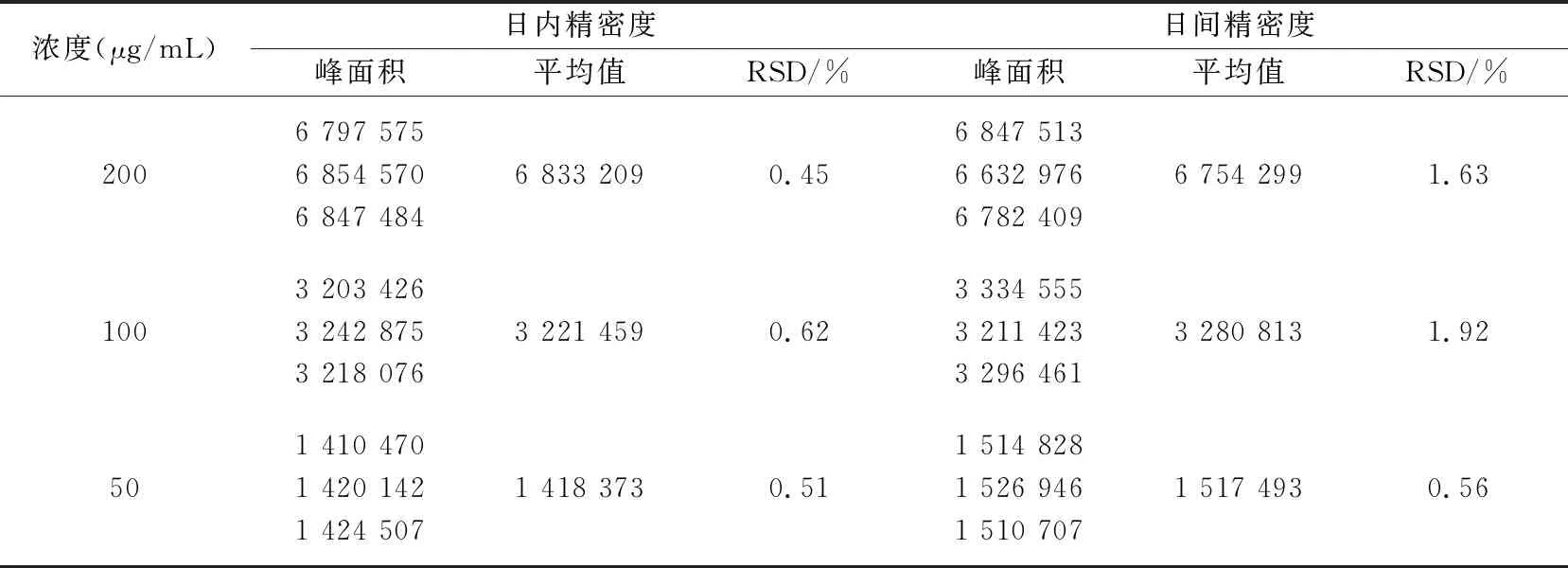
表2 胰島素傳遞體日內、日間精密度測定(n=3)
2.5 回收率實驗
回收率結果見表3,結果表明回收率在98%~105%之間,RSD值<2%,該方法回收率符合方法學要求,方法的準確性良好。
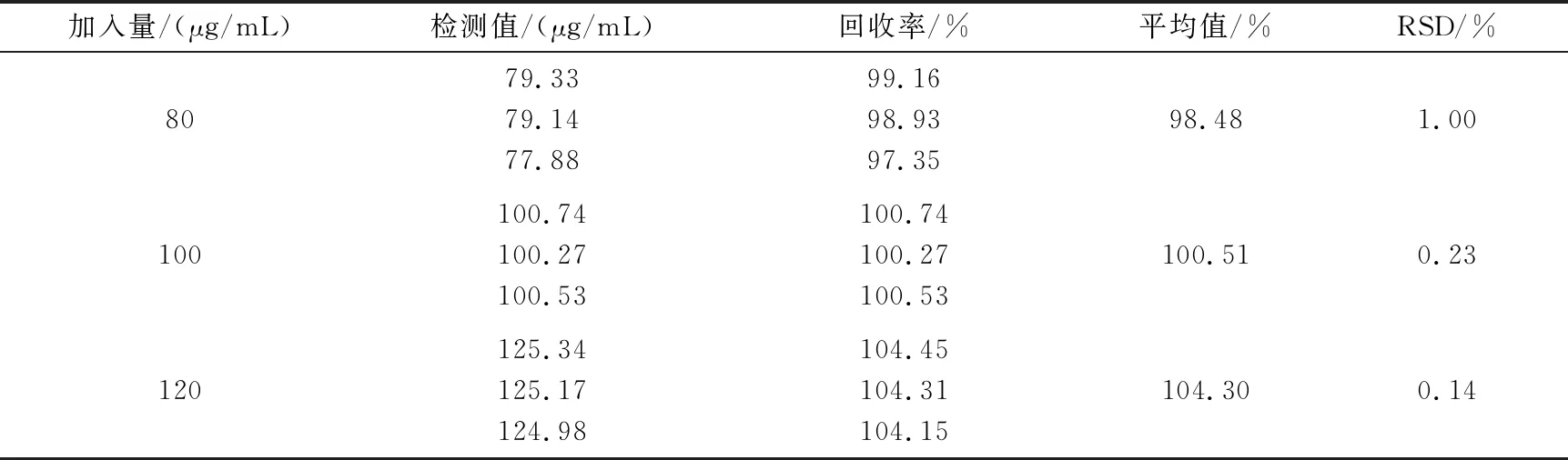
表3 胰島素傳遞體加樣回收率試驗結果
2.6 包封率及載藥量的測定
測定3批胰島素傳遞體供試品的包封率,3次實驗計算結果顯示,制得的傳遞體對胰島素的包封率3次測定結果分別為83.65%、83.53%、83.89%。均值為83.68%,RSD值0.18%。均滿足藥典對脂質體包封率的要求(>80%)。
3 結論與討論
傳遞體作為一種特殊的脂質體,具有高度的變形力。以傳遞體作為載體,介導胰島素可制備成經皮給藥制劑,通過透皮吸收解決胰島素不能口服,只能注射的缺點,為胰島素新制劑的研究提供一種思路。
本文采用了HPLC法建立胰島素傳遞體體外分析的方法,HPLC法準確性高[8],靈敏度強,重現性好,符合樣品分析要求[9]。系統適應性和方法專屬性考察中,輔料對主藥無干擾且方法準確性高[10];精密度和回收率均符合要求;同時確立了胰島素傳遞體包封率測定的方法:低溫高速離心法。此方法操作簡單,結果準確[11],測定的胰島素傳遞體包封率符合《中國藥典》要求。
包封率測定方法選擇的關鍵是游離藥物與傳遞體制劑的分離效果。本實驗中,以包封率為考察指標,對葡聚糖凝膠法、超濾離心法和低溫高速離心法3種常見的包封率測定方法進行比較,結果表明,胰島素傳遞體和未包封的游離胰島素在4 ℃,20 000 rpm,30 min的條件下能夠很好分離,通過測定游離胰島素的含量計算出的胰島素傳遞體的包封率,符合藥典對包封率的規定,最終確定低溫高速離心法作為胰島素傳遞體包封率測定的方法。

