植物鐵還原酶基因FRO的研究進展
喬孟欣 李素貞 陳景堂
(河北農業(yè)大學農學院 國家玉米改良中心河北分中心 河北省作物種質資源實驗室,保定 071001)
Fe是植物生長發(fā)育所必需的微量元素。Fe在植物體內可以發(fā)生Fe3+和Fe2+的可逆轉變并參與形成各種具有生理活性的鐵蛋白,如細胞色素和鐵氧還蛋白,其中鐵氧還蛋白在植物光合電子傳遞、硫酸鹽還原等氧化還原型生理代謝方面具有重要作用[1]。
Fe在地殼中的含量很高,但在有氧環(huán)境下,易與羥基結合形成不溶態(tài)而不能被植物直接吸收利用[2],且Fe在植物體中流動性小,Fe缺乏時植株老葉保持綠色,新葉葉脈間失綠,嚴重時可導致葉片白化。在長期的進化過程中,高等植物形成了不同的鐵吸收機理:即機理Ⅰ和機理Ⅱ,相應的植物稱為機理Ⅰ植物和機理Ⅱ植物。機理Ⅰ植物主要包括雙子葉植物和非禾本科單子葉植物[3],機理Ⅰ植物吸收鐵分為3個步驟,首先H+-ATPase酸化土壤中的三價鐵離子,隨后鐵還原酶基因(Fe3+chelate reductase,FRO)將土壤中的Fe3+還原成Fe2+,再由Fe2+轉運蛋白(Iron-regulated transporter,IRT1/IRT2)將Fe2+轉運至植物體內以供植物各部分生長發(fā)育[4];機理Ⅱ植物主要包括禾本科植物[3],其通過向胞外分泌植物鐵載體(Phytoziderophore,PS)與土壤中的Fe3+螯合形成Fe3+-PS復合物,再由專一轉運蛋白如黃色條紋蛋白(Yellow stripe-like,YSL)將Fe3+-PS復合物轉運至植物根部細胞內。
基于Fe對植物生長發(fā)育的重要性及其被吸收形式與存在形式之間的復雜性,研究植物鐵吸收機制以及相關基因的功能具有非常重要的意義,其中機理Ⅰ相關基因FRO已在多種植物中被發(fā)現與研究(表1)。本文將對擬南芥、番茄、大豆、水稻、花生及蒺藜苜蓿等植物的FRO的亞細胞定位、還原對象、誘導條件或影響因素等方面的研究結果進行總結及探討。
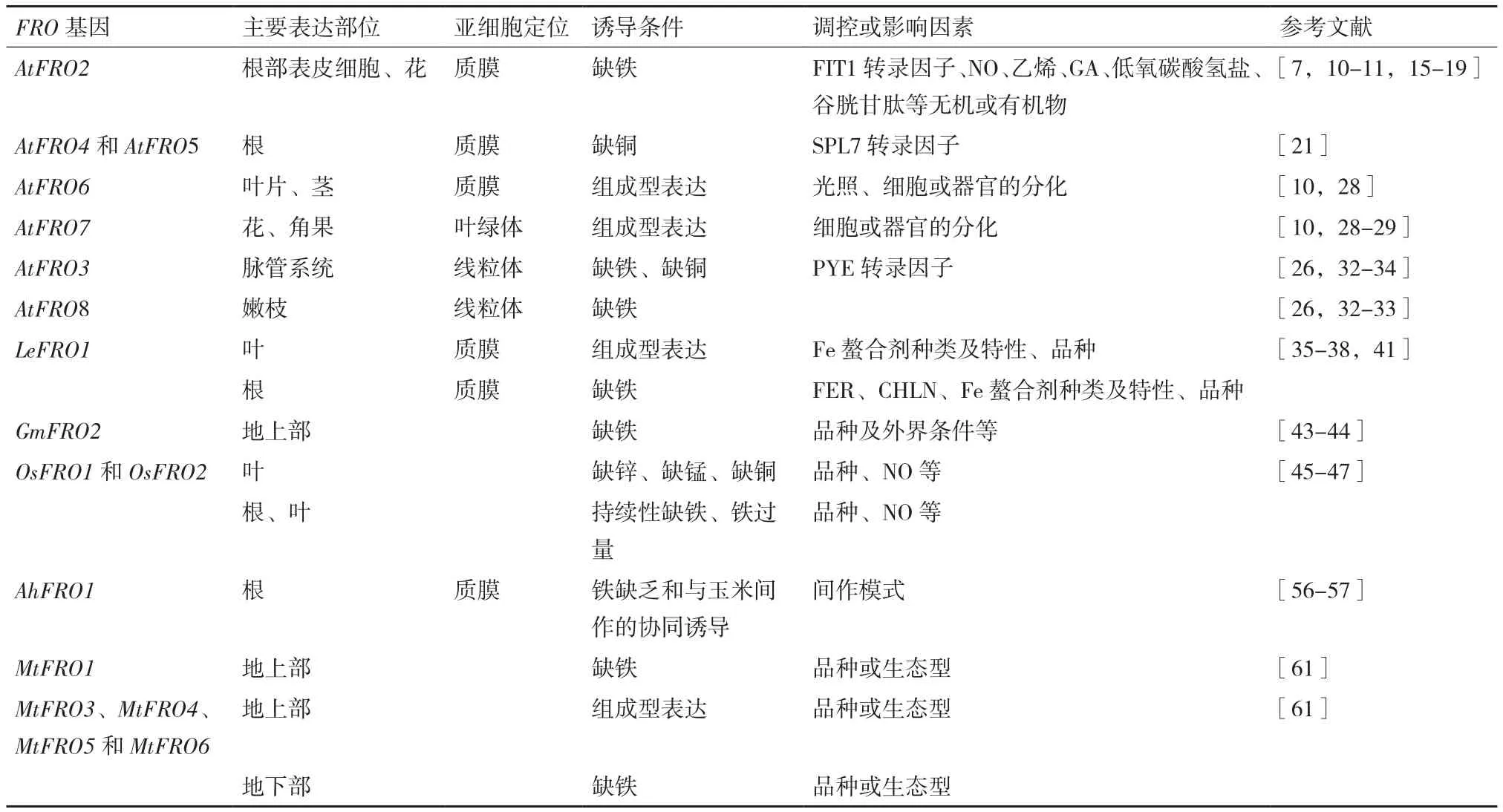
表1 不同植物FRO家族基因特征
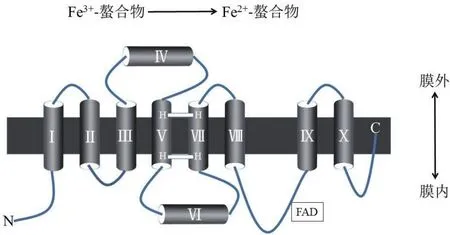
圖1 FRO的預測拓撲結構
1 FRO家族成員的結構特征
Robinson等[5]在缺鐵擬南芥的根中分離出第一個高等植物FRO,并將其命名為AtFRO2。該基因編碼的蛋白由725個氨基酸組成,預測等電點(pI)為9.37,相對分子質量(Mr)為81.50,屬于細胞色素b大家族,擁有提供電子的膜內血紅素結合位點和轉運電子的胞質內核苷酸輔酶因子結合位點。因此,AtFRO2可參與胞內的電子傳遞,從而發(fā)揮還原三價鐵的功能。其預測拓撲模型具有8個跨膜螺旋的膜蛋白、1個膜內螺旋蛋白、1個膜外螺旋蛋白和一個很大的水溶性結構域(圖1),該水溶性結構域包含NADPH、FAD和氧化還原酶結合位點(圖2),位于細胞內;N末端位于胞內,C末端位于膜外;兩對組氨酸殘基位于Ⅴ、Ⅶ跨膜螺旋上并組成血紅素基團結合位點(圖1);Ⅰ、Ⅱ、Ⅸ和Ⅹ跨膜螺旋在整個家族中不保守[6],這造成FRO基因家族成員之間亞細胞定位、功能等方面差異較大。另外,利用各種植物FRO家族基因的氨基酸序列進行系統(tǒng)進化分析,直觀地展示了FRO基因之間的親緣關系(圖 3)。

圖2 不同物種FRO蛋白的氨基酸序列比對分析

圖3 不同物種FRO成員的系統(tǒng)進化樹分析
2 植物中FRO基因的研究現狀
2.1 擬南芥FRO基因家族
擬南芥是最為典型的模式植物之一,AtFRO2的發(fā)現掀開了發(fā)掘FRO基因家族的序幕。迄今為止,在擬南芥中發(fā)現的FRO基因家族共有8個成員AtFRO1-AtFRO8,按其表達部位大致可分為3類:第一類在根中表達;第二類在幼苗中表達;第三類在繁殖器官中表達。其中,AtFRO1的表達量極低,所以針對AtFRO1的研究很少。
在AtFRO2的基礎上,Connolly等[7]用AtFRO2的反義探針作組織原位雜交發(fā)現,AtFRO2在根部表皮細胞中表達,同時將該基因的啟動子與GUS融合,經染色發(fā)現,該基因也在花中表達。Vasconcelos等[8]將AtFRO2轉入大豆,并在充足鐵供應條件下培養(yǎng),通過對根、莢皮、葉、種子中Fe、Mn、K等10種元素含量的測定發(fā)現,在種子中除了Fe的濃度有升高,Zn、Cu、Ni的濃度也有不同程度的升高,說明AtFRO2的表達不僅可以提高Fe的轉運效率,也可間接促進其他離子的轉運;Einset等[9]創(chuàng)制AtFRO2突變體frd1-1并用甜菜堿(Glycine betaine,GB)提前處理,而后在4℃低溫條件下培養(yǎng),發(fā)現擬南芥耐冷性顯著降低,說明AtFRO2有助于GB在低溫脅迫時更好地發(fā)揮對植物的保護作用。AtFRO2的表達受多水平的調控或影響,AtFRO2在缺鐵條件下植株各部位mRNA表達量和相應鐵還原酶活力的對比揭示了缺鐵條件對該基因在轉錄后水平上的調控[7];bHLH(basic helix loop helix)型轉錄因子FIT1(Fedeficiency induced transcription factor,AtbHLH29)在轉錄水平上調控AtFRO2[10-11],該轉錄因子可調控多種缺鐵誘導基因如IRT1、ZIP2(ZRT/IRT-like protein 2)等[12-14]。近年來,越來越多的研究表明NO、乙烯、GA、低氧碳酸氫鹽、谷胱甘肽等無機或有機物也能對AtFRO2的表達產生直接或間接影響[15-19],針對AtFRO2的表達調控網絡還在深入研究及完善。利用轉基因技術將AtFRO2導入其他植物體,能夠明顯減輕植物缺鐵黃化癥狀,而AtFRO2等位基因的變異也能引起AtFRO2表達和鐵還原酶活力的改變,在分子育種領域可利用該天然變異基因改善作物在缺鐵脅迫下的農藝性狀[20]。這啟示筆者在分子育種中插入外源基因時可尋找該外源基因的天然變異或適當對外源基因進行修飾以更好發(fā)揮該基因的功能。
AtFRO4與AtFRO5連鎖,兩者還原對象為Cu,在根中的轉錄水平很高并受轉錄因子SPL7(SQUAMOSA promoter binding protein-like7)調控[21]。SPL7是擬南芥中銅平衡的中心調節(jié)因子,可激活與銅穩(wěn)態(tài)有關的多個基因的轉錄,包括miR398、銅轉運蛋白和 CCH(Copper chaperone)[22-23]。spl7-2的生長缺陷可在充足鐵供應條件下被部分彌補,表明spl7-2突變的癥狀并不完全是由Cu穩(wěn)態(tài)被破壞引起的,可能還包括植株嚴重缺Cu對Fe吸收與運輸的影響[21]。所以,雖然AtFRO4和AtFRO5的還原對象為Cu,但也在一定程度上通過其轉錄因子SPL7活性的變化間接影響植物對Fe的吸收、運輸及利用。
植物從根部吸收鐵后需要在木質部中與檸檬酸等螯合成復合物進行長距離運輸[24-25],到達地上部的鐵復合物需再次被還原才能被利用。所以,位于地上部的FRO基因家族成員AtFRO6和AtFRO7也起著不可或缺的作用[26-27]。Wu等[10]在幼苗地上部檢測到AtFRO6和AtFRO7的轉錄,且無論供鐵條件如何,它們的轉錄水平都很高,說明兩者的表達均不受Fe調控,屬組成型表達。兩者在表達部位及亞細胞定位上存在很大程度的互補:AtFRO6主要在葉片和莖中表達[28],AtFRO7在花和角果等幼嫩組織中表達量高,兩者的亞細胞定位分別為質膜和葉綠體[29-30]。這種定位上的互補暗示它們在功能上的不同,但還需要大量的科學試驗證實,如在煙草中過表達AtFRO6增強葉片鐵還原酶活性和對缺鐵黃化的耐受性,已初步證實AtFRO6編碼的FRO具有在葉片中還原Fe3+的功能[31]。AtFRO6的啟動子中含有多個LRE(Light-responsive element)決定了AtFRO6的表達依賴光照。另外,體外誘導AtFRO6-promoter-GUS植株根部愈傷組織形成和分化的實驗證明,AtFRO6在分化的細胞或器官中表達量升高,AtFRO7也具有該特點[28]。綜合以上對AtFRO6和AtFRO7特性的研究,推測AtFRO6在光照條件下于葉片細胞質膜上還原鐵,并通過影響光合復合物的形成間接參與光合反應進程;AtFRO7在葉綠體中直接參與光合反應;兩者均在分化器官中表達,協同作用共同促進地上部Fe的二次還原。
AtFRO3-promoter-GUS染色結果證明AtFRO3在幼苗各部位均有表達,維管系統(tǒng)中表達量最高,AtFRO8的表達僅限于處在衰老過程中的嫩枝,AtFRO3和AtFRO8的亞細胞定位均為線粒體,表明兩種線粒體FRO家族基因成員可能在不同發(fā)育階段參與植株體內Fe3+-螯合物的還原[26,32-33]。bHLH型轉錄因子PYE(POPEYE)可直接與AtFRO3啟動子結合,轉錄分析表明,缺鐵野生型植株中的AtFRO3表達上調,而在缺鐵突變體pye-1中,AtFRO3的表達水平更高。因此,在缺鐵條件下,PYE可能在一定程度上降低了AtFRO3被誘導的程度[34]。所以在今后研究AtFRO3特性及功能時應充分利用缺鐵條件及突變體pye-1來提高AtFRO3的表達量以達到研究目的。
2.2 番茄FRO基因
番茄是研究機理Ⅰ植物Fe吸收分子機制的重要模式植物,在缺鐵脅迫下表現出典型的機理Ⅰ植物的形態(tài)和生理反應。番茄LeFRO1與擬南芥AtFRO2、豌豆PsFRO1具有較高相似度,分別為78%和81%。將該基因轉入酵母進行功能分析,發(fā)現LeFRO1編碼鐵還原酶,且該蛋白定位在細胞膜。LeFRO1在番茄根、葉、花、果實、子葉中均有表達,且在葉中的表達水平穩(wěn)定,而在根中受缺鐵誘導以及FER與CHLN的調控,其中FER是一種可調控番茄根部缺鐵反應的bHLH蛋白[35],該蛋白可與番茄SlbHLH068蛋白形成二聚體,并與LeFRO1啟動子結合上調LeFRO1的表達[36];CHLN編碼尼克酰胺合成酶(Nicotianamine synthase),尼克酰胺(Nicotianamine)可作為螯合劑促進Fe2+在韌皮部及細胞間的運輸,CHLN的缺失會引起葉脈間失綠,向根部傳達缺鐵信號,導致LeFRO1大量表達,即CHLN下調LeFRO1的表達[37]。合理利用以上兩種蛋白對LeFRO1表達相反的調控作用可有效維持番茄植株內的Fe代謝平衡。另外,近期研究發(fā)現,LeFRO1的轉錄還受Fe螯合劑特性的影響,施入的Fe螯合劑不同,LeFRO1的轉錄水平也會發(fā)生改變[38],這可能與Fe螯合劑能夠參與番茄根部的一系列缺Fe反應有關。除LeFRO1外,與其他元素吸收轉運相關的基因也可受缺鐵條件誘導[39-40],為提高番茄其他元素含量和改善番茄生長狀況提供了新途徑。在16個國內外主要番茄品種中,LeFRO1可根據其編碼的氨基酸種類不同分為3種LeFRO1MM、LeFRO1Ailsa和LeFRO1Mnita,三者在酵母中的轉錄豐度相似,但鐵還原酶活力卻呈現較大差異(LeFRO1Ailsa>LeFRO1MM>LeFRO1Mnita),而三者在番茄根中的鐵還原酶活力又與在酵母中不同,其中Moneymaker的鐵還原酶活力在缺鐵條件下顯著高于其他品種,這是Moneymaker被廣泛種植的原因之一[41]。由此推測酵母中轉錄豐度與鐵還原酶活力的不對等是由于特定位點的氨基酸種類不同。酵母中與番茄根中鐵還原酶活力的不對等是由于番茄根中鐵還原酶活力受多種因素的影響,如品種、其他基因的調節(jié)與干擾作用、地上部新陳代謝的影響以及外部環(huán)境條件的作用等。
2.3 大豆FRO基因
豆科植物在世界飲食中占有極其重要的地位,是礦質營養(yǎng)的主要來源。然而,其生長發(fā)育容易受土壤缺鐵的影響,因缺鐵導致的黃萎病嚴重影響豆科植物的產量[42]。所以,對豆科植物鐵還原酶活力及其相關基因的研究尤為重要。與擬南芥不同,大豆GmFRO2的主要表達部位并不是根部,而是在地上部發(fā)揮著與AtFRO7相似的功能。在缺鐵處理下,通過分析GmFRO2在不同品種大豆植株(抗缺綠癥、感缺綠癥)各部位(根、莖、子葉、單葉、三葉)的表達水平,發(fā)現其在根中的表達水平最低,其余器官的表達水平各不相同,其中抗缺綠癥植株所有器官中均表現出較低的表達水平[43]。針對這一現象可作出如下解釋:缺鐵脅迫容易誘導鐵還原酶基因的表達,缺鐵條件下,抗缺綠癥植株由于自身不易感特性,實際所受到的脅迫強度比感缺綠癥植株小,所以抗缺綠癥植株的GmFRO2的表達水平比感缺綠癥植株低。大豆的品種不同可影響其根部鐵還原酶活力對供鐵條件的反應,如Qiu等[44]對2個吸收和利用磷效率不同的大豆品種03-3(高)和Bd-2(低)的根部鐵還原酶活力進行測定,發(fā)現03-3的根系鐵還原酶活性在各種處理下均高于Bd-2,且在Fe濃度為20 μmol/L的處理下,03-3植株的根系鐵還原酶活性最高。盡管2個品種的鐵還原酶活力大不相同,但經測定,它們的GmFRO2表達水平卻非常接近,這表明該基因表達受轉錄后水平調控,該調控可能與植株對磷的高效利用能夠提高根系鐵還原酶活力有關,且該調控還需一定濃度的Fe進行誘導。大豆FRO的表達容易受品種及外界條件的影響,這增加了對大豆FRO研究的復雜性,但同時又為大豆育種及種質改良提供了多種途徑。
2.4 水稻FRO基因
在水稻根系特殊的生長環(huán)境中,鐵大多以可溶性還原態(tài)存在,所以不需要FRO的還原作用,但水稻地上部分或旱稻中有存在FRO基因家族的可能性。2006年,Ishimaru等[45]搜索到一個與AtFRO2同源的水稻基因,并在水稻基因組中確定了2類FRO基因分別為OsFRO1和OsFRO2;Northern雜交表明,OsFRO1在缺鋅、缺錳、缺銅的水稻植株葉片中表達,OsFRO2在缺鐵水稻葉片中表達。OsFRO2的表達可由鐵過量或持續(xù)性缺鐵誘導[46-47],缺鐵條件也可誘導水稻中機理Ⅰ特征基因IRT1的表達[45,48-50],說明水稻具有2種吸收鐵的機制,既是機理Ⅰ植物又是機理Ⅱ植物[51],且水稻吸收鐵的機制因品種而不同。啟示:水稻屬禾本科植物,在傳統(tǒng)定義中屬機理Ⅱ植物,如今有此發(fā)現,而同樣作為禾本科植物的小麥、玉米是否也具有此特征呢?在水稻中,缺鐵會抑制根的伸長[52],事實上,可以通過將多種與吸收、轉運鐵相關的基因共同轉入水稻植株中以顯著提高鐵含量、增強其對缺鐵的耐受性[53],如將酵母中變異的鐵還原酶基因refre1/372與OsIRT1啟動子融合后轉入水稻增強水稻在石灰性土壤中對缺鐵的耐受性[54],該融合基因與35S-OsIRO2(OsIRO2調控機理Ⅱ植物鐵吸收系統(tǒng)中各種基因的表達)共同轉入水稻更能增強這種特性,且可大大提高植株的生物量[55]。因此,可針對OsFRO1和OsFRO2的結構與功能展開深入研究,并利用基因編輯等技術對其進行修飾以更好發(fā)揮鐵還原酶功能,然后與其他基因融合轉入水稻植株中,爭取在更大程度上提高水稻Fe含量。
2.5 其他植物FRO基因
花生是我國重要的油料作物且具有諸多營養(yǎng)價值與益生功效。目前,AhFRO1和AhIRT1已經在花生中被分離出來,且兩者的表達均受鐵缺乏和玉米花生間作的協同誘導[56-57]。花生與玉米間作是改善花生缺綠癥、提高植株與莢果Fe含量的重要種植方式,與玉米間作可降低花生根際pH以及磷(P)濃度,從而提高花生根際有效Fe濃度;與玉米間作也可誘導AhYSL1的表達,AhYSL1在花生根部表皮細胞運輸 Fe3+-DMA螯合物[58-59],該運輸過程具有機理Ⅱ植物特征,表明花生作為機理Ⅰ植物可同時采用機理Ⅰ和機理Ⅱ 2種Fe吸收方式來抵抗缺鐵帶來的危害。蒺藜苜蓿作為模式豆科植物采用機理Ⅰ吸收運輸Fe,繼Andaluz等[60]發(fā)現MtFRO1之后,Del C Orozco-Mosqueda等[61]通過在蒺藜苜蓿全基因組范圍內進行同源序列比對,發(fā)現另外5種MtFRO拷貝,并對6種MtFRO的表達進行了分析,其中MtFRO2的表達量極低;MtFRO1在鐵充足條件下的表達量很低,但在鐵缺乏條件下的表達量升高,尤其是地上 部;MtFRO3、MtFRO4、MtFRO5和MtFRO6在鐵充足條件下只在地上部表達,但在鐵缺乏條件下,地上部和地下部的表達量均升高。
3 結語
鐵還原酶基因(FRO)編碼的蛋白可以將Fe3+還原為Fe2+以供植物吸收利用,對改善作物品質、提高作物產量具有重要作用。目前,該基因在擬南芥中研究得較為透徹,但擬南芥FRO家族各成員的轉錄水平及轉錄后水平調控的分子機制還不夠明朗,各成員的生理功能研究還不夠全面,尤其是定位至線粒體的成員AtFRO3和AtFRO8。包括擬南芥在內,不同種植物的FRO之間以及同種植物的FRO家族成員之間均存在共性與特性。首先,除AtFRO4和AtFRO5外,各FRO的還原對象均為鐵,且大部分易受缺鐵誘導。其次,各FRO的主要表達部位及亞細胞定位不盡相同,但親緣關系較近的FRO之間具有較高關聯度,如AtFRO4和AtFRO5、AtFRO6和AtFRO7在系統(tǒng)發(fā)育樹中處于同一分支,兩者的主要表達部位及亞細胞定位相同或呈互補關系。最后,除擬南芥外,其他植物FRO的表達均在品種間表現出較大差異,同時各FRO具有各自獨特的轉錄因子或影響因素,其中,bHLH家族對調節(jié)植物體內鐵平衡具有至關重要的作用。擬南芥bHLH家族共有147個成員[62],FIT以及PYE均屬于bHLH家族。FIT通常與其他bHLH轉錄因子(如bHLH38、bHLH39和bHLH101)形成異源二聚體或多聚體對其靶向基因AtFRO2發(fā)揮調控功能[63-64]。另外,PYE的表達受bHLH104與另一bHLH蛋白ILR3(IAA-LEUCINE RESISTANT3)互作的調控[65]。由此可見,bHLH家族不僅非常龐大而且成員之間的互作與調控機制錯綜復雜,但也為今后FRO表達調控的研究指明了方向。整體來看,FRO在水稻、小麥、玉米等主要糧食作物中的研究相對較少,主要是因為這些糧食作物屬于禾本科植物,普遍被認為采用機理Ⅱ吸收鐵,但越來越多的研究表明,機理Ⅱ植物中也具有機理Ⅰ特征蛋白,如玉米缺鐵反應中機理Ⅰ特征轉錄物成分的揭露、玉米ZmZIP基因家族的發(fā)現以及過表達ZmIRT1和ZmZIP3能夠促進轉基因擬南芥鐵和鋅的積累,且FRO已在玉米中預測到[66-69]。另外,科學家已完成玉米全基因組測序,所以,在此基礎上可進行玉米全基因組序列分析初步分離出玉米FRO,再分析各成員在不同鐵供應條件下的表達模式及功能,為挖掘玉米鐵高效基因、提高玉米等禾谷類作物鐵吸收效率、增加植株及籽粒中鐵含量提供新的途徑。

