小桐子低溫脅迫下microRNA實時熒光定量PCR內參的篩選與比較
孔春艷 陳永坤 王莎莎 郝大海 楊宇 龔明
(云南師范大學生命科學學院 生物能源持續開發利用教育部工程研究中心 云南省生物質能與環境生物技術重點實驗室,昆明 650500)
microRNA(miRNA)是一類大小為20-24 nt、具有調控功能的內源性非編碼RNA。眾多的miRNA參與了植物對低溫的感受、響應、信號轉導和適應過程[1-2]。在miRNA研究中,通常需要對miRNA在植物各組織和器官中的表達量進行分析,確定miRNA表達量對于探究miRNA的生物學功能尤其重要[3-4]。實時熒光定量PCR(quantitative real-time PCR,qRT-PCR)技術具有高靈敏性、特異性、快速簡單、低樣本濃度需求等優點,是研究基因表達的首選方法[1-2,5]。然而,qRT-PCR結果中基因表達量的精確和準確性分析依賴于所選擇的內參基因[6]。在qRT-PCR中,最常用的植物內參基因包括肌動蛋白(ACT)、甘油醛3-磷酸脫氫酶(GAPDH)、18S核糖體RNA(18S)和F-BOX家族蛋白(FP),但在miRNA定量檢測中并不選擇這些內參基因[7-8]。研究表明當選用ACT作為miRNA研究的內參時,由于目的miRNA與ACT的大小有較大的差異,在校正miRNA數據時并不理想[9]。不經篩選直接使用常見內參基因會降低試驗結果的準確性[10-12]。內參基因的穩定性差導致基因表達量檢測的誤差,如在研究雜交蘭(Cymbidium hybrid)花器官不同部位中八氫番茄紅素脫氫酶基因(ChPDS)的表達模式時,以雜交蘭泛素蛋白基因(ChUBQ)、雜交蘭延伸因子基因(ChEF-1α)、雜交蘭微管蛋白基因(ChTUB)、雜交蘭肌動蛋白基因(ChACT)及雜交蘭泛素蛋白基因(ChUBQ)和雜交蘭延伸因子基因(ChEF-1α)組合進行校正的雜交蘭ChPDS表達模式均為花瓣>唇瓣>蕊柱,而以穩定性最差的雜交蘭RNA聚合酶β亞基基因(ChrpoB)進行校正時,雜交蘭ChPDS相對表達量為花瓣>蕊柱>唇瓣[13]。因此,針對實際情況篩選內參基因很有必要性[1-2,5]。
小桐子(Jatropha curcas)是一種有巨大綜合開發潛力的多用途能源植物樹種,原產熱帶及亞熱帶地區,抗寒性較弱,是一種喜溫冷敏植物[14-16]。Maes等[17]進行的世界范圍內的調查表明,小桐子生長適宜的年均溫度為19.3-27.2℃,最低月均溫度要高于10.5℃。而隨著小桐子栽培的北移和向高海拔山區發展,低溫冷害已成為限制小桐子產業的主要環境因素[15-17]。為研究miRNA在小桐子低溫脅迫與適應過程中的調控作用,本課題組前期進行了小桐子小RNA-seq分析,初步獲得了差異表達與穩定表達的miRNA信息[18],但要進行進一步qRTPCR驗證,需要篩選合適的內參基因用于miRNA定量分析。但目前尚未見對小桐子miRNA qRT-PCR內參基因篩選的報道。
本研究基于小桐子小RNA-seq數據[18],篩選低溫處理前后表達量相對穩定的10個miRNA以及在其他物種miRNA定量分析中常用的U6作為候選內參,采用qRT-PCR方法對候選內參基因在低溫脅迫下的表達穩定性進行分析,以期篩選出可用于小桐子低溫脅迫下miRNA差異表達分析的穩定內參基因,為小桐子miRNA表達的定量分析提供參考。
1 材料與方法
1.1 材料
1.1.1 實驗材料 選取飽滿的小桐子種子,參照李忠光等[19]方法,用1.5% CuSO4溶液消毒,在恒溫培養箱中萌發5 d,將發芽的種子種在營養土中,在相對濕度75%、26/20℃、16/8 h光周期的培養箱中培養21 d,至第3片真葉展開[20]。
1.1.2 低溫處理 在小桐子長至第3片真葉展開時,轉入1℃光照培養箱中低溫處理5 d,每天取樣1次(LT1d-LT5d,取用第2片及以上展開真葉)。以未處理的小桐子作為對照1(C0d);另在正常培養條件下第26天取樣作為對照2(C5d)。依據前期結果,在1℃處理5 d時,小桐子幼苗死亡率約70%[20-21]。
1.2 方法
1.2.1 樣品miRNA提取及cDNA合成 參照Plant miRNA Kit(OMEGA公司)說明書提取miRNA,2%瓊脂糖凝膠電泳檢測miRNA的質量,NanoPhotometer-N60超微量分光光度儀(Implen,Germany)測定濃度,并通過OD260/OD280和OD260/OD230檢測miRNA的純度。采用miRcute miRNA First-Strand cDNA Synthesis Kit(Tiangen,北京)反轉 錄 cDNA。 反 應 體 系 為 Reaction Buffer 10 μL、Enzyme Mix 2 μL、miRNA 2 μL,加水至 20 μL。42℃孵育1 h,并在95℃加熱3 min失活逆轉錄酶(RT enzyme mix),進行miRNA加A尾反應以及cDNA第一鏈合成。cDNA用NanoPhotometer-N60超微量分光光度儀(Implen,Germany)測定濃度,每份樣本終濃度為100 ng/μL,取1 μL用于qRT-PCR。
1.2.2 qRT-PCR各供選基因引物設計 在11個候選內參基因中,U6snRNA序列來自于Jatropha curcas Database(JCDB)和NCBI;10個來自小桐子低溫脅迫下小RNA-seq[18]中表達穩定的miRNA,按照其序列設計引物,反向引物為:5′-GCTGTCAACGATACGCTACGTAACG-3′。 利 用 DNAMAN 8(Lynnon,USA)進行引物互補檢測,減少引物自身延伸或兩兩互補延伸形成二聚體的可能性(表1)。

表1 候選內參基因引物序列
1.2.3 qRT-PCR分析 根據TaKaRa公司的SYBR Premix Ex TaqTMⅡ(Tli RNase H PLUS)試劑盒說明書配置10 μL反應體系,cDNA模板1 μL(10 ng/μL)、正反向引物各 0.4 μL(10 μmol/L)、2×TransStar Tip Green qPCR SuperMix 5 μL 和 ddH2O 3.2 μL。所有操作均在冰上進行,3個重復,3次生物學重復。反應程序為 95℃ 30 s;95℃ 5 s,60℃ 30 s,45 個循環,并在65-97℃進行熔解曲線分析。利用LightCycler?96 System(Roche,Switzerland)進行qRT-PCR反應。
1.2.4 數據處理 記錄qRT-PCR分析得出的基因轉錄水平Ct值,每個基因在不同處理樣本中的Ct值測定3個重復。qRT-PCR熔解曲線利用LightCycler 96 SW 1.1(Roche,Switzerland)軟件進行作圖及分析;利用 geNorm(https://genorm.cmgg.be/)、NormFinder(https://www.moma.dk/normfinder-software/) 和BestKeeper(https://www.gene-quantification.de/bestkeeper.html)分析11個候選內參基因的表達穩定性;利用Microsoft Excel 2016進行數據作圖。
2 結果
2.1 miRNA質量檢測
通過2%瓊脂糖凝膠電泳檢測提取的miRNA樣品(圖1)。可見提取的miRNA質量較好;各樣品中miRNA的OD260/OD280、OD260/OD230的值均大于1.8(表2),miRNA質量滿足后續實驗的需求。

圖1 提取的miRNA2%的瓊脂糖凝膠電泳圖

表2 7個miRNA樣品的純度與濃度

圖2 內參基因的qRT-PCR分析
2.2 引物擴增特異性分析
以miRNA cDNA第一鏈為模板進行qRT-PCR擴增,用2%瓊脂糖凝膠電泳檢測(圖2)。11條內參基因條帶單一,通過測序、比對等檢測,確定擴增產物為引物特異性擴增產物,符合預期結果。

圖3 十一個候選內參基因的qRT-PCR熔解曲線
經熔解曲線分析,11條候選內參基因的熔解曲線均呈現明顯的單一峰(圖3),不存在引物二聚體,并且每個樣本的重復性較好,進一步說明引物的特異性,可進行后續實驗分析。
2.3 候選內參基因的表達分析
11個候選內參基因在不同溫度處理的小桐子葉片中,平均Ct值變化范圍為10.53-26.03(圖4),其中U6Ct值最小,miR2612Ct值最大(圖5)。

圖4 11個候選內參基因平均Ct值分布

圖5 各候選基因在不同處理下葉片組織中Ct值分布
2.4 內參基因的表達穩定性分析
利用GeNorm軟件對11個候選內參基因在不同處理下葉片組織中穩定性(M值)分析(圖6),M 值 由 高 到 低 為miR5672、miR5040、miR5535、miR1446、miR3624、miR5791、miR2612、miR159、miR3630、U6、miR6448,所選候選內參基因的M值均小于1.5,表明候選基因表達都較穩定,M值最低的是miR6448;其次是U6。可見miR6448在低溫脅迫下表達最穩定,其次是U6。
通過對不同處理下葉片組織中內參基因的NormFinder分析(表3),發現穩定值最小的是miR6448(0.088);其 次 是U6(0.134)。 這 與GeNorm分析得出的結果一致。
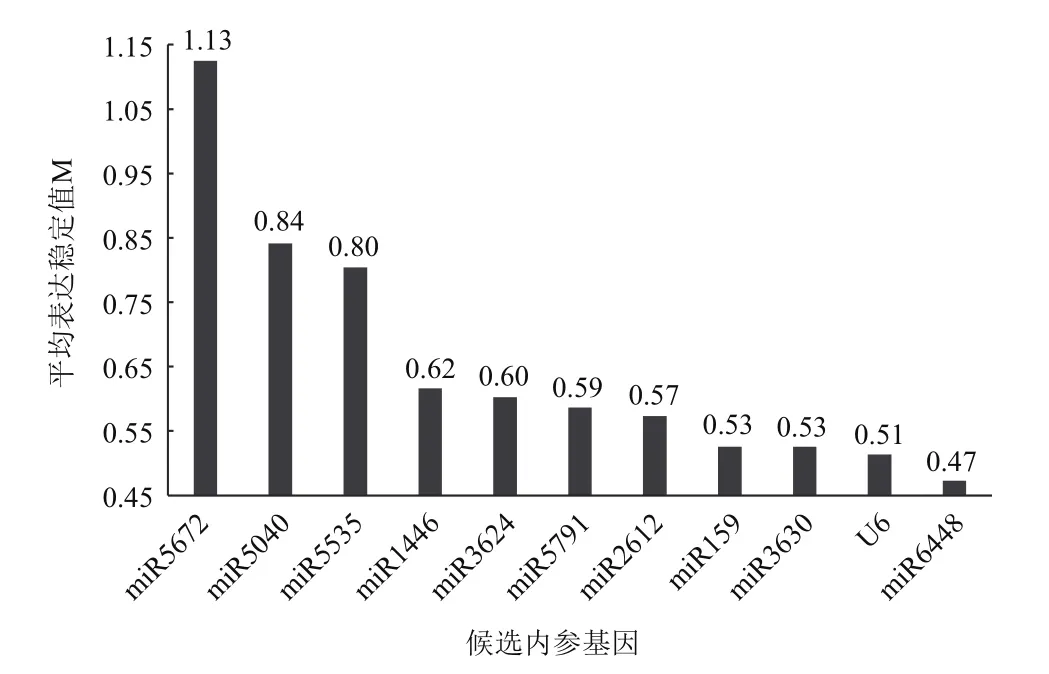
圖6 不同處理下葉片組織中內參基因的GeNorm分析

表3 不同處理下葉片組織中內參基因的NormFinder分析
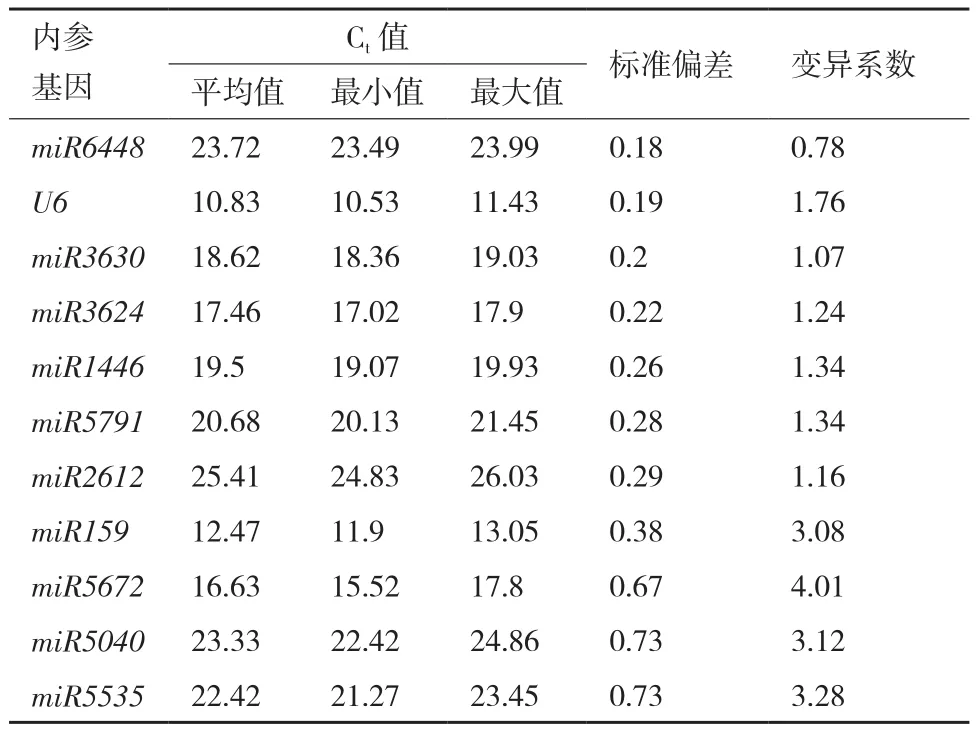
表4 不同處理下葉片組織中內參基因的BestKeeper分析
由BestKeeper分析標準偏差和變異系數,miRNA6448的標準偏差(0.18)和變異系數(0.78)都是最小的,表明miRNA6448在低溫脅迫下的小桐子中表達最穩定。
3 討論
進行qRT-PCR時,對內參基因的篩選非常有必要。內參基因在qRT-PCR中可以降低或校正基因定量過程中存在的誤差,選擇合適的內參基因對于基因定量表達的結果有重要意義[3,10]。而在選擇內參基因時,除內參基因的穩定性,內參基因的表達豐度也會影響qRT-PCR結果[13,22-23]。內參基因與所檢測基因之間的Ct值差異越小,擴增效率對計算結果的影響也會越小,計算的結果會更加準確[23]。如果目標基因和內參基因表達量(Ct值)過大,用內參基因來衡量目標基因的表達量就不完全可靠[10,23]。在本研究中,miR6448的 Ct值為 23左右,豐度適中,可以用于檢測qRT-PCR試驗中豐度較適中的轉錄本;U6的Ct值為10左右,可以用于miRNA qRT-PCR實驗中豐度較高的轉錄本檢測。
在進行miRNA研究時,提取的miRNA中往往棄除了mRNA等長鏈RNA,因此,相對鏈長較長的mRNA無法再用作miRNA定量研究的內參[24]。在qRT-PCR中,最常用的植物內參基因包括ACT、GAPDH、18S和F-BOX家族蛋白,通常在miRNA定量檢測中并不選擇這些內參基因[7-8]。常用于miRNA熒光定量的內參基因多為一些片段長度相對較短的基因,例如U6[3,25-26]。在大豆[27]、小麥[28]、龍眼[29]和百合[8]等植物 miRNA 的 qRT-PCR 分析中,miRNA的表達水平比最常用的ACT、GAPDH、F-BOX等蛋白質編碼基因穩定得多。
在miRNA的qRT-PCR分析時,常常需要根據不同的植物材料和處理條件來選擇合適的內參。茶樹低溫脅迫下,miRNA(PC-3p-222)在不同低溫處理以及不同茶樹組織中表達最為穩定,可作為茶樹低溫脅迫下miRNA的qRT-PCR的內參基因[30]。甘蔗芽在低溫脅迫下,miR171/18S rRNA和miR171/miR5059表達最穩定[31]。鹽脅迫下,U6適合作為大豆根組織miRNA研究的內參[32]。葡萄在鹽脅迫和低溫脅迫下,U6是表達最穩定的基因[1]。本研究發現,小桐子葉片組織對低溫脅迫處理響應的miRNA中,miR6448和U6的表達表現穩定。可見miRNA內參基因除特異性外,像U6這樣的基因也表現出一定的通用性。
4 結論
低溫脅迫下表達最穩定的基因是miR6448和U6。miR6448適用于表達豐度適中的microRNA基因表達定量分析中;U6適用于豐度較高的microRNA的qRT-PCR分析。

