馬鈴薯StSRP1的克隆、表達及生物信息學分析
龐鵬湘 常燕楠 尉瑞敏 郜剛
(山西師范大學生命科學學院,臨汾 041004)
橡膠延長因子基因(Rubber elongation factor protein,REF)家族包括橡膠延長因子基因(Rubber elongation factor,REF)、小橡膠粒子蛋白(Small rubber particle protein,SRPP)和脅迫相關基因(Stress-related protein,SRP)[1]。其中 REF/SRPP 有REF結構域,對橡膠的生物合成起決定性作用[2]。擬南芥SRPP在組織生長和發育以及干旱脅迫響應中起重要作用[3],擬南芥中有3種SRPP同源物,分別為SRP1、SRP2和SRP3,SRP在各組織中表達差異。由ABA和非生物脅迫誘導(干旱、高鹽度和低溫),與野生型相比,過表達SRP的轉基因擬南芥植株(35S:SRP1、35S:SRP2和35S:SRP3)具有更好的營養和生殖生長,并且對干旱脅迫具有更好的耐受性[3]。在云杉中通過半干燥處理后,SRP主要涉及滲透、內源激素、抗氧化蛋白、分子伴侶和防御相關蛋白[4]。Sano等[5]研究表明在不同脅迫條件下(脫水脅迫、滲透脅迫、鹽脅迫、淹水脅迫、熱脅迫和冷脅迫),成熟種子中的SRP被誘導。Hong等[6]研究表明CaSRP1(Capsicum annuumstress-related protein 1)之前被鑒定為SRPPs同源物,在水分脅迫的條件,CaSRP1被誘導,相對于野生型擬南芥,轉基因擬南芥植物中CaSRP1過表達導致耐旱性增強[7]。Eun等[8]研究表明SbSRP可能涉及ROS清除活性直接作為非酶抗氧化劑或間接誘導幾種編碼抗氧化酶的基因的表達。脅迫相關基因的表達導致代謝物的積累和生化和生理途徑的改變,這對于植物適應不利脅迫條件是至關重要的。
目前,關于馬鈴薯StSRP1的表達、功能等相關研究,鮮見報道。有文章表明,水稻種子干燥階段中,脅迫相關蛋白在水稻種子成熟過程中對耐干性具有重要作用[5],脅迫相關蛋白根據其生理功能分為3大類:分子伴侶(Molecular chaperones)、抗氧化蛋白(Antioxidative proteins)和晚期胚胎發育豐富蛋白(Late embryogenesis abundant proteins,LEA)。分子伴侶通過促進蛋白質的天然折疊和防止變性蛋白質的不可逆聚合,在應答脅迫中發揮重要作用[9]。熱休克蛋白(Heat shock protein,HSP)在熱休克應答中就是一大類分子伴侶,HSP通過蛋白質之間的相互作用介導調節多種細胞過程,參與熱休克脅迫[10];當非生物脅迫破壞細胞的代謝平衡時,有害ROS的水平會增強,抗氧化蛋白參與抑制攻擊DNA,蛋白質和膜的活性氧(ROS)的產生引起脂質過氧化和脫酯化[11];LEA蛋白在許多高等植物的種子中很豐富,并且可能普遍存在于植物種子中,LEA蛋白表達可以通過干燥脅迫或通過用ABA處理在植物的其他階段誘導[12]。
本研究采用電子克隆法,從馬鈴薯中克隆得到StSRP1序列,利用分子生物學公用數據庫,對基因的分子生物學特性、生化特性進行分析,預測蛋白質的結構,并對其進行定量表達分析。為研究該基因的結構和功能以及驗證馬鈴薯StSRP1在抵抗生物脅迫過程中的作用奠定基礎。
1 材料與方法
1.1 材料
選用中薯3號馬鈴薯塊莖作為試驗材料,將其放在高壓滅菌的草炭/蛭石土(3∶1,V/V)的營養缽中,在光照強度2 000-3 000 lx、光照時間16 h/8 h(晝/夜)、23℃/18℃(晝/夜)的光照培養箱中培養,待其長至7-8葉齡期,進行處理。
選取生理小種3號(race3)、生化變種2號(biovar2)的PO41菌株作為病原菌,在鑒定培養基(TTC培養基)中純化,在擴繁培養基(牛肉膏蛋白胨培養基)中擴繁。
1.2 方法
1.2.1 激素處理 根據Ni等[13]的方法,分別用50μmol/L 茉莉酸甲酯(MJ)、100 μmol/L 脫落酸(ABA,Sigma-Aldrich,St. Louis,USA)對馬鈴薯的7-8葉齡期幼苗進行噴霧處理。用0.1%乙醇噴霧處理作為對照。所有處理后的樣品均用透明聚乙烯塑料袋覆蓋,以保持濕度,分別于1、2、3、4和5 d時對植物地上部分取樣,液氮速凍,-80℃保存備用。
1.2.2 青枯菌處理 采用He等[14]的傷根灌菌法,通過分光光度計測量配置菌懸液濃度為108CFU/mL(A660=0.2)的菌液,取30 mL菌液接種至7-8葉齡期的幼苗,以水作為對照,分別于6、12、24、48和84 h對植株地上部分取樣,液氮速凍,-80℃保存備用[15]。
1.2.3 RNA提取及cDNA的合成 利用TaKaRa MiniBEST Plant RNA Extraction Kit提取馬鈴薯地上部分總RNA。使用分光光度計法進行定量檢測,用瓊脂糖凝膠電泳檢測其完整性。樣品cDNA合成操作按照PrimeScripTMRT-PCR Kit說明書進行。
1.2.4StSRP1的電子克隆 利用NCBI數據庫中的blastn(http :/BLAST.ncbi.nlm.nih.gov/BLAST.cgi)檢索前期工作中獲得的EST原始序列,找出其同源序列,發現與NCBI數據庫中XM_006359330.1相似性最高,為97%。通過bioedit軟件拼接序列,直到不能延伸。
1.2.5 StSRP1的生物信息學分析 利用BioEdit軟件分析基因序列并推導其相應氨基酸序列。用ExPASy-ProtParam(http://web.expasy.org/protparam/)分析氨基酸序列,用TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)分析跨膜結構,用SignalP(http://www.cbs.dtu.dk/services/SignalP/)分析信號肽,用 NetPhos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)分析磷酸位點,利用WOLF PSORT Server(https://wolfpsort.hgc.jp/)分析蛋白質的亞細胞定位,用Pfam(https://pfam.xfam.org/search)分析蛋白結構域。
用 PSIPRED(http://bioin f.cs.ucl.ac.uk/psipr ed/) 和 PRABI(https://npsa-prabi.ibcp.fr/cgi-bin/sec pred_hnn.pl)進行蛋白質二級結構預測,CPHmodels(https://swissmodel.expasy.org/)進行蛋白質三級結構預測。
通過NCBI的BLAST進行同源性分析,按照相似度由高到低的順序,選擇20條序列下載,利用MEGA 5.0軟件鄰接法(neighbor-joiningmethod,NJ)構建系統發育樹,使用1 000 bootstrap replicates。
利用 PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)搜索StSRP1啟動子的2 000 bp序列,通過分析目的基因的啟動子區域,找出轉錄基因的結合位點,從而分析目的基因受哪些轉錄因子的調控,定位潛在的順式作用元件。
1.2.6 實時熒光定量PCR 根據StSRP1序列設計特異性熒光定量引物(F:5′-CGGTGACATATGCGTCGGAG-3′和 R:5′-AACAGTGCCGTCGGTCAAGG-3′),正反引物各 0.4 μL、2×TransStart Top Green qPCR SuperMix 10 μL、模板(稀釋的 cDNA)2 μL,加ddH2O定容到20 μL。用Actin作為內參基因(F:5′-GACTCTGGTGATGGTGTCAG-3′和 R :5′-CTCGCTCAGCTGTGGTGGTG-3′),
2 結果
2.1 StSRP1的生物信息學分析
2.1.1StSRP1序列 前期實驗構建了病原誘導的馬鈴薯莖特異消減cDNA文庫,從該文庫中篩選出目的基因克隆,通過序列拼接獲得全長cDNA序列(Accession:MK224501),經BLAST分析,該基因與Solanum tuberosumstress-related protein(Accession:XM_006359330.1)相似性高達97%,故命名StSRP1。該基因序列包含一個867 bp的開放讀碼框,編碼288個氨基酸(圖1)。

圖1 StCUL1的核苷酸序列以及推導的氨基酸序列
2.1.2 StSRP1蛋白質的生物信息學分析 運用ProtParam和ProScal進行分析StSRP1理化性質分析,蛋白的分子量是30.682 kD、等電點是5.22、不穩定指數是38.19,該數值低于閾值40,為穩定蛋白,StSRP1屬于不穩定蛋白、半衰期在哺乳動物的網織紅細胞中為30 h,在酵母細胞中大于20 h,在大腸桿菌體內大于10 h,脂溶指數是增加球形蛋白的熱穩定性的一個積極因素,該蛋白的脂溶指數是86.81、正電荷殘基數(Arg + Lys)有26個,負電荷殘基數(Asp + Glu)有33個。蛋白質的種類、空間結構及活性、功能都與肽鏈中氨基酸的種類及順序有關,該蛋白是由20種氨基酸組成,其中Ala(A)含量最高,為15.3%,其次Pro(P)和Val(V),占9.7%;親水性平均系數(Grand average of hydropathicity,GRAVY)是-0.152,該數值為負值則說明該蛋白為親水性蛋白,反之為疏水性蛋白,疏水性氨基酸很明顯的少于親水性的氨基酸,并且親水性和疏水性都在第100-150個氨基酸區間達到最高值,所以StSRP1屬于親水性蛋白,StSRP1無跨膜結構和信號肽。亞細胞定位分析表明該蛋白位于內質網,并且該蛋白有絲氨酸(Ser)12個、蘇氨酸(Thr)16個、絡氨酸(Tyr)6個,共34個磷酸位點。該蛋白的保守結構域是REF(52-266)。
2.1.3 StSRP1系統進化分析 通過BLAST搜索比對,StSRP1與Solanum lycopersicumstress-related protein(Accession:XM_004247384.4) 相似性達97%,與Solanum pennelliistress-related protein(Accession:XM_015231821.1)相似性達96%,與Capsicum annuumstress-related protein(Accession:XM_016710268.1) 相似性達 88%。Solanum lycopersicum、Solanum pennellii和Capsicum annuum都屬于茄科。因此,馬鈴薯StSRP1與其他茄科植物SRP具有高度保守的序列結構。
運用MEGA5.0軟件中的鄰接法構建20個相關氨基酸序列的系統進化樹(圖2),從系統發生樹上節點位置和分支長度上分析,StSRP1與馬鈴薯、番茄同屬一支,它們可能具有共同的起源,與辣椒、煙草親緣關系次之。
2.1.4 StSRP1的二、三級結構分析 StSRP1蛋白約含49.65%的α-螺旋、5.56%的延伸帶和44.79%的無規則卷曲(圖3-A),用CPHmodels建立StSRP1的分子模型(圖3-B),模板Template= 2R6G.G、Id=13.0、Coverage=66.0,StSRP1的二級結構分析證實了StSRP1蛋白的三維模型是合理的。

圖2 StSRP1的系統進化樹
2.1.5StSRP1序列的啟動子分析 基于馬鈴薯基因組的公開序列,從馬鈴薯基因組DNA中獲得起始密碼子ATG上游2 000 bp 5′側翼序列。利用PlantCare在線軟件分析StSRP1啟動子序列,在StSRP1啟動子1 000 bp區域存在23種潛在的順式作用元件,并在許多位置發現多個核心順式作用元件,包括TATA和CAAT box。一系列假定的順式調控元件能夠使StSRP1可誘導或組織特異性表達,如參與脫落酸反應順式作用元素ABRE、參與光應答的順式作用調節元件G-box,MYBHv1結合位點CCAAT-box、參與防御和脅迫應答的順式作用元素TC-rich repeats。
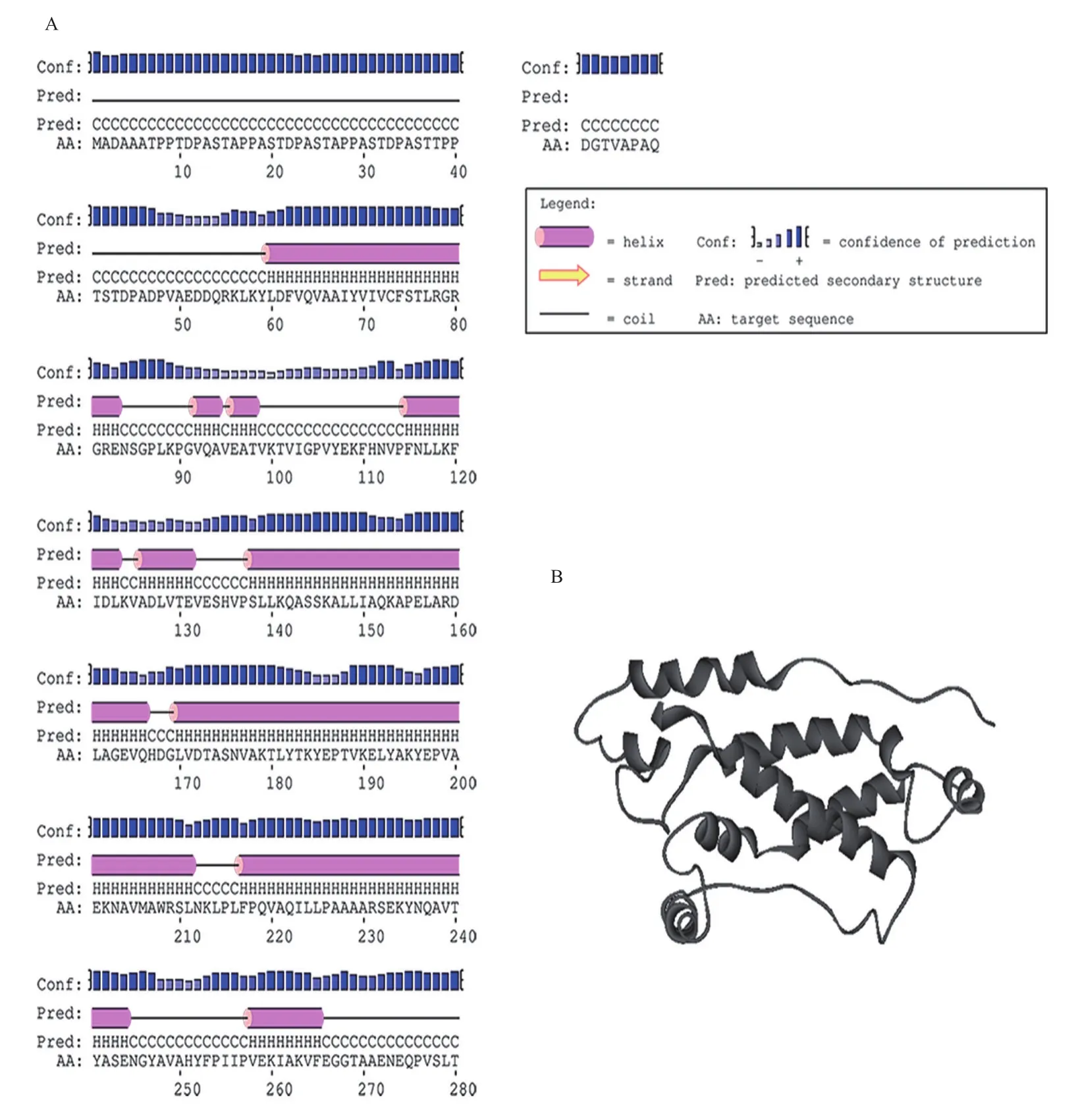
圖3 StSRP1蛋白二級結構(A)和三級結構(B)
2.2 StSRP1的表達量分析
2.2.1 青枯菌誘導StSRP1的表達模式 為了確定在細菌侵染下StSRP1的表達情況,以及StSRP1的表達隨時間推移的變化,對接種后馬鈴薯幼苗在不同時間點的誘導表達進行qRT-PCR分(圖4)。StSRP1受病原菌誘導,能在接種后快速、持續地表達。在接種24 h后,其表達水平開始顯著提高,并在接種48 h后表達量至最高水平,接種后84 h表達量迅速下降。相比對照組,StSRP1的表達量無明顯變化,一直處于較低水平的表達狀態。表明正常情況下,該基因在植物體內維持低水平表達,以調節基本的代謝,當受到病原菌脅迫時,表達量便會被上調,推測它與馬鈴薯抗青枯病相關免疫應答關系密切。
2.2.2 非生物脅迫下StSRP1的表達 為探討StSRP1蛋白在植物激素信號轉導細胞應答中的作用,通過研究StSRP1在MJ和ABA激素反應中的表達(圖5)發現,MJ和ABA都能夠不同程度地誘導StSRP1上調表達,經MJ處理后,StSRP1的表達量在3 d時達到高峰,在5 d時表達量開始明顯下降。經ABA處理后,StSRP1的表達量在1 d時增加后,在2 d時立即下降,然后在3 d時達到高峰。結果表明,不同激素處理誘導了StSRP1的表達,因此StSRP1可能在激素信號轉導過程中起著重要作用。
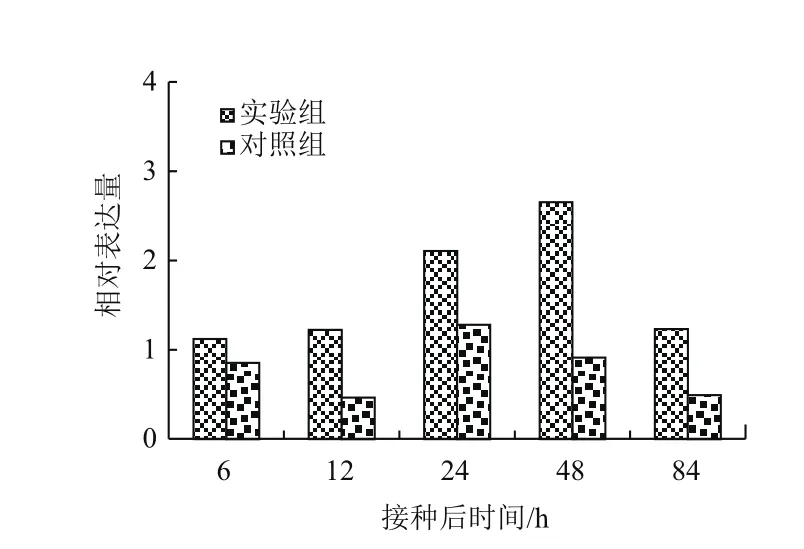
圖4 StSRP1在馬鈴薯與青枯菌互作早期時的表達分析

圖5 非生物脅迫下StSRP1的表達分析
3 討論
脅迫相關蛋白在植物響應逆境中至關重要,調節多種真核細胞的生命活動。這已在相關研究中得到支持。Park等[16]研究表明,SRP僅在高等植物中發現,并且對非生物脅迫信號傳導非常重要。木豆種子干燥過程中,脅迫相關蛋白在保護酶和脂質大分子中的有著重要作用[17],在大豆中,水脅迫條件下,70 kD HSP蛋白定位于內質網[18];在橡膠樹中SRPP和REF定位于內質網[19];在水仙花中,SbSRP在質膜中表達[20],這與通過生物信息學分析SPR蛋白的亞細胞定位一致。Qi等[21]研究表明含有REF結構域的基因參與脅迫應答,在水仙花中,SbSRP轉錄物在鹽,干燥,熱和冷脅迫下表現出更高的表達[20],關于StSRP1表達調控的研究很少。StSRP1預測的保守結構域是REF,表明StSRP1可能參與脅迫應答。
為了研究調節StSRP1表達的機制,選取StSRP1蛋白起始密碼子上游的2 000 bp堿基,預測其啟動子,啟動子中含有參與防御和脅迫應答的順式作用元素TC-rich repeats,進一步表明StSRP1可能參與脅迫應答。植物中的脅迫適應性應答通常涉及ABA激活的信號通路與其他植物激素(例如MeJA,水楊酸和乙烯)之間的協同和拮抗相互作用[22]。StSRP1的側翼序列中發現了參與脫落酸反應順式作用元素ABRE,它對StSRP1表達的影響沒有報道。StSRP1轉錄起始位點上游的片段對于在轉基因植物的發育中驅動轉基因表達可能具有很大的實用性,需要進一步的缺失分析來闡明StSRP1啟動子區的順式作用元件。顯然,用ABA、MJ和病原菌處理,StSRP1的表達量上調,為進一步研究StSRP1功能及在青枯菌脅迫下的響應機制提供了依據。
4 結論
經青枯菌誘導,克隆獲得的馬鈴薯StSRP1,全長867 bp,編碼289個氨基酸,含有REF保守結構域,屬于REF家族,與茄科科植物番茄SRP聚為一支。StSRP1可能參與馬鈴薯激素調控和逆抗逆應答。

