山羊Kruppel樣轉錄因子家族在前體脂肪細胞分化中的表達模式及相關性分析
朱江江,林亞秋,王永,,林森
山羊Kruppel樣轉錄因子家族在前體脂肪細胞分化中的表達模式及相關性分析
朱江江1,林亞秋1,王永1,2,林森2
(1青藏高原動物遺傳資源保護與利用四川省重點實驗室,成都 610041;2青藏高原動物遺傳資源保護與利用教育部重點實驗室,成都 610041)
【】優化山羊前體脂肪細胞體外培養體系,揭示Kruppel樣轉錄因子家族(KLFs)成員在前體脂肪細胞分化過程中的表達模式。于四川省簡陽大哥大牧業有限公司隨機選取3只7日齡簡州大耳羊為研究對象。放血致死并清洗后,在無菌環境中取其皮下脂肪組織。利用Ⅰ型膠原酶消化法獲得其皮下前體脂肪細胞,待細胞長至細胞密度為80%時傳代至6孔培養板中(F3代),以“150 μmol·L-1油酸+10 mg·L-1胰島素”前體脂肪細胞進行成脂誘導,并在誘導分化后0 d、3 d、5 d、7 d收集細胞,Trizol法提取細胞總RNA,利用實時熒光定量PCR(RT-qPCR)檢測KLF2-10, KLF 12和KLF15共11個KLF轉錄因子家族成員在不同分化階段細胞中的表達水平,并利用皮爾遜系數分析各個成員mRNA總體表達水平之間的相關性。150 μmol·L-1油酸+10 mg·L-1胰島素處理前體脂肪細胞24 h后細胞中開始出現小脂滴,48 h后脂滴數量增多、體積增大,誘導120 h后脂肪細胞分化程度顯著增加。RT-qPCR結果顯示,脂肪分化標志基因過氧化物酶體增殖物活化受體γ(PPARγ)基因隨著誘導分化的進行其表達水平持續上升,其中在第7天時其表達水平極顯著高于其他各組(<0.01)。、、、、和在脂肪細胞中表達水平顯著(<0.05)或極顯著(<0.01)高于前體脂肪細胞中表達水平,其中和在分化5 d時表達水平最高,和表達水平在7 d時最高,而則在3 d時表達水平最高;和在前體脂肪細胞中的表達水平極顯著高于分化后脂肪細胞中的表達水平(<0.01),其中、和的表達水平均在5 d時達到最低,而和則在7 d時表達水平最低;相關性分析結果顯示KLF家族各成員mRNA在山羊前體脂肪細胞分化過程中總體表達水平存在相關性,與6個基因具有較強的相關性,其次為和,分別與5個成員具有較強的相關性,而與其他基因均沒有較強的相關性。明確了KLF家族在山羊前體脂肪細胞分化過程中的表達模式,解析了各個成員mRNA表達之間的相關性,為闡明山羊前體脂肪細胞分化的分子機制提供重要的基礎數據。
山羊;前體脂肪細胞;分化;KLF
0 引言
【研究意義】脂肪組織在動物體內的分布及沉積是影響動物肉質性狀的關鍵因素,其中前體脂肪細胞分化造成細胞體積增大, 是影響動物脂肪沉積的主要方式。前體脂肪細胞分化是一個伴隨著細胞形態結構和功能變化的復雜生物過程,是諸多轉錄因子協同作用的結果[1]。近年越來越多的研究表明Kruppel樣轉錄因子家族(KLFs)可獨立或者協同其他轉錄因子調控脂肪細胞分化[2-3]。探討KLF家族基因對于脂肪細胞分化的調控作用和理清脂肪細胞分化的調控機制具有重要意義。【前人研究進展】KLF家族是一類具有鋅指結構的轉錄因子,在哺乳動物細胞生長、分化和疾病中發揮重要的調控作用[4]。截止目前KLF家族共有18個成員(即)被發現[5],其中有10個成員(—)可能參與脂肪細胞分化[6],但該結論以小鼠前脂肪細胞系研究結果為主,而且關于同一成員的調控作用存在分歧。BIRSOY等指出是3T3-L1前體脂肪細胞早期分化所必需的轉錄因子,然而PARK等在2017年卻提出了相反的觀點,即對3T3-L1前體脂肪細胞分化無影響[7-8]。JIANG等[9]指出可通過調控過氧化物酶體增殖物活化受體γ基因()的表達從而促進豬前體脂肪細胞分化,但對小鼠3T3-L1前體脂肪細胞分化卻沒有影響,表明該基因作用存在種屬特異性。GUO等[10]發現可通過結合的啟動子從而促進的轉錄。青藏高原動物遺傳資源保護與利用四川省重點實驗室前期分別克隆了藏山羊[11]及簡州大耳羊[12]、和[13]序列,并進行了組織表達分析。而對于其他成員而言,是機體紅細胞生成的主要調控因子[6],在細胞增殖等方面具有重要的調控作用[14],可調控機體糖酵解過程[15],在神經細胞突出生長具有重要調控作用[16],可抑制腫瘤細胞的增殖和惡化[17],而則是剛發現的家族新成員[5]。目前還沒有關于在山羊前體脂肪細胞分化中的研究。因此,在已有研究的基礎上,在山羊前體脂肪細胞中驗證KLFs家族特別是等脂肪分化相關基因的功能對揭示山羊肌內脂肪沉積的分子調控機制具有重要意義。【本研究切入點】青藏高原動物遺傳資源保護與利用四川省重點實驗室前期RNA-Seq測序發現轉錄因子家族基因可能參與山羊脂肪沉積過程,然而其功能研究并不能完全參照鼠源細胞系中的研究結果,必須以體外培養的山羊前體脂肪為研究對象來進行。KLFs家族各個成員的生物學功能不同,有的激活靶基因表達,有的抑制靶基因表達[18]。并且各個成員之間存在相互調控的網絡關系[19-20]。然而,KLFs家族各成員在脂肪細胞分化中的表達情況及相關性究竟如何還不清楚。【擬解決的關鍵問題】為了探究KLFs家族基因在山羊肌內脂肪沉積中的作用,本研究以山羊前體脂肪細胞分化調控為切入點,在優化山羊前體脂肪細胞體外培養的基礎上,選擇目前已經報道的對細胞分化可能具有調控作用的和(除已有報道外)[13]11個KLFs家族成員為研究對象,利用實時熒光定量PCR(RT-qPCR)檢測它們在不同成脂誘導分化階段細胞中的表達水平,明確在分化過程中的表達模式,分析各個成員之間基因表達的相關性,為進一步闡明KLF轉錄因子家族網絡調控山羊脂肪沉積的作用及分子機制提供重要的基礎數據。
1 材料與方法
1.1 試驗動物與樣品采集
試驗于2017年在西南民族大學生命科學與技術學院完成。于四川省簡陽大哥大牧業有限公司隨機選擇3只7日齡的簡州大耳羊羔羊為試驗動物。羔羊帶回實驗室后放血致死,消毒后解剖取其皮下脂肪組織用于細胞培養。
1.2 主要試劑
I型膠原酶、油酸、牛血清白蛋白和胰島素購自Sigma公司產品,胰蛋白酶和DMEM/ F12培養基購自Hyclone公司產品,胎牛血清購自Gemini公司產品。SYBR?Premix ExTM (2×)購自大連TaKaRa公司,2×PCR Master Mix和Revert Aid First Strand cDNA Synthesis Kit購自Thermo公司。總RNA提取試劑盒購自天根生化科技(北京)有限公司。
1.3 山羊前體脂肪細胞的分離培養
將3只7日齡的簡州大耳羊頸動脈放血后用新潔而滅清洗2—3次,再用75%酒精擦拭消毒,在無菌環境中取其皮下脂肪組織,用含3倍雙抗的PBS清洗3次后將其剪碎,等量混合3只羔羊組織樣品后加入2倍體積的I型膠原酶消化1 h(每5 min震蕩一次),并加入等體積的10%胎牛血清培養液終止消化。濾液分別過200目和400目后分裝到離心管中,2 000 r/min離心5 min,棄上清,加入紅細胞裂解液靜置5 min,2 000 r/min離心5 min,棄上清,用PBS洗3遍后,取適量的重懸液分別接種到25 cm2的培養瓶中,加入適量完全培養基混勻后,于37℃,5% CO2的培養箱中培養,隔2 d更換新鮮培養基。
1.4 山羊前體脂肪細胞的傳代培養及誘導分化
當原代細胞長至80%細胞密度時,用0.25%胰蛋白酶消化2 min,棄掉胰蛋白酶,加入適量完全培養基終止消化,1 000 r/min離心3 min,加入適量完全培養基混勻后,按照1﹕3傳代接種于25 cm2的培養瓶中在37℃,5% CO2的培養箱中培養,隔2 d換液。待細胞長至80%細胞密度時再傳代2次最后至6孔培養板中(即F3代),然后用含150 μmol·L-1油酸+10 mg·L-1胰島素的完全培養基培養至不同時間收集用于基因表達模式的檢測。
1.5 基因表達檢測
分別取誘導0、3、5和7 d的F3代細胞(每個時間點3個重復),利用RNA提取試劑盒提取總RNA,按照反轉錄試劑盒說明書以 Oligo (dT) 為引物合成cDNA第一鏈。利用 Primer Premier5.0 軟件,根據本實驗室前期提交GenBank數據庫的山羊(、和)序列設計特異引物(表1),利用RT-qPCR檢測它們在不同成脂誘導分化時間段中的表達水平。RT-qPCR反應體系如下:SYBR?Premix ExTM (2×) PCR 10 μL,10 μmol·L-1上下游引物各0.5 μL,模板cDNA 1 μL,ddH2O 8 μL。二步法PCR反應條件:預變性95℃ 1 min;PCR過程95℃ 30 s,60℃/62℃ 30 s,40個循環;添加溶解曲線95℃15 s,60℃30 s,95℃15 s;保存4℃forever。
1.6 數據統計分析
時序表達數據定量分析以誘導分化0 d的細胞Ct值為對照來計算,結果用2?△△Ct法進行統計分析。最終結果以SPSS 18.0軟件中的One-way ANOVA進行顯著性檢驗分析,采用Duncan法對各階段mRNA表達進行多重比較。并利用SPSS對各時期基因表達水平總體數據進行相關性分析,利用r值代表基因表達水平相關性。利用Cytoscape3.2.0對得到的相關性結果進行網絡分析,設置閾值位r>0.7。
2 結果
2.1 山羊前體脂肪細胞分化過程中的形態學變化
當細胞傳至F3代長至80%細胞密度后,加入誘導分化液培養24 h后細胞中開始出現小脂滴(圖1-A),48 h后脂滴數量增多、體積增大(圖1-B、C),誘導120 h后脂肪細胞分化程度顯著增加(圖1-D),脂滴經油紅O染色后可被染成橘紅色。

表1 引物信息
S:正義鏈引物; A:反義鏈引物; GAPDH:甘油醛-3-磷酸脫氫酶
S: Sense primer; A: Antisense primer; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase
2.2 轉錄因子KLF家族成員的表達模式
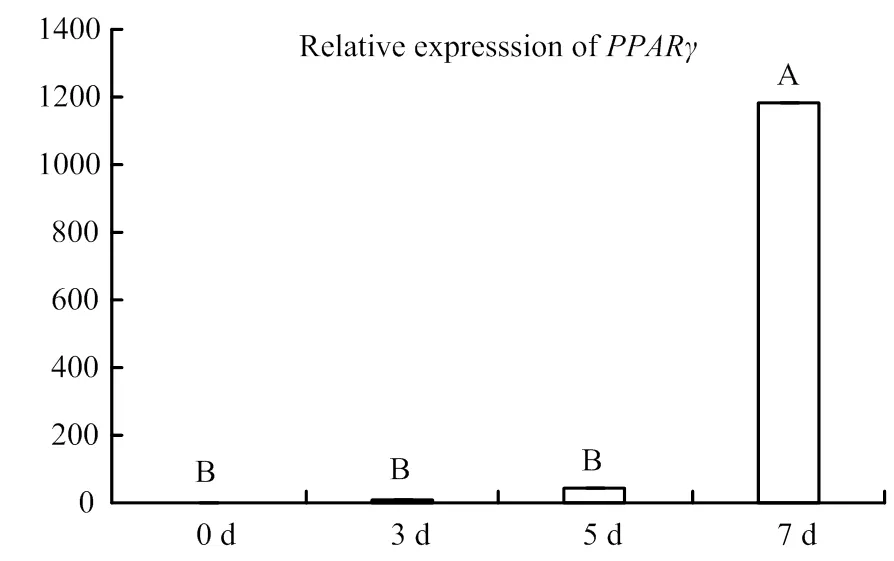
RT-qPCR結果顯示,PPARγ基因隨著誘導分化的進行其表達水平持續上升,其中在第7天時其表達水平極顯著高于其他各組(<0.01)(圖2)。家族11個成員在山羊前體脂肪細胞分化過程中均被檢測到,其表達模式可大概分為兩種,一種是在脂肪細胞中的表達水平顯著或極顯著高于前體脂肪細胞中表達水平(、、、、和);另外一種是在前體脂肪細胞中的表達水平極顯著高于脂肪細胞中的表達水平(、、、和)(圖3、4)。
其中在第一種表達模式中和的表達趨勢相似,均是隨著分化的進行其表達水平逐漸升高,且第7天表達水平最高,極顯著高于在前體脂肪細胞中的表達水平(<0.01);和表達趨勢相似,均是誘導分化第5天的表達水平顯著高于在前體脂肪細胞中的表達水平(<0.05);同時結果顯示,在誘導分化第3天的表達極顯著高于其在前體脂肪細胞中的表達水平(<0.01),在誘導分化的第3天和第5天的表達水平極顯著高于其在前體脂肪細胞中的表達水平(<0.01)。
另外一種表達模式比較單一,均是在前體脂肪細胞中的表達水平極顯著高于誘導分化后各個時間段的表達水平(<0.01)。
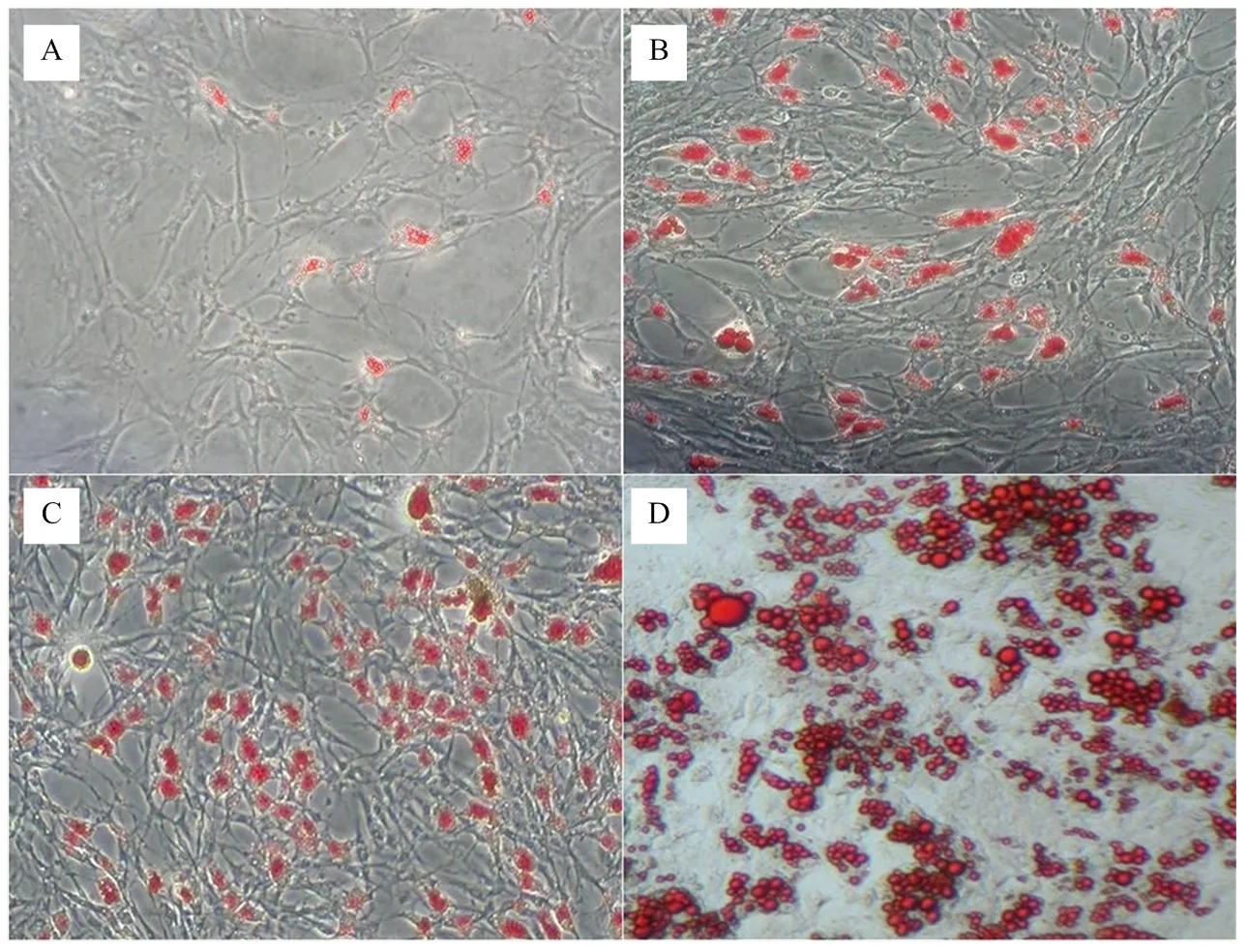
A. 誘導培養第24小時;B. 誘導培養48 h;C. 誘導培養72 h;D. 誘導培養120 h
不同大寫字母表示P<0.01,不同小寫字母表示P<0.05。下同
2.3 轉錄因子KLF家族各成員間表達相關性分析
本試驗分析了家族各成員在山羊前體脂肪細胞分化過程中基因表達水平之間的相關性,結果顯示家族這11個成員的mRNA表達水平均存在正相關或負相關,且與之間存在極顯著正相關(<0.01),與存在顯著負相關(<0.05);與、、、和之間存在極顯著的負相關(<0.01);和、存在顯著的正相關(<0.05),與和存在極顯著的正相關(<0.01),與存在顯著的負相關(<0.05);與存在顯著的正相關(<0.05),與存在極顯著的負相關(<0.01);與、、存在顯著或極顯著的正相關(<0.05或<0.01),與和存在極顯著的負相關(<0.01)。相關性網絡分析發現,與6個基因具有較強的相關性,其次為和,分別與5個成員具有較強的相關性,而與其他基因均沒有較強的相關性(表2,圖5)。
3 討論
3.1 山羊前體脂肪細胞體外培養體系的優化
建立動物前體脂肪細胞體外培養模型是闡明動物脂肪沉積分子機理的重要手段,本實驗室前期試驗發現體外培養的簡州大耳羊前體脂肪細胞傳至第3代后,其自發分化能力則顯著下降。因此確定適合山羊前體脂肪細胞的有效誘導劑對闡明脂肪細胞分化機制具有非常重要的理論與實際意義。綜合目前國內外不同動物前體脂肪細胞誘導分化的方法,發現不同動物(如豬、牛、雞、草魚和綿羊等)所用的誘導劑存在差別[21-24]。本試驗發現“油酸+胰島素”可有效誘導簡州大耳羊前體脂肪細胞分化,且在誘導分化的第5天分化率達到90%以上。這與曲貞曉和杜琛等[25-26]在嶗山奶山羊和內蒙古絨山羊所用的方法相比縮短了前體脂肪細胞完全分化的時間,為進一步研究山羊脂肪細胞分化、脂代謝的分子機制提供更好的模型。CHEGURU等[27]也指出油酸+胰島素可有效促進3T3- L1前體脂肪細胞中脂滴的積聚并伴隨著、aP2轉錄因子()和硬脂酰輔酶A去飽和酶1()基因表達的升高。SHANG等[21]指出160 μmol·L-1油酸可誘導雞前體脂肪細胞分化,DING等[28]指出50—300 μmol·L-1油酸可通過促進aP2基因的表達(但、轉錄因子CCAAT/增強子結合蛋白α()和脂蛋白脂酶()基因表達未發生變化)進而促進豬前體脂肪細胞分化。本研究發現不同濃度的油酸(0、50、100、150、300 μmol·L-1)對山羊前體脂肪細胞的成脂誘導效果并不相同,使用150 μmol·L-1具有最好的成脂誘導效果。此外,ADINA等[29]發現使用10 mg·L-1的胰島素具有較好的誘導成脂分化的效果。因此本研究在前期試驗和前人研究結果的基礎上,選擇150 μmol·L-1油酸+10 mg·L-1胰島素處理山羊前體脂肪細胞,結果顯示成脂誘導效果良好。綜上所述,不同動物前體脂肪細胞具有最適合的獨特誘導劑,即使同一誘導劑其最佳濃度也可能存在差異。

不同大寫字母表示P<0.01,不同小寫字母表示P<0.05

不同大寫字母表示<0.01,不同小寫字母表示<0.05
Different capital letters represents<0.01, different lower-case letters represents<0.05
圖4 山羊脂肪細胞分化過程中、、、和的表達情況
Fig. 4 The expression of,,,andduring preadipocyte differentiation

表2 KLF家族各成員間表達水平的相關性
*表示差異顯著(<0.05),**表示差異極顯著(<0.01);#表示進行相關分析的誘導分化時間為0—5 d,其余的為0—7 d
*represents<0.05, ** represents<0.01, #represents the analyses based on 0-5 days after cell differentiation inducing, the rest data based on 0-7 days after cell differentiation inducing

圖5 山羊KLF家族基因相互關系網絡圖
3.2 KLFs在山羊前體脂肪細胞分化過程中的表達模式
基于轉錄因子在前體脂肪細胞分化中所占的重要地位,檢測轉錄因子在山羊前體脂肪細胞中的表達模式是闡明山羊前體脂肪細胞分化分子機理的基礎。本研究檢測了脂肪細胞分化標志基因、脂肪細胞確定分化依賴因子1()和在山羊成脂分化過程中的表達譜。結果發現和(數據未顯示)的表達水平隨著分化的進行而持續增高,從而進一步證明了本文所選誘導劑的可行性。家族成員在山羊成脂分化過程中的表達模式可大概分為兩類,一類是分化的脂肪細胞中表達水平顯著或極顯著高于前體脂肪細胞中表達水平(、、、、和),推測這些成員可能在山羊前體脂肪細胞分化中發揮正調控作用;另一類是前體脂肪細胞中的表達水平極顯著高于分化的脂肪細胞中的表達水平(、、、和),推測這些成員可能在山羊前體脂肪細胞分化中發揮負調控作用。這些結果與其他學者在人、小鼠和雞上的研究結果存在著一些相似及不同之處,下面分別就相似及不同之處進行對比分析。
3.2.1、、、、和表達模式分析 本研究發現在誘導分化第7天的山羊脂肪細胞中表達極顯著高于其在前體脂肪細胞中的表達水平,這與其他學者提出的在人和小鼠的前體脂肪細胞中存在高水平表達的結果不同[30-31]。SUE等[32]指出隨3T3-L1前體脂肪分化,表達水平呈下降趨勢,且可能依賴于C-末端結合蛋白()蛋白來抑制在3T3-L1前體脂肪細胞分化。但本文卻發現其在誘導分化第5天的山羊脂肪細胞中的表達顯著高于在前體脂肪細胞中的表達。隨山羊前體脂肪細胞分化的進行其表達水平逐漸升高,這與Birsoy等[7]在3T3-L1中的報道相似,但與EISENSTEIN等[33]在小鼠中的報道不同。在誘導分化第3天的山羊脂肪細胞中表達極顯著高于其在前體脂肪細胞中的表達水平,這與其在雞前體脂肪細胞中高表達的報道不同[34]。和在山羊前體脂肪細胞成脂分化過程中的表達模式與它們在3T3-L1前體脂肪細胞分化中的表達模式相似,并且研究指出可能通過抑制前脂肪細胞因子1(PREF1)來促進3T3-L1前體脂肪細胞分化[35]。在雞前體脂肪細胞分化中表達量顯著增加,但在不同發育階段皮下脂肪組織中表達水平卻無變化[36],推測其可能在動物組織與細胞中存在不同的調控途徑。此外,研究發現除了自身可調控脂肪細胞分化外,還可作為關鍵的轉錄因子介導其他調控因子對脂肪細胞分化的調控[3,37],進一步證明了該基因的重要作用。
3.2.2、、、和表達模式分析、、、和在山羊前體脂肪細胞中的表達水平均極顯著高于在誘導分化細胞中的表達水平。OISHI 等[38]指出在3T3-L1前體脂肪細胞被誘導1 h后就檢測到表達,誘導3 h檢測到表達峰值,且可協同C/EBPβ和C/EBPδ激活PPARγ來促進3T3-L1脂肪細胞分化。本研究結果與之不同的原因可能是檢測的誘導分化時間點跨度較大,推測可能在前體脂肪細胞誘導早期發揮作用[39]。和在山羊和3T3-L1前體脂肪細胞分化中的表達模式不同。Lee等[40]指出在3T3-L1前體脂肪細胞誘導36 h后檢測到表達,并且熒光素酶報告實驗證明超表達可促進和啟動子的活性,提示可能通過促進和的表達來促進脂肪細胞分化。Pei等[41]指出可能是調控3T3-L1前體脂肪細胞中期分化階段的重要轉錄因子,且這種調控作用主要通過影響和的表達水平來進行的。目前尚未見和在脂肪細胞分化、脂代謝和脂肪沉積中的相關報道。
3.3 KLF家族各成員在山羊前體脂肪細胞分化過程中相關性
研究表明,KLFs家族有些成員的表達可以調控同一家族其他成員的表達,即等級調控,在功能上體現為協同或者拮抗作用[19-20]。但目前關于KLFs各個成員之間的網絡調控關系報道在脂肪細胞分化中研究較少,無法精確構建其調控網絡。因此本研究系統分析了家族11個成員在山羊前體脂肪細胞分化過程中的相關性,結果指出這11個成員均存在正相關或負相關即可能發揮協同或者拮抗作用,并且與、和這三個成員存在顯著相關的成員較多,推測它們可能在網絡級聯中處于重要位置。與在紅細胞生成中具有相互調控作用[19,42]。Eaton等[21]在小鼠胎兒肝臟細胞系中研究表明可以激活和的表達,而則可以抑制介導的的活化,三者之間形成了交互調控的網絡。FUNNELL等[43]發現和在胚胎發育過程中具有重疊作用。本研究也發現與在山羊前體脂肪細胞分化過程中也存在顯著相關,推測在這個過程中可能具有相互調控作用。本文還發現、和處于相關性網絡的中心位置,分別與6個、5個、5個基因具有較強的相關性,推測這些基因可能在山羊前體脂肪細胞分化過程中具有重要作用。
4 結論
油酸+胰島素可有效誘導山羊前體脂肪細胞分化;、、、、和在分化的脂肪細胞中表達水平顯著或極顯著高于前體脂肪細胞中表達水平;、、、和在前體脂肪細胞中的表達水平顯著或極顯著高于分化的脂肪細胞中的表達水平。、和在山羊前體脂肪細胞分化調控過程中可能具有重要的調控作用。這些結果為進一步闡明轉錄因子家族在山羊前體脂肪細胞分化中的調控作用提供重要的數據支撐。
[1] STEPHENS J M. The fat controller: adipocyte development., 2012, 10(11): e1001436.
[2] KACZYNSKI J, COOK T, URRUTIA R. Sp1 and Kruppel-like transcription factors., 2003, 4(2): 206.
[3] LEE D S, CHOI H, HAN B S, Kim W K, Lee S C, Oh K J, Bae K H. c-Jun regulates adipocyte differentiation via the KLF15-mediated mode., 2016, 469(3): 552-558.
[4] WU Z N, WANG S Q. Role of kruppel-like transcription factors in adipogenesis., 2013, 373(2): 235-243.
[5] PEI J, GRISHIN N V. A new family of predicted Krüppel-like factor genes and pseudogenes in placental mammals., 2013, 8(11): e81109.
[6] WEI S J, ZHANG L F, ZHOU X, DU M, JIANG Z H, HAUSMAN G J, BERGEN W G, ZAN L S, DODSON M V. Emerging roles of zinc finger proteins in regulating adipogenesis., 2013, 70(23): 4569-4584.
[7] BIRSOY K, CHEN Z, FRIEDMAN J. Transcriptional regulation of adipogenesis by KLF4., 2008, 7(4): 339-347.
[8] PARK Y K, WANG L M, GIAMPIETRO A, LAI B B, LEE J E, GE K. Distinct roles of transcription factors KLF4, Krox20 and PPARγ in adipogenesis., 2017, 37(2): e00554-16.
[9] JIANG S Z, WEI H K, SONG T X, YANG Y, ZHAGN F, ZHOU Y F, PENG J, JIANG S W. KLF13 promotes porcine adipocyte differentiation through PPARγ activation., 2015, 5: 28.
[10] GUO H F, KHAN R, RAZA S H A, NING Y, WEI, D W, HOSSEINI S M, ULLA I, GARCIA M D, ZAN L S. KLF15 promotes transcription of KLF3 gene in bovine adipocytes., 2018, 659(15): 77-83.
[11] 池永東, 王永, 朱江江, 林森, 趙越, 林亞秋. 藏山羊KLF8基因克隆及組織表達分析. 基因組學與應用生物學, 2019, 38(2): 478-502.
CHI Y D, WANG Y, ZHU J J, LIN S, ZHAO Y, LIN Y Q. Cloning and tissue expression analysis of klf8 gene in Tibetan goat., 2019, 38(2): 478-502. (in Chinese)
[12] 田苗, 左璐璐, 張小玉, 柏雪, 江明鋒, 林亞秋. 牦牛基因克隆及組織表達分析. 黑龍江畜牧獸醫, 2017, 17(09/1): 234-236.
TIAN M, ZUO L L, ZHANG X Y, BAI X, JIANG M F, LIN Y Q. Cloning and tissue expression analysis ofgene in Yak., 2017, 17(09/1): 234-236. (in Chinese)
[13] 朱江江, 林亞秋, 王永, 李倩, 林森, 熊朝瑞, 俄木曲者. 山羊KLF13 基因的克隆及表達分析. 農業生物技術學報. 2017, 25(1): 102-109.
ZHU J J, LIN Y Q, WANG Y, LI Q, LIN S, XIONG C R, EMU Q Z. Cloning and expression analysis of goat ()gene., 2017, 25(1): 102-109. (in Chinese)
[14] NEVE B, FERNANDEZ-ZAPICO M E, ASHKENAZI-KATALAN V, DINA C, HAMID Y H, JOLY E, VAILLANT E, BENMEZROUA Y, DURAND E, BAKAHER N, DELANNOY V, VAXILLAIRE M, COOK T, DALLINGA-THIE G M, JANSEN H, CHARLES M A, CLEMENT K, GALAN P, HERCBERG S, HELBECQUE N, CHARPENTIER G, PRENTKI M, HANSEN T, PEDERSEN O, URRUTIA R, MELLOUL D, FROGUEL P. Role of transcription factor KLF11 and its diabetes-associated gene variants in pancreatic beta cell function.2005, 102(13): 4807-4812.
[15] Wu G, YUAN S, CHEN Z, CHEN G, FAN Q, DONG H, YE F, LI J, ZHU X. The KLF14 transcription factor regulates glycolysis by downregulating LDHB in colorectal cancer., 2019, 15(3): 628-635.
[16] WANG J, GALVAO J, BEACH K M, LUO W, URRUTIA R A, GOLDBERG J L, OTTESON D C. Novel roles and mechanism for Kruppel-like Factor 16 (KLF16) regulation of neurite outgrowth and ephrin receptor A5 (EphA5) expression in retinal ganglion cells., 2016, 291(35): 18084-18095.
[17] ALI A, ZHANG P, LIANGFANG Y, WENSHE S, WANG H, LIN X, DAI Y, FENG X H, MOSES R, WANG D, LI X, XIAO J. KLF17 empowers TGF-β/Smad signaling by targeting Smad3-dependent pathway to suppress tumor growth and metastasis during cancer progression., 2015, 6(3): e1681.
[18] PEARSON R, FLEETWOOD J, EATON S, CROSSLEY M, BAO S. Krüppel-like transcription factors: a functional family., 2008, 40(10): 1996-2001.
[19] FUNNELL A P W, MALONEY C A, THOMPSON L J, KEYS J, TALLACK M, PERKINS A C, CROSSLEY M. Erythroid Kruppel- like factor directly activates the basic Kruppel-like factor gene in erythroid cells., 2007, 27(7): 2777-2790.
[20] EATON S A, FUNNELL A P W, SUE N, NICHOLAS H, RICHARD C M, CROSSLEY M. A network of Krüppel-like factors (Klfs)., 2008, 283(40): 26937-26947.
[21] 郭紅芳, 昝林森, 孫永剛. 牛前體脂肪細胞的分離培養及誘導分化. 西北農林科技大學學報(自然科學版), 2012, 42(2): 1-6.
GUO H F, ZAN L S, SUN Y G. Primary culture and differentiation of bovine preadipocytes., 2012, 42(2): 1-6. (in Chinese)
[22] SHANG Z C, GUO L, WANG N, SHI H, WANG Y X, LI H. Oleate promotes differentiation of chicken primary preadipocytes., 2014, 34(1): e00093.
[23] 吉紅, 曹艷姿, 林亞秋, 劉品, 盧榮華, 蘇尚順, 楊公社, 奧宏海. 草魚前體脂肪細胞的原代培養. 水生生物學報, 2009, 33(6): 1226-1230.
JI H, CAO Y Z, LIN Y Q, LIU P, LU R H, SU S S, YANG G S, AO H H. Primary culture of grass carp preadipocyte in vitro., 2009, 33(6): 1226-1230. (in Chinese)
[24] 蔡勇, 阿依木古麗, 楊具田, 馬忠仁, 盧建雄, 臧榮鑫, 吳建平. 綿羊前體脂肪細胞的原代培養及分化. 動物營養學報, 2010, 22(6): 1768-1774.
CAI Y, AYIMUGULI, YANG J T, MA Z R, LU J X, ZANG R X, WU J P. Primary culture and differentiation of Ovine preadipocytes., 2010, 22(6): 1768-1774. (in Chinese)
[25] 曲貞曉, 劉金鳳, 姜穎, 潘慶杰. 山羊前體脂肪細胞體外培養試驗. 青島農業大學學報(自然科學版), 2013, 30(1): 1-5.
QU Z X, LIU J F, JIANG Y, PAN Q J. The culture experiment of goats preadipocytes in vitro., 2013, 30(1): 1-5. (in Chinese)
[26] 杜琛, 付紹印, 韓志玲, 孟麗云, 愛倫高娃, 高麗霞, 成立新, 張文廣, 李金泉. 絨山羊肌內前體脂肪細胞的基因表達分析. 畜牧獸醫學報, 2013, 44(10): 1532-1538.
DU C, FU S Y, HAN Z L, MENG L Y, AILUN G W, GAO L X, CHENG L X, ZHANG W G, LI J Q. Gene expression analysis on intramuscular preadipocytes in the cashmere goats., 2013, 44(10): 1532-1538. (in Chinese)
[27] CHEGURU P, CHAPALAMADUGU K C, DOUMIT M E, MURDOCH G K, HILL R A. Adipocyte differentiation-specific gene transcriptional response to C18 unsaturated fatty acids plus insulin., 2012, 463(3): 429-447.
[28] DING S T, WANG J C, MERSMANN H J. Effect of unsaturated fatty acids on porcine adipocyte differentiation., 2003, 23(8): 1059-1069.
[29] ADINA K S, ROBERT Y H, M. DANIEL L. Induction of fatty acid synthetase synthesis in differentiai 3T3-Ll preadipocytes., 1980, 255(25): 4745-4750.
[30] BANERJEE S S, FEINBERG M W, WATANABE M, GRAY S, HASPEL R L, DENKINGER D J, KAWAHARA R, HAUNER H, JAIN M K. The Kruppel-like factor KLF2 inhibits peroxisome proliferator-activated receptor-gamma expression and adipogenesis., 2003, 278(4): 2581-2584 .
[31] LEE H, KANG R, KIM Y S, CHUANG S I, YOON Y. Platycodin D inhibits adipogenesis of3T3-L 1 cells by modulating kruppel-like factor 2 and peroxisome proliferator-activated receptor γ., 2010, 24(S2): S161-S167.
[32] SUE N,JACK B H A,EATON S A,PEARSON R C M, FUNNELL A P W, TURNER J, CZOLIJ R, DENYER G, BAO S S, MOLERO-NAVAJAS J C, PERKINS A, FUJIWARA Y, ORKIN S H, BELL-ANDERSON K, CROSSLEY M. Targeted disruption ofthe basic Kriippel-like factor gene (Klf3) reveals a role in adipogenesis., 2008, 28(12): 3967-3978.
[33] EISENSTEIN A, CARROLL S H, JOHNSTON-COX H, FARB M, GOKCE N, RAVID K. An adenosine receptor-Krüppel-like factor 4 protein axis inhibits adipogenesis., 2014, 289(30): 21071-21081.
[34] ZHANG Z W, WANG H X, SUN Y N, LI H, WANG N. Klf7 modulates the differentiation and proliferation of chicken preadipocyte., 2013, 45(4): 280-288.
[35] LI D, YEA S, LI S, CHEN Z, NORLA G, BANCK M, LABORDA J, TAN S, FRIEDMAN J M, FRIEDMAN S L, WALSH M J. Kruppel- like factor-6 promotes preadipocyte differentiation through histone deacetylase 3-dependent repression of DLK1., 2005, 280(29): 26941-26952.
[36] MATSUBARA Y, AOKI M, ENDO T, SATO K. Characterization of the expression profiles of adipogenesis-related factors, ZNF423, KLFs and FGF10, during preadipocyte differentiation and abdominal adipose tissue development in chickens., 2013, 165(3): 189-195.
[37] AHMED M, GAFFEN S L. IL-17 inhibits adipogenesis in part via C/EBPα, PPARγ and Krüppel-like factors., 2013, 61(3): 898-905.
[38] OISHI Y, MANABE I, TOBE K, SHINDO T, FUJIU K, NISHIMURA G, MAEMURA K, YAMAUCHI T, KUBOTA N, SUZUKI R, KITAMURA T, AKIRA S, KADOWAKI T, NAGAI R. Kruppel-like transcription factor KLF5 is a key regulator of adipocyte differentiation., 2005, 1(1): 27-39.
[39] CERVANTES-CAMACHO C, BELTRáN-LANGARICA A, OCHOA- URIBE A K, Marsch-Moreno M, Ayala-Sumuano JT, Velez- delValle C, Kuri-Harcuch W. The transient expression of Klf4 and Klf5 during adipogenesis depends on GSK3β activity., 2015, 4(4): 248-255.
[40] LEE H, KIM H J, LEE Y J, LEE M Y, CHOI H, LEE H, KIM J W. Krüppel-like factor KLF8 plays a critical role in adipocyte differentiation., 2012, 7(12): e52474.
[41] PEI H, YAO Y, YANG Y, LIAO K, WU J R. Krüppel-like factor KLF9 regulates PPARγ transactivation at the middle stage of adipogenesis., 2011, 18(2): 315-327.
[42] ILSLEY M D, GILLINDER K R, MAGOR G W, Huang S, Bailey T L, Crossley M, Perkins A C . Krüppel-like factors compete for promoters and enhancers to fine-tune transcription., 2017, 45(11): 6572-6588.
[43] FUNNELL A P, MAK K S, TWINE N A, PELKA G J, NORTON L J, RADZIEWIC T, POWER M, WIKINS M R, BELL-ANDERSON K S, FRASER S T, PERKINS A C, TAM P P, PEARSON R C M, CROSSLEY M. Generation of mice deficient in both KLF3/BKLF and KLF8 reveals a genetic interaction and a role for these factors in embryonic globin gene silencing., 2013, 33(15): 2976-2987.
Expression Profile and Correlations of Kruppel Like Factors During Caprine () Preadipocyte Differentiation
ZHU JiangJiang1, LIN YaQiu1, WANG Yong1,2, LIN Sen2
(1Qinghai-Tibetan Plateau Animal Genetic Resource Reservation and Utilization Key Laboratory of Sichuan Province, Chengdu 610041;2Key Laboratory of Qinghai-Tibetan Plateau Animal Genetic Resource Reservation and Utilization (Southwest Minzu University), Ministry of Education, Chengdu 610041)
【】The aim of this study was to optimize the culture system of goat preadipocytes in vitro and elucidate the expression patterns of Kruppel like factors (KLFs) during preadipocytes differentiation.】Three 7-day-old Jianzhou Big-Eared goats were selected randomly from Sichuan Jianyang DAGEDA Animal Husbandry Co. Ltd. as experimental animal. After bloodletting death of goats, their subcutaneous fat tissues were collected in a sterile room. The goat subcutaneous preadipocytes were collected using collagenase I digestion method. The cells at Generation Three were then passaged to a 6-well plate when the cells were grown to 80% density. The combined use of were used for preadipocytes differentiate inducing. The cells were then collected after cultivation for 0 d, 3 d, 5 d and 7 d. The total RNA was extracted by using Trizol method. Real-time fluorescent quantitative PCR (RT-qPCR) was performed to determine the expression levels of 11 members of KLFs, including KLF2-10, KLF12 and KLF15, during goat preadipocytes differentiation. Pearson correlation coefficient was used for expression correlation analysis between KLF individuals.【】The results showed that the combined use of 150 μmol·L-1oleic acid and 10 mg·L-1insulin promoted the formation of small lipid droplets after 24 h cultivation. After 48 h, the lipid droplets became bigger and much more. The differentiation of the preadipocytes were enhanced significantly after 120 h comparing with preadipocytes at 0 h. The results of RT-qPCR showed that the combined use of oleic acid and insulin stimulated the expression of peroxisome proliferator-activated receptor-gamma () continuously companying the differentiation of preadipocytes, and toped at 7 d which significantly higher than other groups (<0.01). The expression levels of,,,,and<0.05) or extremely significantly (<0.01) higher than those in preadipocytes. While the expression of,andwere topped at 5 d, theandtoped at 7 d. However, theexpressed most at 3 d. For the other KLF individuals, the expression levels of,,,andextremely significantly higher (<0.01) than those in adipocytes. The expression of,andbottomed at 5 d, while that of theandbottomed at 7 d. Correlation analysis showed that KLF individual significantly (<0.05) correlated with each other across cell differentiation.was strongly correlated with 6 individuals, followed byandboth of which were significantly correlated with 5 individuals. However,was not significantly correlated with other individuals. 【】In this study, the expression patterns of KLFs during goat preadipocytes differentiation were clarified, and also the correlations among KLF individuals. These results provided important basic data for elucidating the molecular mechanism of goat preadipocytes differentiation.
goat; preadipocytes; differentiation; Kruppel like factors
10.3864/j.issn.0578-1752.2019.13.012
2018-01-24;
2019-05-10
國家重點研發計劃(2018YFD0502002)、國家自然科學基金(31672395)、四川省“十三五”畜禽育種攻關項目(2016NYZ0045)、中央高校基本科研業務費專項基金(2017NGJPY06)、青藏高原生態畜牧業協同創新中心開放基金(QZGYXT01)
朱江江,E-mail:zhujiang4656@hotmail.com。
林亞秋,E-mail:linyq1999@163.com
(責任編輯 林鑒非)

