核磁熒光雙模態不同分子探針判斷非小細胞肺癌病情與預測預后的價值
周 婕 蔡曙波 徐 陽
肺癌是當前已知癌癥中發病率和死亡率最高的疾病,其中90%以上為非小細胞肺癌(non-small cell lung cancer,NSCLC)[1]。NSCLC早期診斷是降低胃癌病死率的重要手段之一,不過當前常規影像學方法對NSCLC的良惡性判定與預測預后存在局限性,病理檢查對患者的創傷比較大,使其臨床應用受到限制[2-3]。分子影像是新興的成像模式,具有高分辨率、可動態監測、高靈敏度等優點,特別是為通過熒光探針檢測、鑒別局部病變提供了更好的平臺支持[4-5]。氫質子磁共振波譜(proton magnetic resonance spectroscopy,1H-MRS)是1種非侵入性核磁熒光雙模態不同分子探針檢查技術,也是1種可以進行定性分析和定量分析的方法[6-7]。由于NSCLC與正常肺組織具有不同的代謝特征,故當前1H-MRS在臨床上應用于NSCLC可提供更準確、更多的信息,從而有利于定性診斷NSCLC[8]。本文具體探討了核磁熒光雙模態不同分子探針判斷NSCLC病情與預測預后的價值。現總結報告如下。
1 資料與方法
1.1 研究對象
研究時間為2015年5月到2017年11月,采用回顧性、總結研究方法,選擇在我院進行診治的NSCLC患者64例作為研究對象,納入標準:首次發病與診治患者;病理診斷為NSCLC;醫院倫理委員會批準了此次研究;臨床、影像學與病理資料完整;患者在自愿條件下簽署了知情同意書;年齡40~70歲,均無腦血管意外、顱腦外傷、顱內感染或手術病史。排除標準:手術病史、放化療史或使用皮質類固醇激素類藥物史患者;妊娠與哺乳期婦女;影像學或臨床資料不完整者。
其中男性36例,女性28例;年齡43~68歲,平均年齡(56.33±4.18)歲;病程最短者2.5 h,最長者10年,平均(3.19±1.84)年;病情分級:Ⅰ級32例,Ⅱ級20例,Ⅲ級12例;平均體重指數(21.14±3.19)kg/m2;吸煙24例,肺癌家族史者19例;平均受教育年限(12.44±2.19)年。
1.2 1H-MRS檢查方法
1.2.1 檢查設備 飛利浦 Multiva 1.5T磁共振機(標準頭顱正交線圈或8通道頭頸部專用相陣控線圈),德國徠卡公司的熒光顯微手術及顯像系統,美國GE公司的InstaTrak Plus 3500神經導航系統。5-ALA藥物由我院保存。
1.2.2 檢查過程 使用自旋回波(SE)序列獲得T1加權像(T1WI);采用快速自旋回波(FSE)序列獲得T2加權像(T2WI)。掃描參數:帶寬62.5KHz,層厚6.5 mm,層間距1.3 mm,T1WI(TR/TE,600/16 ms),T2WI(TR/TE,5100/118 ms),T1WI-Flair(TR/TE,2960/7.9 ms。MR增強掃描圖像在T1加權像基礎上獲得(對比劑為釓噴酸葡胺,注射劑量0.1 mg/kg,注射速度2 ml/s,掃描參數TR/TE 2962/7.9 ms,層厚6.5 mm,層間距1.3 mm,帶寬62.5 KHz)。
1H-MRS掃描:以腫瘤病灶最大層面的軸位T2WI作為波譜定位像,掃描感興趣區(region of interest,ROI)分別位于腫瘤實質區、對側正常區,采用點分辨波譜分析法采集信號。掃描參數:帶寬62.5 KHz,層厚6.5 mm,FOV 24×24 cm,層間隔1.3 mm,TR/TE:1500/144 ms,激勵數1.0。完成掃描后將數據傳送到ADW4.2工作站進行后處理,得到波譜圖,觀察并分析不同興趣區各化學組分的峰值和比值,包括N-乙酰天門冬氨酸(n-acetylaspartate,Nhh)峰、膽堿(choline,Cho)峰,以NAA/Cho、Cho/Cr等比值來比較并記錄。
1.3 病理學診斷
手術治療后切除的組織標本立即固定于福爾馬林溶液中,在病理科進行脫水、透明、浸蠟、包埋、切片、HE染色、封片處理。NSCLC的病理學分級標準:①出現壞死;②局部微血管增生顯著;③核分裂象增多。有①者診斷為Ⅰ級;有①、②兩項者診斷為Ⅱ級,有①、②和③三項者診斷為Ⅲ級。
1.4 預后調查
所有患者隨訪至2018年4月,調查患者的死亡與生存情況。
1.5 統計學方法
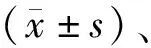
2 結果
2.1 常規MRI特征
在64例患者中,常規MRI表現為不均勻強化,周圍T2上高信號,腫瘤邊界不清,瘤周水腫顯著。
2.2 1H-MRS指標對比
NSCLC的腫瘤實質區典型波譜表現為Cho峰顯著升高,NAA峰顯著降低,Cr峰降低不顯著,NAA/Cr比值降低,Cho/NAA、Cho/Cr比值升高,與對側正常區對比差異有統計學意義(P<0.05),見表1。
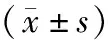
表1 NSCLC不同部位的代謝物比值對比
本研究將Ⅰ級、Ⅱ級列為低級別NSCLC組,Ⅲ級列為高級別NSCLC組,低級別組瘤體區的Cho/NAA、Cho/Cr、NAA/Cr比值與高級別組對比差異也有統計學意義(P<0.05),見表2。
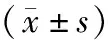
表2 惡性NSCLC的腫瘤實質區不同分級的代謝物比值對比
2.3 預后情況
隨訪至2018年4月,64例患者中死亡12例,死亡率為18.8%。
2.4 影響分析
在64例患者中,以患者的一般資料與1H-MRS指標作為獨立變量,以隨訪預后死亡作為因變量,多因素Logistic回歸分析結果顯示病情分級、Cho/Cr、Cho/NAA為導致患者死亡發生的主要危險因素(P<0.05)。見表3。
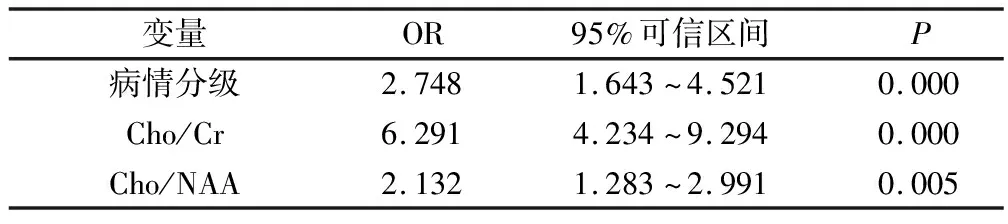
表3 影響非小細胞肺癌預后的獨立危險因素
3 討論
NSCLC是我國最常見的惡性腫瘤之一,發病率為50/10萬左右。早期NSCLC臨床大多沒有特異性的癥狀,為此在診斷時多為晚期,且發病人群呈年輕化趨勢,使得患者的預后一直比較差[9]。手術為早期NSCLC的主要治療方法,治療原則是在保存正常腦組織神經功能的前提下,安全切除腫瘤病灶,以提高患者的生存率[10-11]。然而由于NSCLC的侵襲性生長而腫瘤邊界不清,腫瘤全切存在一定困難,有研究顯示只有在不到30%的患者影像學上呈強化的腫瘤組織能得到全切。因為在術前精確地定位NSCLC的病灶范圍與進行病理分級,對提高手術切除率具有重要的意義[12]。
當前診斷NSCLC的影像學方法比較多,不同方法的成像空間分辨率和深度、成像靈敏度均存在差異[13]。分子成像技術在在分子生物學研究的基礎上,通過化學手段與造影材料的協同作用,可以實現感興趣分子的在體腫瘤示蹤,具有檢測靈敏度高、特異性強、可連續動態觀察、無創等優點[14]。而已在臨床廣泛應用的核磁共振成像具有優良的空間分辨率,可從宏觀觀測探針的分布聚集情況,將核磁與分子成像技術結合的核磁熒光雙模態,可以同時從宏觀和微觀上進行疾病的判定。MRS可顯示局部的代謝產物,從而有利于進行疾病的定性診斷與分級診斷[15]。特別是1H-MRS也可用來檢測體內多種微量代謝物,如Cr、NAA、Cho等,能夠無創性檢測腫瘤組織及正常腦組織上述代謝物的變化,通過計算各種代謝物的比值,從而判斷NSCLC的惡性程度進行分析[16]。本研究NSCLC的腫瘤實質區典型波譜表現為Cho峰顯著升高,NAA峰顯著降低,Cr峰降低不顯著,NAA/Cr比值降低,Cho/NAA、Cho/Cr比值升高,與對側正常區對比差異有統計學意義(P<0.05)。NAA是目前公認的神經元內標志物,NSCLC波譜特點為NAA峰顯著下降。從機制上分析,NSCLC的病灶組織遭受到破壞,使得腫瘤細胞膜的轉換增強與Cho密度增加,且會影響正常的能量代謝通路,導致Cr的強度減少與NAA峰的顯著降低[17]。
核磁熒光雙模態成像技術可在同一儀器上實現多種成像方式的檢查,其中開發與核磁熒光雙模態成像系統相匹配的活體成像探針已成為醫學影像技術的發展前沿。1H-MRS作為一種非侵入性的新技術,從而為臨床提供更全面、準確的術前腫瘤病理分級等方面的信息[18]。本研究顯示低級別組瘤體區的Cho/NAA、Cho/Cr、NAA/Cr比值與高級別組對比差異也有統計學意義(P<0.05)。從機制上分析,由于組織壞死的產生,使得Cho在高度惡性的NSCLC呈現下降趨勢[19]。同時在高級別NSCLC的壞死區,Cho/Cr、NAA/Cr比值的變化可反映腫瘤組織的正常有氧呼吸發生障礙,同時發生缺血缺氧,進而導致線粒體損傷,細胞出現凋亡與壞死等[20]。
在核磁熒光雙模態成像中,探針制備與選擇是分子影像中的重要環節和先決條件,制備性質優良的NSCLC特異性分子影像探針是開展后續診斷研究的基礎和關鍵[21]。1H-MRS可較全面反映瘤體區及對側相應正常部位的代謝情況,從而有利于指導術中切除[22]。本研究顯示多因素Logistic回歸分析結果顯示病情分級、Cho/Cr、Cho/NAA為導致患者死亡發生的主要危險因素(P<0.05),表明核磁熒光雙模態不同分子預測預后也有很好的價值,也可逐漸成為臨床研究中不可或缺的先進診斷手段。研究也存在一定的不足,比如納入本研究中的病例數相對較少,患者的配合程度也可能導致實驗數據不準確,將在下一步研究進行深入分析。
總之,核磁熒光雙模態不同分子探針可有效判斷NSCLC患者的病情與預測預后,有很好的臨床應用價值。

