帕瑞昔布鈉不同時間點超前鎮痛對甲狀腺癌根治術的應激激素水平的影響
陳 穎 沈 亮 費 健
應激反應是機體受到各種內外環境刺激時出現的非特異性全身反應,其是機體適應、保護機制的重要組成部分,輕度應激反應可增強機體的適應能力,提高機體的準備狀態,但應激反應若過于持久、強烈,會超過機體的負荷限度,使機體內部環境平衡失調,損害機體,造成嚴重的并發癥[1]。甲狀腺癌根治術是一種創傷較大的手術,患者應激反應強烈,因此選擇一種即可防止術后疼痛,又可抑制圍術期過度應激反應,減少機體不良反應的鎮痛模式非常重要[2]。超前鎮痛是對機體在傷害性刺激前采取措施以防止中樞神經及外周敏感化,其不是特指在術前給予鎮痛,而是在術前、術中及手術結束后采取有效措施減少刺激導致的外周、中樞敏化,減輕機體疼痛[3]。注射用帕瑞昔布鈉是一種選擇性COX-2抑制劑,可用于術后鎮痛[4],已有研究發現帕瑞昔布鈉超前鎮痛對甲狀腺癌根治術的術后鎮痛效果好,而其鎮痛效果為6~12 h[5]。因此本文分析了帕瑞昔布鈉不同時間點超前鎮痛對甲狀腺癌根治術患者應激激素水平的影響,為臨床甲狀腺癌根治術選擇合理的鎮痛方式提供參考。
1 資料與方法
1.1 一般資料
選擇我院2018年3月至2018年8月收治的137例甲狀腺癌根治術患者,所有患者均符合2012年美國
國家癌癥綜合治療聯盟中關于甲狀腺癌的診斷標準[6],病理分期為Ⅲ期或Ⅳ期;排除有合并其他惡性腫瘤者,有嚴重肝、腎功能障礙者,有麻醉藥物過敏史者及慢性疾病史者等。137例中男性71例,女性66例;年齡為46~71歲,平均年齡為(62.9±7.8)歲;病理分期為Ⅲ期74例,Ⅳ期63例;病理類型:乳頭狀癌61例,濾泡狀癌76例。根據隨機數字表法,將所有患者分為A組(70例)及B組(67例),2組患者的一般資料對比,差異無統計學意義,P>0.05,見表1。本研究所有患者知情同意,且經醫院倫理委員會批準同意。
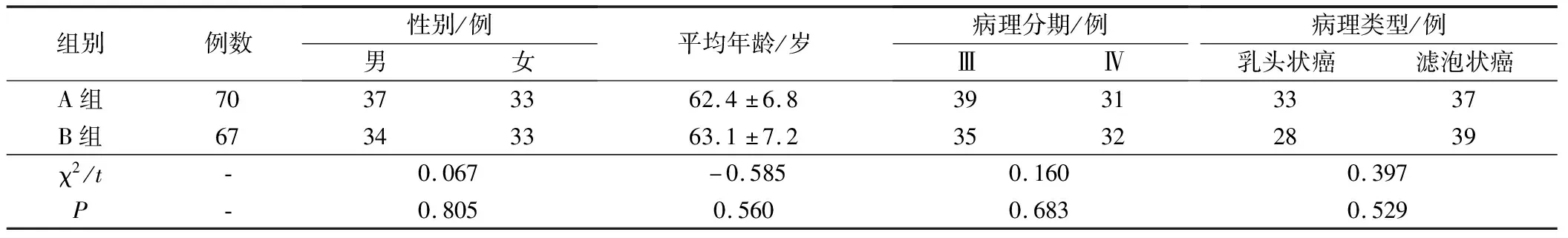
表1 2組患者一般資料對比
1.2 方法
A、B 2組患者均行甲狀腺癌根治術,均在麻醉誘導前30 min注射40 mg帕瑞昔布鈉,并在入室后連接多功能監護儀,對患者的HR、EGC、BP及SpO2進行監測,并建立靜脈通道。麻醉誘導:2組均靜脈注射0.01 mg/kg阿托品,0.05 mg/kg咪達唑侖,0.12~0.14 mg/kg維庫溴銨,0.03 μg/kg的舒芬太尼,1.5~2.0 mg/kg丙泊酚,誘導成功后,行氣管插管;麻醉維持:以1~3 mg/kg·h速度靜脈泵注丙泊酚,以3~5 μg/kg·h的速度靜脈泵注瑞芬太尼,術中根據患者的血壓、心率調節泵注速度,之后吸入1%的七氟烷維持麻醉。在術前1 h,追加0.02 mg/kg維庫溴銨及0.2~0.5 μg舒芬太尼。術前30 min,停止吸入七氟烷,術前5 min,停止麻醉藥物用藥;2組均在術前30 min,靜脈注射5 mg地塞米松,并采用靜脈鎮痛泵自控鎮痛,按壓量為0.5 ml/次,鎖定時間為15 min,背景劑量為2 ml/h。B組在術后12 h再靜脈注射40 mg帕瑞昔布鈉。
1.3 觀察指標
①對比2組患者術前(T0)、術后12 h(T1)、術后24 h(T2)及術后48 h(T3)點的MAP及HR;②在T0、T1、T2、T3點抽取A、B 2組患者的靜脈血樣,采用放射免疫法檢測患者的血漿皮質醇(Cor)及去甲腎上腺素濃度(NE),用血糖儀檢測2組的血糖水平(Glu),對比2組的Cor、NE及Glu;③對比2組T1、T2及T3點的視覺模擬評分(VAS評分),總分為0~10分,分值越高,疼痛越嚴重;④對比2組患者術后不良反應。
1.4 統計學方法
采用SPSS19.0軟件,計數資料用卡方檢驗;計量資料用t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 2組不同時間點的SBP、DBP及HR對比
2組T0點的MAP及HR對比,差異無統計學意義(P>0.05);A組T1、T2、T3點的MAP及HR明顯高于B組及A組T0點,B組T1、T2點的MAP及HR均明顯高于T0點,P<0.05,見表2。
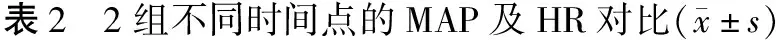
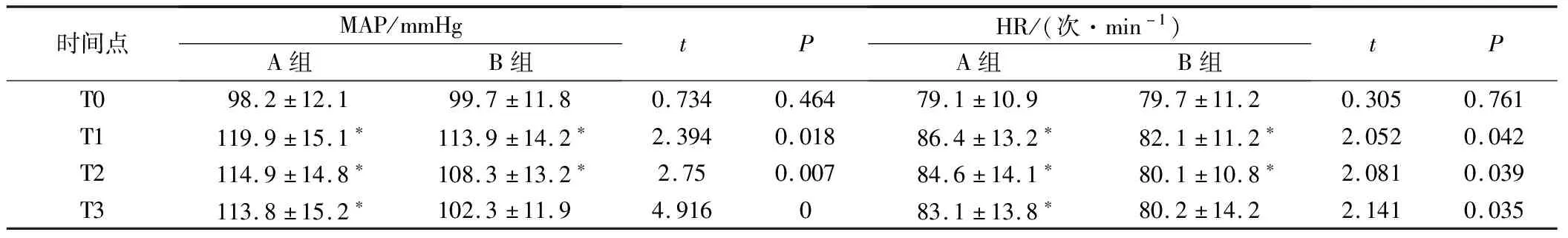
時間點MAP/mmHgA組B組tPHR/(次·min-1)A組B組tPT098.2±12.199.7±11.80.7340.46479.1±10.979.7±11.20.3050.761T1119.9±15.1?113.9±14.2?2.3940.01886.4±13.2?82.1±11.2?2.0520.042T2114.9±14.8?108.3±13.2?2.750.00784.6±14.1?80.1±10.8?2.0810.039T3113.8±15.2?102.3±11.94.916083.1±13.8?80.2±14.22.1410.035
注:*為與T0點對比,P<0.05。
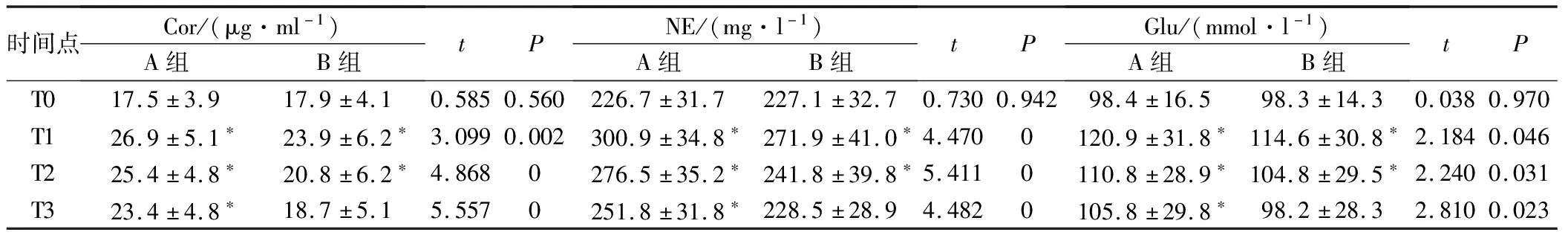
2.2 2組不同時間點的Cor、NE及Glu水平對比
2組T0點的Cor、NE及Glu水平對比,差異無統計學意義(P>0.05);A組T1、T2、T3點的Cor、NE及Glu明顯高于B組及A組T0點,B組T1、T2點的Cor、NE及Glu均明顯高于T0點,P<0.05,見表3。
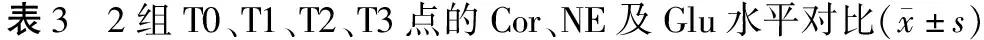
時間點Cor/(μg·ml-1)A組B組tPNE/(mg·l-1)A組B組tPGlu/(mmol·l-1)A組B組tPT017.5±3.917.9±4.10.5850.560226.7±31.7227.1±32.70.7300.94298.4±16.598.3±14.30.0380.970T126.9±5.1?23.9±6.2?3.0990.002300.9±34.8?271.9±41.0?4.4700120.9±31.8?114.6±30.8?2.1840.046T225.4±4.8?20.8±6.2?4.8680276.5±35.2?241.8±39.8?5.4110110.8±28.9?104.8±29.5?2.2400.031T323.4±4.8?18.7±5.15.5570251.8±31.8?228.5±28.94.4820105.8±29.8?98.2±28.32.8100.023
注:*為與T0點對比,P<0.05。
2.3 2組不同時間點的VAS評分對比
B組T1、T2、T3點的VAS評分均明顯低于A組,P<0.05,見表4。
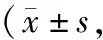
表4 2組T1、T2及T3點VAS評分對比分)
2.4 2組術后不良反應發生率對比
A組術后不良反應發生率為31.4%(23/70),與B組40.3%(27/67)對比,差異無統計學意義,P>0.05,見表5。
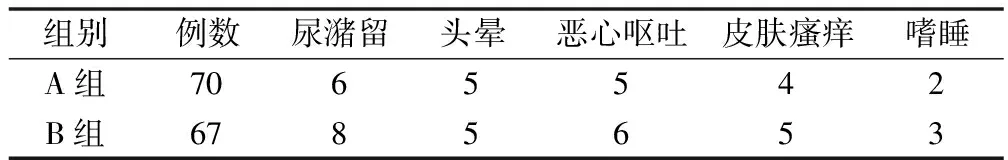
表5 2組術后不良反應發生率對比/例
3 討論
手術部位、類型、手術時間、創傷大小均會對腎上腺皮質激素水平造成直接影響,輕度、短暫的應激反應對機體有良性作用,而強烈、持久的應激反應會使機體處于長期高負荷運轉中,使機體處于過度消耗的狀態,導致器官功能失調,影響機體的中樞神經系統、心血管系統、呼吸系統、內分泌系統、胃腸道及泌尿系統、免疫系[7]。以往傳統的術后模式為硬膜外鎮痛及靜脈鎮痛,硬膜外鎮痛容易增加感染幾率,使患者發生低血壓、出現運動神經阻滯,這種鎮痛模式對盆腔、下腹部手術造成的應激反應效果較好,但對胸部手術、上腹部的應激反應效果較差;而阿片類藥物鎮痛易誘發嘔吐、惡心、皮膚瘙癢、嗜睡、尿潴留、呼吸抑制等不良反應,也會使機體產生依賴性。這兩種模式在甲狀腺癌根治術的臨床術后鎮痛應用中均有一定的限制[8]。而完全消除圍術期應激反應在臨床上是不能實現的,因此選擇適當的麻醉方法、合理用藥可在一定程度上減輕機體不利的應激反應,使患者機體達到最佳的耐受狀態非常重要[9]。帕瑞昔布是COX-2抑制劑,可用于甲狀腺癌根治術的鎮痛,帕瑞昔布鈉不同時間點超前鎮痛少有研究,因此本文分析了帕瑞昔布鈉不同時間點超前鎮痛對甲狀腺癌根治術的鎮痛效果。
本文結果表明,2組T0點的MAP及HR對比,差異無統計學意義(P>0.05),A組T1~T3點的MAP及HR明顯高于B組及A組T0點,B組T1、T2點的MAP及HR均明顯高于T0點;B組T1~T3點的VAS評分均明顯低于A組,表明帕瑞昔布鈉術前術后聯合超前鎮痛對甲狀腺癌根治術患者的血流動力學影響較超前鎮痛小,鎮痛效果優于超前鎮痛。這主要是由于帕瑞昔布鈉在患者機體中吸收較快,7~13 min后會出現止痛作用,23~39 min會出現臨床意義的止痛作用,2 h內達到最大效果,雖鎮痛較為持久,多為6~12 h,但12 h后患者的疼痛仍較為嚴重[10],B組在術后12 h再給患者注射40 mg帕瑞昔布鈉,會持續降低患者的疼痛水平,從而維持患者的血流動力學穩定。
當疼痛刺激機體時,會使下丘腦-腺垂體-腎上腺髓質系統活性增強,內側下丘腦的神經元會將神經信號轉化為激素信號,分泌大量的皮質醇、去甲腎上腺素,使得血液中的皮質醇、去甲腎上腺素濃度迅速升高,同時其會增強糖原異生作用,促使機體血糖水平顯著升高,因此Cor、Glu、NE三者與機體的應激反應程度密切相關[11]。表4結果表明,2組T0點的Cor、NE及Glu對比無統計學意義,A組T1~T3點的Cor、NE及Glu明顯高于B組及A組T0點,B組T1、T2點的Cor、NE及Glu均明顯高于T0點,表明術后聯合術前超前鎮痛較術前超前鎮痛可更顯著改善甲狀腺癌根治術患者Cor、NE及Glu水平,主要是由于帕瑞昔布鈉術前聯合術后超前鎮痛的效果優于術前超前鎮痛,而患者疼痛與Cor、Glu、NE水平密切相關,因此術前聯合術后鎮痛更有助于降低患者的應激反應。表5結果表明,2組術后不良反應發生率對比無統計學差異,表明帕瑞昔布鈉術前及術后超前鎮痛對甲狀腺癌根治術患者較為安全。
綜上所述,帕瑞昔布鈉不同時間點超前鎮痛對甲狀腺癌根治術患者安全有效,可降低患者術中的應激反應。

