達氏鰉谷氨酸脫氫酶基因的克隆及雙低菜粕添加對其表達的影響
岳華梅,吳金平,陳細華,阮 瑞,李創舉
(農業農村部淡水生物多樣性保護重點實驗室,中國水產科學研究院長江水產研究所,武漢 430223)
近年來,隨著魚粉價格的不斷上升,利用廉價蛋白源替代魚粉已經成為當前魚類營養與飼料學研究的熱點之一[1]。雙低菜籽粕是雙低油菜籽經制油加工后的副產品。油菜籽中通常含有30%~40%的菜油,經榨取后可產生70%左右的餅粕。但是因其含有多種抗營養因子和毒素,如單寧酸、芥子油甙等, 可影響氨基酸的利用、消化酶的活性、礦物鹽的利用,限制了菜粕在魚類飼料中的使用量[2]。研究表明,烏蘇鱧(Pseudobagrusussuriensis)[3]、大黃魚(Pseudosciaenacrocea)[4]和歐洲鰉(Husohuso)[5]對雙低菜粕的表觀消化率低于魚粉。這可能是由于雙低菜粕屬于植物性蛋白原料,其纖維素所占比例較高,而水生動物缺乏消化纖維素的酶系統[6]。當飼料中選用植物性蛋白原料(如雙低菜粕)時,其是否影響魚類的蛋白質代謝目前研究較少。
飼料在體內蛋白酶的作用下水解生成多肽,多肽在肽酶(如氨肽酶N)的作用下水解生成小肽及游離氨基酸,最后被腸道轉運載體(如小肽轉運載體)吸收進入血液循環系統。谷氨酸脫氫酶(GDH)是蛋白質分解代謝和非必需氨基酸合成的關鍵酶,其活性與蛋白質合成與分解有直接關系[7]。GDH 是通過催化體內氨基酸氧化脫氨基作用來參與蛋白質的分解,具體作用是催化谷氨酸氧化脫氨基生成α-酮戊二酸和氨,其輔酶是NAD+或NADP,也可以催化其逆反應參與蛋白質的合成[8]。
達氏鰉(H.dauricus)隸屬鱘形目鱘科鰉屬,主要分布于我國黑龍江阿穆爾河流域,成魚個體較大,屬偏肉食性魚類。近些年來隨著養殖業的發展,達氏鰉及其雜交種也作為經濟魚類在全國范圍內開展推廣養殖[9]。本團隊前期研究表明,達氏鰉幼魚對雙低菜粕的粗蛋白及總氨基酸的表觀消化率顯著低于魚粉[10]。本研究旨在克隆蛋白質代謝關鍵基因谷氨酸脫氫酶,分析其序列及組織表達特征,并試圖從分子層面探究雙低菜粕是否影響達氏鰉幼魚的蛋白質代謝途徑,以期為菜粕在鱘魚飼料配方中的應用提供理論基礎。
1 材料與方法
1.1 實驗飼料
所配制飼料配方及營養成分見表1。實驗原料魚粉和雙低菜粕來自武漢大北農水產科技有限公司。所有原料粉碎后過60目篩,在基礎飼料中添加0.4%的二氧化鈦作為標記物,采用逐級混勻法,均勻混合到基礎飼料中,以測定其表觀消化率[10]。取70%添加二氧化鈦的基礎飼料和30%的菜粕,充分混勻后,添加20%左右的水,再次混勻,用小型絞肉機制成直徑約3 mm的條狀飼料。風扇吹干后,置于-20 ℃冰箱中保存備用。
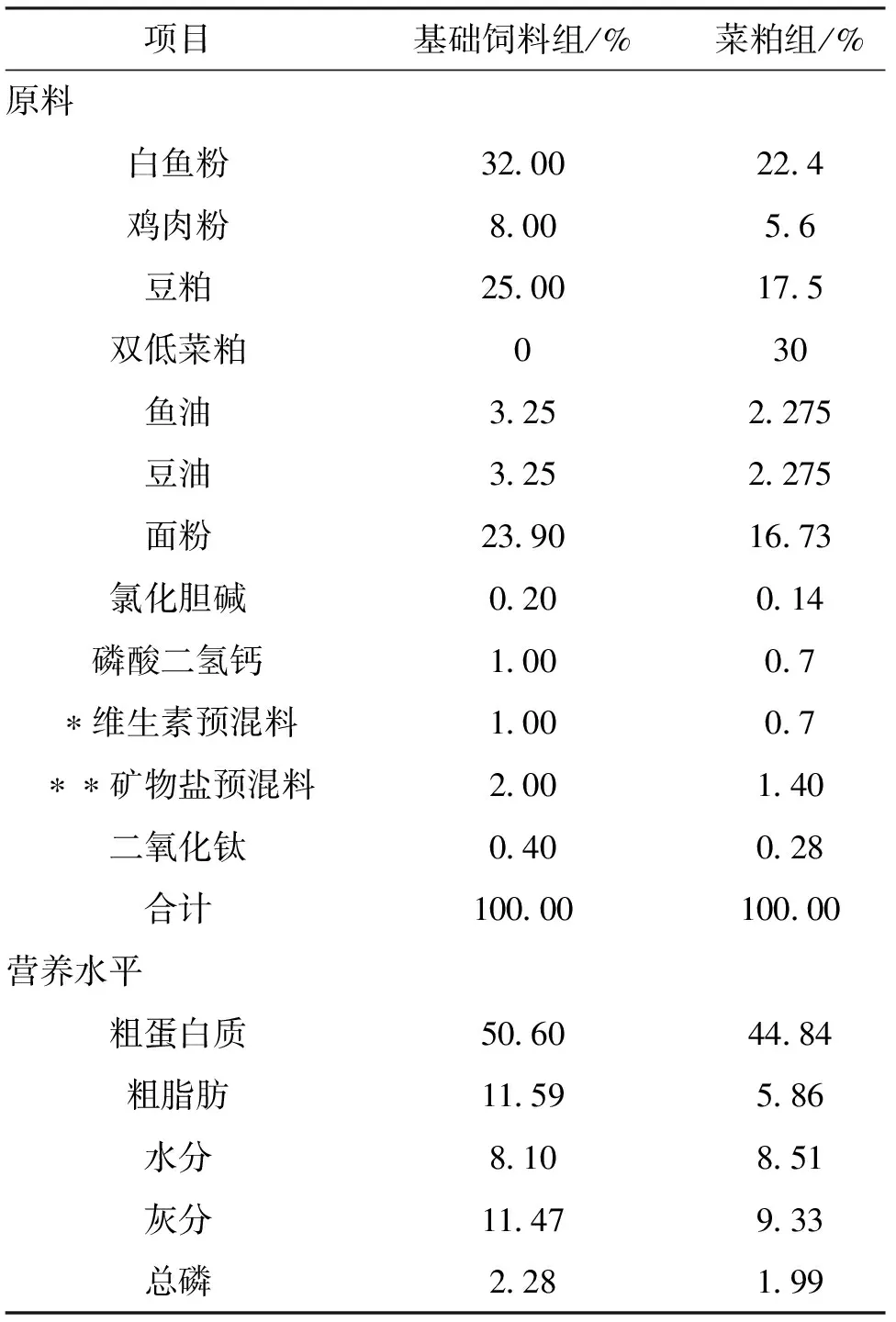
表1 基礎飼料組成及營養水平(干重)
注:*每千克飼料中含有維生素:VB150 mg,VB2200 mg,VB650 mg,VB1220 mg, 葉酸15 mg,VC(30%) 325 mg,泛酸400 mg,肌醇1500 mg,D-生物素(2%) 5 mg,煙酸750 mg,VA 2.5 mg,VE(50%) 100 mg,VD32 mg,VK 20 mg。
**每千克飼料中含有礦物鹽:Ca(H2PO4)21 800 mg,KH2PO41 350 mg,NaCl 500 mg,MgSO4·7H2O 750 mg,NaH2PO4、2H2O 650 mg,KI 1.5 mg,COSO4·6H2O 2.5 mg,CuSO4·5H2O 15 mg, ZnSO4·7H2O 350 mg,FeSO4·7H2O 1 250 mg,MnSO4·4H2O 80 mg,Na2SeO36.00 mg。
1.2 實驗魚養殖及樣品采集
達氏鰉幼魚來源于黑龍江撫遠江段野生個體自然繁殖,所得魚苗隨后飼養于長江水產研究所荊州太湖基地。挑選初始體重為(66.79±2.18 g)的達氏鰉幼魚120尾,隨機分養于6個流水養殖桶中(直徑105 cm,體積0.43 m3),每桶放魚20尾,其中3桶魚飼喂基礎飼料組飼料,另外3桶魚飼喂菜粕組飼料。經基礎飼料投喂2周后,開始用實驗飼料投喂,每天表觀飽食投喂2次(08:00,15:00)。實驗期間采取自然光照,水源為過濾后的地下水,水溫18.2~20.0 ℃,溶氧≥5 mg/L,pH 7.8~8.2。實驗飼料共投喂4周,取樣前對實驗魚進行24 h饑餓處理,然后隨機選取4條魚,經0.05% MS-222(Sigma)麻醉后,解剖取肝臟和腸組織,保存于RNAlater(Qiagen)保存液中,-80 ℃存放備用。組織表達分析所選用達氏鰉為9月齡(體長35 cm,體重585.4 g),分別取心、肝、脾、肌肉、腸、下丘腦、垂體組織,浸泡于RNAlater(Qiagen)保存液中,-80 ℃存放備用。
1.3 總RNA 提取
采用RNeasyPlus Mini Kit 試劑盒(Qiagen)進行組織總RNA 的提取,并參照PrimeScriptRT reagent Kit With gDNA Eraser(TaKaRa)試劑盒合成單鏈cDNA 用于熒光定量PCR分析。
1.4 谷氨酸脫氫酶基因ORF序列克隆及分析
根據實驗室已有的達氏鱘下丘腦轉錄組數據(未發表數據),搜索得到gdh同源基因的序列片段信息,設計嵌套引物進行PCR 擴增。PCR產物純化后連入pMD19-T 載體,轉化大腸桿菌感受態細胞(DH5α),挑取陽性克隆進行測序驗證。本研究所有引物均由生工生物工程(上海)有限公司合成(表2)。采用NCBI Conserved Domain Database對所得序列進行結構域預測(https://www.ncbi.nlm.nih.gov/cdd)。對推導的達氏鰉GDH氨基酸序列與NCBI中查詢得到的其它物種GDH序列運用Clustal Omega(https://www.ebi.ac.uk/Tools/msa/clustalo)進行序列一致性比對,并利用MEGA X 軟件以鄰接法(Neighbor-Joining, NJ)構建系統發生樹,自展法(Bootstrap)檢驗系統分支的置信度(重復次數為1 000)。所選取物種GDH氨基酸序列對應的NCBI序列號如下:人(CAA30521.1)、小鼠(EDL24875.1)、西部錦龜(XP_005294054.1)、綠海龜(EMP30951.1)、熱帶爪蟾(AAH84455.1)、非洲爪蟾(NP_001087023.1)、斑馬魚(NP_997741.1)、泥鰍(AEX31556.1)、黃鱔(AEX31558.1)、大西洋鮭(NP_001117108.1)、虹鱒(CAD11803.1)、羅氏沼蝦(ATN39850.1)、中華絨螯蟹(AEO72077.1)、凡納濱對蝦(ACC95446.1)。

表2 實驗所用引物序列
1.5 實時熒光定量PCR
根據所得到達氏鰉gdhcDNA 序列設計定量引物(表2),進行qRT-PCR 反應。達氏鰉apN及pepT1基因的熒光定量引物設計參考自達氏鱘下丘腦轉錄組數據庫搜索得到的相應同源基因的部分片段序列,并進行測序驗證。達氏鰉hsp90和18sRNA的熒光定量引物參考文獻[11]。實驗按SYBRPremix ExTaqTM(Perfect Real Time)試劑盒說明書進行操作,重復3次,以達氏鰉18S RNA作為內參基因。擴增反應在 Bio-Rad CFX96 Real Time System 儀上進行,反應程序為95 ℃預變性10 min,95 ℃變性15 s,53 ℃退火15 s,72 ℃延伸15 s,共40個循環。結果采用2-ΔΔCt分析法進行數據分析。
1.6 統計分析
實驗數據用平均值±標準差(Mean±SD)表示,并采用SPSS 22.0對各實驗組數據進行單因素方差分析,P<0.05表示差異顯著,P≥0.05表示沒有顯著性差異。使用GraphPad Prism 5.0軟件進行制圖。
2 結果
2.1 達氏鰉谷氨酸脫氫酶基因的cDNA序列擴增及分析
本研究克隆得到達氏鰉谷氨酸脫氫酶基因gdh的完整ORF序列。該序列全長1 635 bp,編碼544個氨基酸。結構域預測發現,達氏鰉GDH擁有兩個ELFV_dehydrog超家族結構域(圖1,下劃線標示)。氨基酸序列多重比對結果表明,達氏鰉GDH的氨基酸序列較為保守,與其它代表性脊椎動物的同源蛋白序列一致性均大于85%(圖2)。進一步運用Mega X軟件構建了基于GDH氨基酸序列的NJ系統發育樹(圖3),結果顯示,哺乳類代表物種人和小鼠先與爬行類的西部錦龜聚為一支,然后再與兩棲類的熱帶爪蟾及非洲爪蟾聚為一支,隨后這5個物種再與軟骨魚類達氏鰉聚為一類,而所有的硬骨魚類聚為單獨的一支。

圖1 達氏鰉gdh的ORF cDNA全長序列及推導的氨基酸序列Fig.1 The full-length ORF cDNA sequences of gdh and their putative amino acidsELFV_dehydrog結構域用下劃線標示
2.2 谷氨酸脫氫酶基因gdh的組織表達分析
采用熒光定量PCR法檢測了gdhmRNA在達氏鰉各組織(心、肝、脾、腸、肌肉、下丘腦、垂體)中的表達。gdh在所有檢測的組織中都有表達,其中在腸中的轉錄水平最高,在肌肉中的轉錄水平最低(圖4)。
2.3 雙低菜粕添加對gdh、apN、pepT1及hsp90基因表達的影響
在基礎飼料中添加雙低菜粕作為蛋白原料制備飼料投喂達氏鰉幼魚,檢測其對蛋白質代謝相關基因gdh、apN、pepT1及應激反應相關基因hsp90表達的影響。熒光定量PCR分析結果顯示,在肝臟中,gdh和hsp90的表達量在菜粕組和基礎飼料組沒有明顯變化(圖5A)。而在腸中,菜粕組gdh和apN基因的轉錄水平顯著高于基礎飼料組;pepT1基因在菜粕組的表達量雖也高于基礎飼料組,但是差異不顯著(圖5B)。
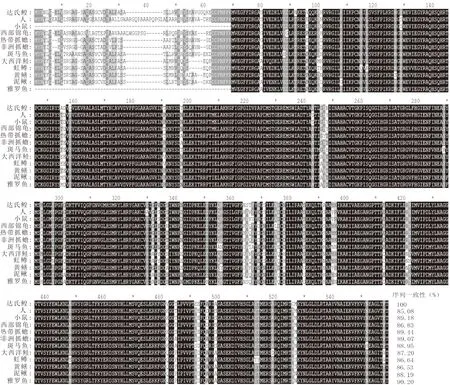
圖2 達氏鰉與其他代表性物種的GDH氨基酸序列多重比對分析Fig.2 Multiple sequence alignment of GDH between H. dauricus and other vertebrates除達氏鰉外,其它所有序列來源于Genbank。相同的氨基酸殘基用黑色陰影高亮顯示,60%一致的氨基酸殘基用灰色陰影表示
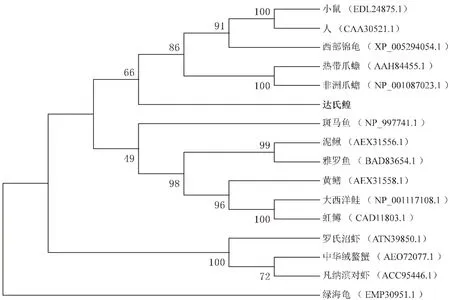
圖3 采用MEGA X軟件構建的基于GDH氨基酸序列的NJ系統進化樹Fig.3 NJ phylogenetic tree based on GDH amino acid sequences by MEGA X
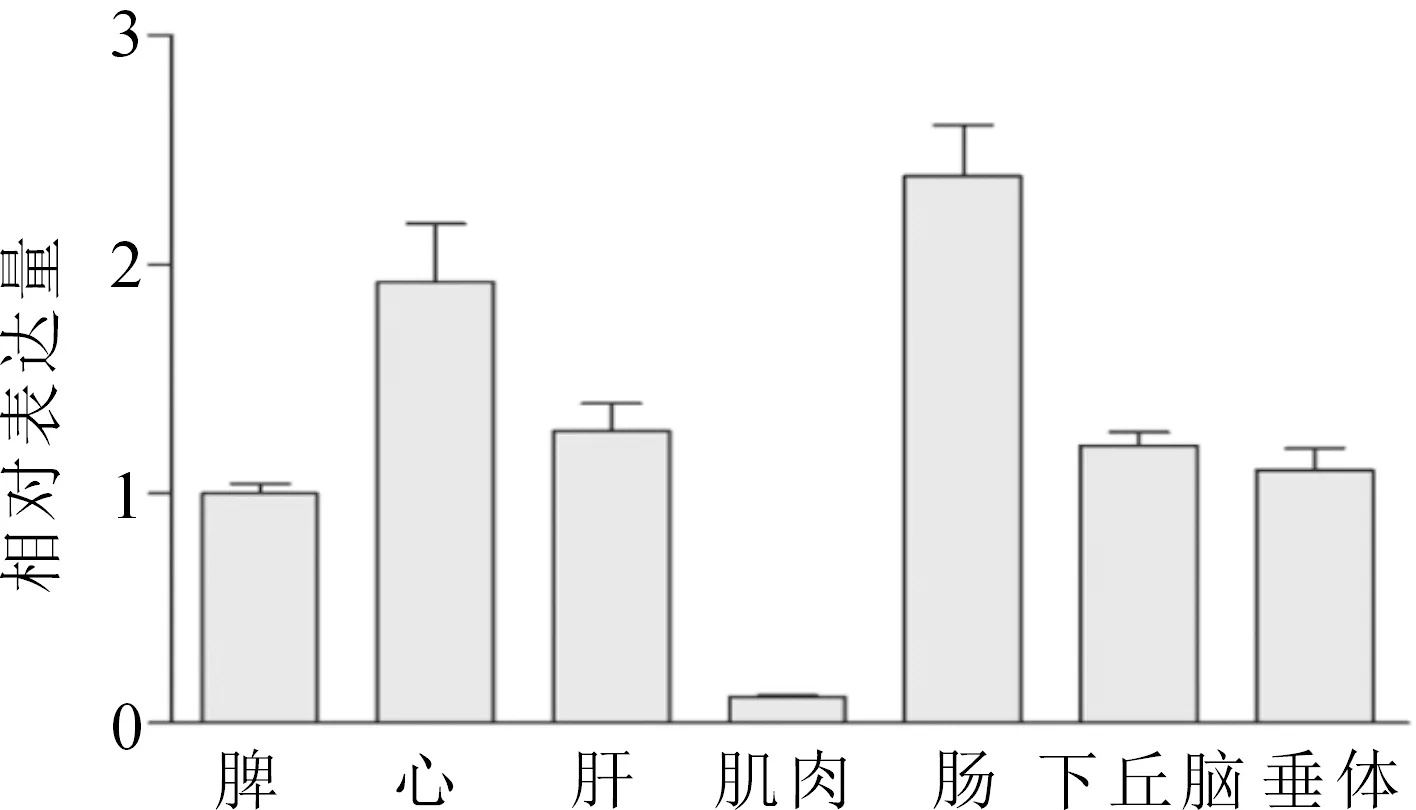
圖4 達氏鰉gdh基因在不同組織中的表達Fig.4 The transcription distribution of gdh in different tissues of H. dauricus

圖5 兩種蛋白原料對肝臟gdh、hsp90及腸gdh、apN、pepT1基因表達的影響Fig.5 The transcription differences of gdh and hsp90 in the liver(A) and gdh, apN, and pepT1 in the intestine(B) by the two different protein ingredients diets每組選取4尾魚進行分析,誤差線表示標準差,*代表差異顯著(P<0.05)
3 討論
本研究從達氏鰉中克隆得到谷氨酸脫氫酶基因的ORF序列,氨基酸序列多重比對結果表明GDH在脊椎動物中較為保守,暗示其具有保守的生物學功能。谷氨酸是含量最高的游離氨基酸之一,廣泛分布于各種組織中,包括腦、骨骼肌、肝、腎、腸和脂肪等組織中。本研究也發現達氏鰉gdh基因在所有組織中廣泛表達(圖4),這與其對谷氨酸的分解代謝功能是相一致的。在凡納濱對蝦(Litopenaeusvannamei)[12]、明對蝦(Fenneropenaeuschinensis)[13]及斑節對蝦(Penaeusmonodon)[14]中,gdh在肌肉中大量表達,這可能與甲殼動物的大量氨基酸代謝發生在肌肉中有關。在湘云鯽和紅鯽中,gdh在肝臟和前腸中表達量都較高[15]。本研究中達氏鰉gdh在腸中表達量最高,在肝臟組織中也有大量表達。腸道是魚類氨基酸消化、吸收及轉運的主要場所。另外,大量的研究證實GDH在肝臟和腸中的氨氮代謝中也發揮重要作用[12-14]。因此,GDH在肝臟和腸道中的高表達與其參與氨基酸消化及氨氮代謝功能相一致。
熱休克蛋白又稱為應激蛋白, 包含HSP90、HSP70、HSP60等蛋白家族。它是生物細胞(包括原核細胞及真核細胞)在受熱、生物應激、理化因素等應激原刺激后, 發生熱休克反應時所產生的一類伴隨細胞蛋白[16]。在本研究中,當在飼料中添加雙低菜粕時,肝臟中hsp90的表達沒有發生變化(圖5A),這說明雙低菜粕的添加沒有引起達氏鰉魚體的應激反應。
在本團隊前期研究中,達氏鰉對魚粉組總氨基酸的表觀消化率(98.62%±3.86%)顯著高于豆粕組(85.68%±3.97%)[10]。為了研究飼料中添加雙低菜粕是否會引起達氏鰉蛋白質代謝水平的升高,分別檢測了與蛋白質消化相關的gdh、apN基因及多肽轉運相關的pepT1基因的表達變化。GDH主要催化谷氨酸的去氨基化,生成副產品氨,參與氮代謝循環。APN屬于鋅金屬肽酶家族的一個成員,屬肽鏈端解,其在腸道中主要參與氨基酸的N端水解,以將小的多肽消化成氨基酸[17-18]。動物腸道小肽轉運載體pepT1的主要功能是將小肽從細胞外轉運至細胞內,在動物吸收外源小肽中起關鍵作用[19]。本研究結果顯示,雙低菜粕組腸道中gdh和apN的轉錄水平顯著高于基礎飼料組,pepT1的變化沒有顯著性差異(圖5B)。這說明為了更好地消化植物性蛋白質,達氏鰉體內的蛋白質轉錄水平得到提高,但是小肽轉運過程變化不顯著。以上結果暗示,在達氏鰉飼料中添加雙低菜粕,需綜合考慮其對生長及體內蛋白代謝水平的影響。

