桑色素與血清白蛋白相互作用熱力學行為
謝文,何歡,董家新,郭清蓮,*,劉義
1武漢大學中南醫院,武漢 4300712武漢大學化學與分子科學學院,病毒學國家重點實驗室和生物醫學分析化學教育部重點實驗室,武漢 4300723廣西師范大學化學與藥學學院,廣西 桂林 541004
1 引言
血清白蛋白(SA)是動物血漿當中含量最多的載體蛋白1,2,也是循環系統中最常見的可溶性蛋白質,主要承擔儲存和運輸內、外源物質的功能3,4。絕大多數生物活性物質,如類固醇激素、氨基酸、金屬離子和許多藥物分子,與血清白蛋白的親和力,直接決定了它們在機體中的分布5-7。其中,藥物分子進入血液后,通常首先與血清白蛋白結合,依賴血清白蛋白進行運輸,并轉運至病灶發揮生理藥理活性8。研究藥物與SA結合的熱力學行為和特征,有助于從分子層面深入闡述藥物在體內的運輸過程以及作用機制,是目前化學、醫藥學、生命科學領域共同感興趣的課題。
桑色素(英文名稱Morin,分子式C15H10O7,分子量302.23,分子結構如圖1所示)是一種從黃桑木、黃橙樹等桑科植物的樹皮中提取的天然黃酮類化合物。它具有抗菌、抗病毒、抗癌、解痙等多種藥理作用9。研究發現桑色素對金黃色葡萄球菌、痢疾桿菌和傷寒桿菌均有較強的抗菌作用10。桑色素對腹水型肝癌細胞具有永久性光敏殺傷作用,能夠抑制腹水型肝癌細胞DNA的合成11。最新的研究發現桑色素還可以和許多金屬離子形成配合物,其抗菌、抗病毒、抗氧性和抗癌活性更顯著12,13。因此,新型金屬-桑色素復合物的設計、合成及其生理活性的研究,是當前的研究熱點之一14,15。
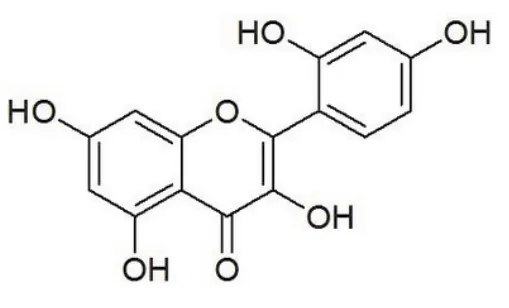
圖1 Morin的化學結構Fig. 1 Chemical structure of Morin.
桑色素具有優良的抗菌、抗腫瘤等生理活性,因此其與蛋白質、核酸等生物大分子的相互作用引起了許多研究人員的關注。戚祖德等人通過多種光譜手段,研究了Morin與人血清白蛋白(HSA)的相互作用,發現Morin能與HSA形成穩定的復合物16。Wang等人的報導指出0.5 mg·L-1的牛血清白蛋白(BSA)和人血清白蛋白就能夠有效猝滅桑色素的內源性熒光,且BSA的猝滅作用強于HAS17。宋玉民等通過電化學方法,研究了Morin與小牛胸腺DNA的相互作用,發現Morin與DNA發生較強烈的嵌入結合作用18。本文選擇牛血清白蛋白作為模型蛋白,利用熒光光譜、紫外-可見吸收光譜、圓二色譜和分子模擬技術,研究了牛血清白蛋白與桑色素的結合模式。
2 實驗部分
2.1 儀器和試劑
日立F-2500熒光分光光度計(配以恒溫附件,日本),普析TU-1901 UV-Vis分光光度計(中國),Sartorius ME215S分析天平(德國),Millipore純水儀(美國)。
分子對接實驗由Sybyl 8.1軟件(美國)Surflex-Dock模塊運行,操作系統為CentOS5.0系統。
牛血清白蛋白(BSA)和桑色素(純度 > 99%)均購自Sigma公司。BSA溶液由Tris-HCl緩沖溶液(0.05 mol·L-1、pH = 7.4)配制。三羥甲基氨基甲烷純度高于99.9%,NaCl、HCl和DMF等為分析純,桑色素用DMF溶解。試驗中DMF最大使用濃度為2%,該濃度下DMF對BSA沒有變性作用。
2.2 實驗方法
2.2.1 熒光光譜
熒光猝滅光譜:移取2.5 mL 1.0 × 10-5mol·L-1的BSA溶液于1 cm的石英比色皿中,用微量進樣器逐次加入Morin溶液,攪拌混合均勻,并延時1.5 min進行熒光強度測定,測試溫度分別為298、303、308和313 K。激發波長為280 nm,發射波長掃描范圍為300-450 nm。激發和發射的狹縫寬度均為2.5 nm。據上述方法,測定BSA與Morin在不同摩爾比情況下的熒光強度。
同步熒光光譜:采取同步掃描模式,激發掃描起始波長為230 nm,發射光譜掃描起始波長為290 nm,Δλ分別為15和60 nm。室溫條件下,測定BSA溶液以及BSA溶液與Morin在不同摩爾比情況下的同步熒光光譜。
2.2.2 紫外-可見吸收光譜
室溫條件下在210-500 nm波長范圍內測定BSA溶液(1.0 × 10-5mol·L-1)和Morin溶液(1.0 ×10-5mol·L-1)的吸收光譜,以及BSA與Morin摩爾比為1 : 1時的吸收光譜。
2.2.3 圓二色譜
室溫條件下采用Jasco J-810圓二色光譜儀測定BSA-Morin混合體系的CD光譜。BSA濃度為1.0 ×10-5mol·L-1,Morin濃度為0、1.0 × 10-5、2.0 × 10-5、4.0 × 10-5mol·L-1。掃描波長范圍為200-260 nm。用Tris-HCl緩沖溶液作為空白參比,從樣品光譜圖中扣除。
2.2.4 分子對接
BSA的晶體結構信息由Protein Data Bank(PDB)獲取,結構編號為3v0319。采用GaussView軟件構建Morin分子并優化其構型。應用選擇BSA中配體的方法,定義對接原型分子。
3 結果與討論
3.1 熒光猝滅機制及猝滅常數
熒光猝滅現象指熒光分子與溶劑分子或其它溶質分子相互作用,造成熒光強度降低、消失或熒光強度與濃度不呈現線性關系20,21。圖2給出了在298-313 K溫度條件下,Morin與BSA相互作用的熒光猝滅光譜。可以看出,隨著Morin的不斷加入,BSA的熒光峰強度均明顯降低,并且其降低程度隨Morin濃度增加呈一定的規律性,表明Morin能有效地與BSA發生相互作用22。同時,我們還發現隨著Morin的加入,BSA的最大發射波長并沒有明顯的變化,表明BSA生色基團周圍微環境的極性改變不大23。
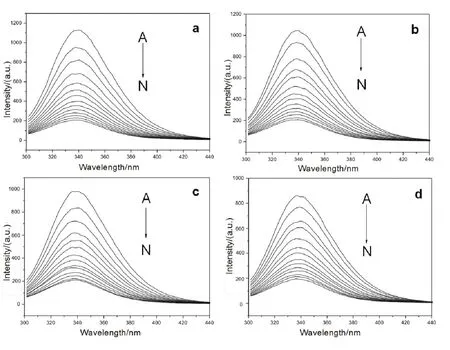
圖2 298-313 K溫度下Morin-BSA體系熒光光譜Fig. 2 Fluorescent spectra of BSA in presence of Morin at 298-313 K.c(BSA) = 1.0 × 10-5 mol·L-1; 105c(Morin)/(mol·L-1), A-N: 0.0, 0.4, 0.8,1.2, 1.6, 2.0, 2.4, 2.8, 3.2, 3.6, 4.0, 4.4, 4.8, 5.2, respectively.a: 298 K; b: 303 K; c: 308 K; d: 313 K.
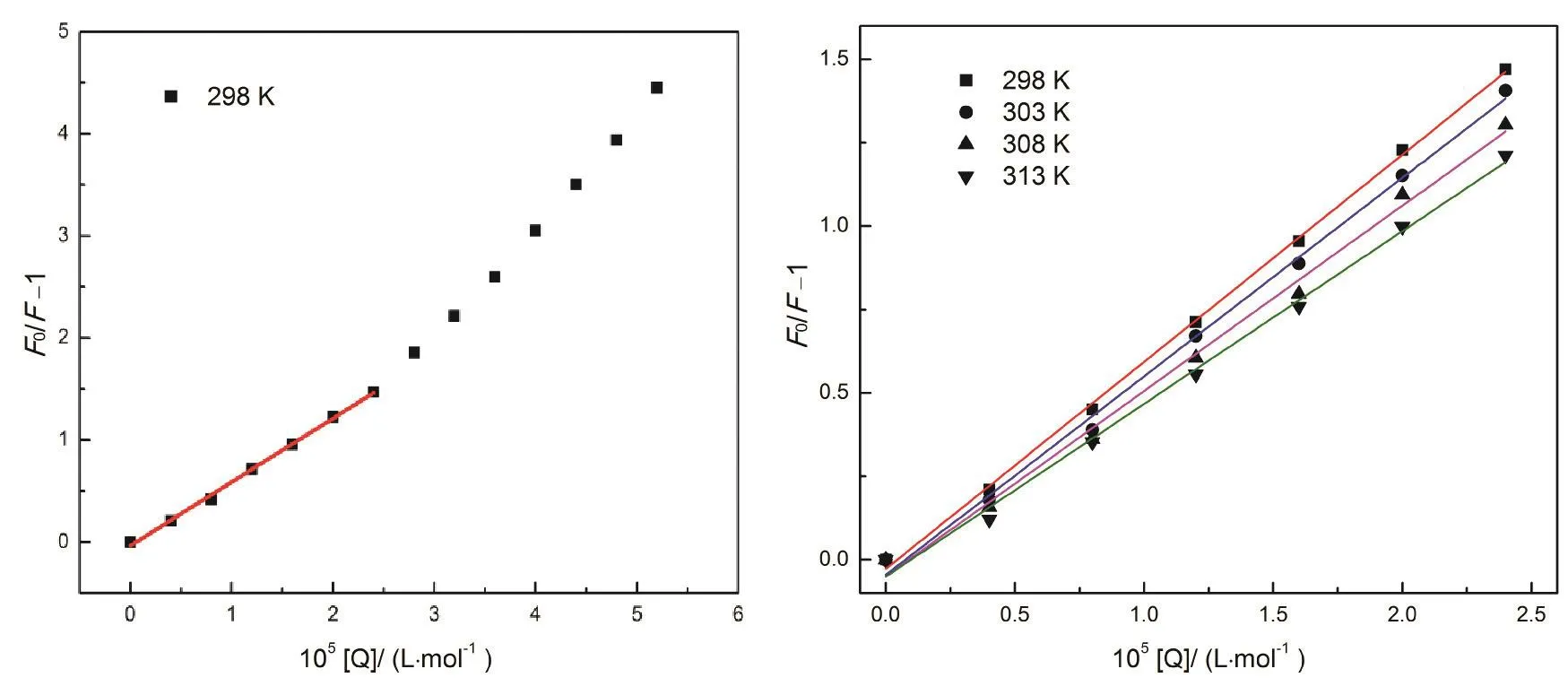
圖3 298-313 K溫度下BSA-Morin體系Stern-Volmer關系圖Fig. 3 Plots of Stern-Volmer equation of BSA-Morin system at 298-313 K.
大量的研究表明通過測定溫度對粘度或結合常數的影響可以區分熒光分子熒光猝滅機制24,25:靜態猝滅過程KSV隨溫度升高而降低,動態猝滅過程KSV隨溫度升高而升高26。基于此,我們對圖2中各濃度下的峰值按Stern-Volmer方程27分析:
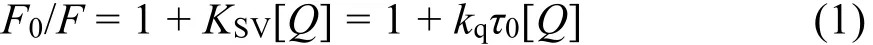
式中F0和F指有無猝滅劑時體系熒光強度;KSV為猝滅常數;[Q]為Morin的濃度;kq為BSA的猝滅速率常數;τ0為不存在猝滅劑時生物BSA的平均熒光壽命。根據文獻28報道,生物大分子的熒光平均壽命為10-8s。由圖3可以看到,Morin對BSA的熒光猝滅作用并不能在所有的濃度范圍內都呈現出良好的線性關系,但其在低濃度范圍內(0-2.4 μmol·L-1)具有良好的線性關系(線性相關系數R大于0.99)。因此,我們選取低濃度的熒光數據來進行處理,計算了不同溫度下KSV和kq,列在表1中,發現KSV隨溫度升高而減小,kq高于蛋白質最大碰撞猝滅速率常數29,推斷BSA與Morin分子之間的熒光猝滅可能是由于形成了復合物的靜態猝滅過程。
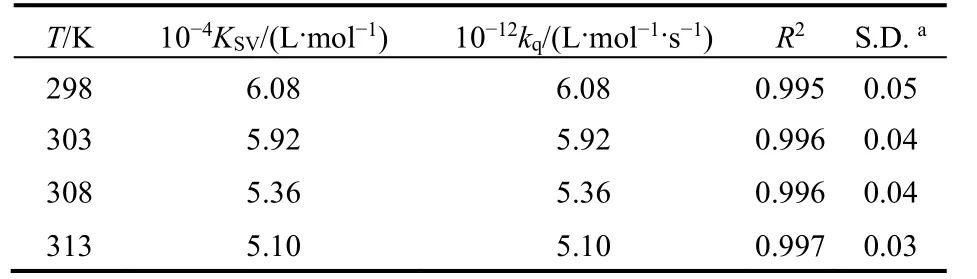
表1 pH = 7.4時298-313 K溫度下BSA-Morin體系猝滅常數Table 1 Quenching constants of Morin-BSA system at 298-313 K and pH = 7.4.
為了驗證Morin對BSA熒光的猝滅是靜態猝滅過程,分別測定了BSA、Morin單獨和混合條件下的紫外-可見吸收光譜。如圖4所示,可以發現BSA紫外-可見吸收光譜280 nm處的吸收峰在加入Morin之后明顯下降,表明Morin與BSA之間形成了基態復合物30,這進一步證實了BSA與Morin之間的靜態猝滅機制。
3.2 Morin與BSA間的作用模式
靜態猝滅過程的熒光數據可以用Lineweaver-Burk雙倒數函數來進一步處理31:
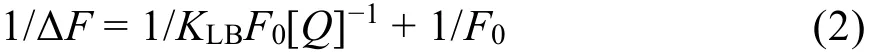
式中,F0表示不存在Morin時BSA的熒光強度;ΔF表示體系在不存在Morin與Morin濃度為[Q]時的熒光強度的差值;KLB是Lineweaver-Burk生成常數,用來反映BSA與Morin之間的結合達到平衡時的量效關系。根據Lineweaver-Burk雙倒數圖的直線斜率和截距進行計算,得到KLB等相關參數,列于表2中。
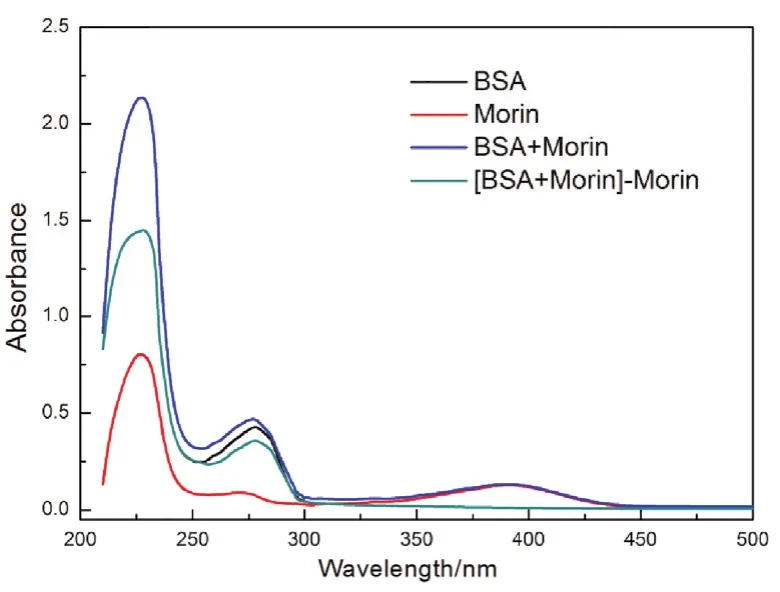
圖4 Morin-BSA體系的紫外-可見吸收光譜Fig. 4 UV-Vis absorption spectra of BSA-Morin system.c(BSA) = 1.0 × 10-5 mol·L-1; c(Morin) = 1 × 10-5 mol·L-1.

表2 298-313 K溫度下BSA-Morin體系的熱力學參數Table 2 Thermodynamic parameters of the interaction at 298-313 K.
根據作用距離及偶極矩差異,可將蛋白質與藥物小分子之間相互作用力分為范德華力、氫鍵、疏水作用力和靜電作用力;根據Ross等人的實驗結果,相互作用力類型可以通過相互作用熱力學參數的大小和符號來進行判斷32。為了研究BSA與Morin的作用力類型,計算了298-313 K下的ΔH?、ΔS?、ΔG?。相互作用過程的焓變ΔH?和熵變ΔS?可以通過van't Hoff方程獲得33:
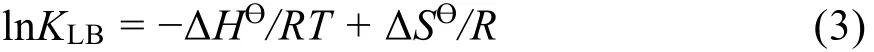
其中,R是氣體常數。ΔG?下式獲得:
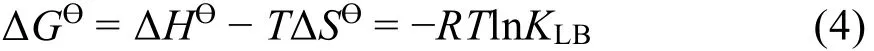
如圖5所示,以lnKLB對1/T直線擬合,從斜率和截距獲得焓變ΔH?和熵變ΔS?,得到298-313 K的吉布斯自由能變ΔG?,結果列于表2。ΔG?小于零可得BSA與Morin的結合是自發的,負的ΔH?和ΔS?說明氫鍵和范德華力是結合驅動力34。
3.3 Morin與BSA相互作用位點數
蛋白質等生物大分子通常有相互獨立的結合位點。對于靜態猝滅過程,藥物分子在蛋白質上的結合位點數可以由熒光強度-藥物濃度間對數關系式求出35:
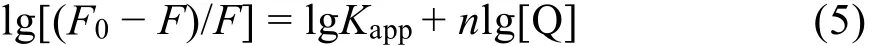
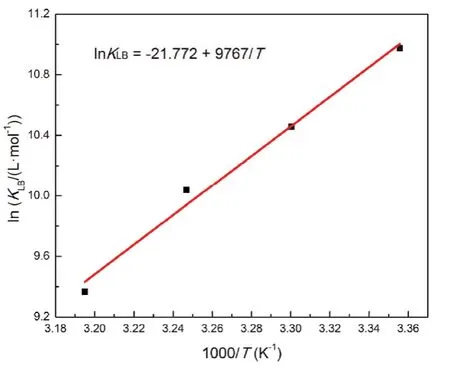
圖5 BSA-Morin體系的van't Hoff曲線Fig. 5 van't Hoff plot for BSA-Morin system.
式中F0和F分別表示不存在和存在Morin時BSA的熒光強度;[Q]為Morin的濃度,Kapp和n是表觀結合常數和結合位點數。
由上式擬合,從直線斜率和截距求出Morin與BSA相互作用的結合位點數n及表觀結合常數Kapp,列于表3。可以發現Morin與BSA平均結合位點數(naverage)為1.20,且溫度對結合位點數的影響不大,說明Morin與BSA之間基本上是1 : 1結合,有一個較強的結合位點。同時,Morin-BSA體系的表觀結合常數達到104數量級,進一步證實了Morin與BSA之間存在強的結合,表明了血清白蛋白在體內能起到儲存和運輸Morin分子的作用,能使Morin分子通過血液循環達到作用部位,從而發揮其生理生化效應。
3.4 Morin與BSA結合距離的計算
藥物分子與蛋白質的結合距離可以利用熒光共振能量轉移理論(Fluorescence Resonant Energy Transfer,FRET)進行計算,其猝滅程度滿足下式36:

式中,E表示蛋白質和藥物分子之間能量轉移效率;r指供體、受體真實距離;R0指50%轉移效率時臨界距離37:
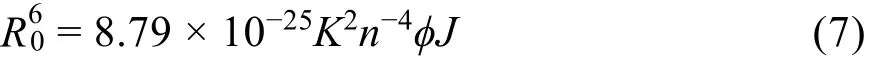
在上式中,K2為偶極方向空間因子,n表示介質的平均折射率38。φ為熒光殘基的熒光量子產率,J為光譜重疊積分,即:

F(λ)為蛋白質在波長λ處熒光強度,ε(λ)指藥物分子在λ處摩爾消光系數。圖6為Morin與BSA的濃度均為1 × 10-5mol·L-1時,Morin-BSA體系的發射光譜。將發射光譜與吸收光譜重疊區域按上式計算,得到J = 1.82 × 10-14cm3·L·mol-1。K2取2/3,n取有機物平均值1.36,色氨酸量子產率為φ = 0.1539,求出臨界距離R0為3.47 nm,由此求得色氨酸與Morin分子間平均距離r為3.09 nm。可見0.5R0< r < 1.5R0,說明BSA與Morin分子間符合熒光共振能量轉移(FRET)。

表3 Morin-BSA體系的表觀結合常數及結合位點數Table 3 The apparent binding constants and binding site numbers of Morin-BSA system.

圖6 BSA和Morin的熒光光譜Fig. 6 Fluorescence spectra of BSA-Morin system.[BSA] = 1.0 × 10-5 mol·L-1, [Morin] = 1.0 × 10-5 mol·L-1.
3.5 Morin對BSA構象的影響
3.5.1 同步熒光光光譜
蛋白質最大發射波長與其熒光氨基酸殘基周圍的微環境密切相關,因此可以通過同步熒光光譜研究蛋白質發光基團構象變化。當激發波長和發射波長的波長差固定為15和60 nm時,可以分別得到酪氨酸和色氨酸殘基周圍微環境改變的信息40。如圖7所示,隨著Morin的加入,酪氨酸殘基的最大發射波長基本上保持不變(最大發射波長保持在288 nm),表明Morin的加入對酪氨酸殘基所處微環境基本上沒有影響;色氨酸殘基的最大發射波長發生了微弱的紅移(最大發射波長從281 nm紅移至284 nm),表明Morin的加入對色氨酸殘基所處微環境的極性有一定的增強。與戚祖德等人的報導相比,可以發現Morin與HSA和BSA的作用機制存在一定的差異:Morin在HSA上的結合位點位于亞結構域II A,與HSA唯一色氨酸殘基(W214)的距離較近,導致W214所處微環境的疏水性發生明顯的增強(即極性發生減弱),因此的HSA熒光發生明顯的紅移16。結合熒光共振能量轉移數據,我們認為這可能是由于Morin在BSA中結合位點與BSA的兩個色氨酸距離較遠,不能直接改變色氨酸附近的蛋白質空間結構。
3.5.2 圓二色譜
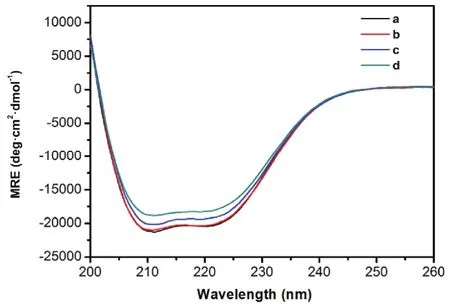
圖8 BSA-Morin體系的圓二色譜圖Fig. 8 CD spectra of BSA-Morin system.MRE: mean residue ellipticity. c(BSA) = 1.0 × 10-5 mol·L-1;105 c(Morin)/(mol·L-1), a-d: 0, 1.0, 2.0, 4.0, respectively.
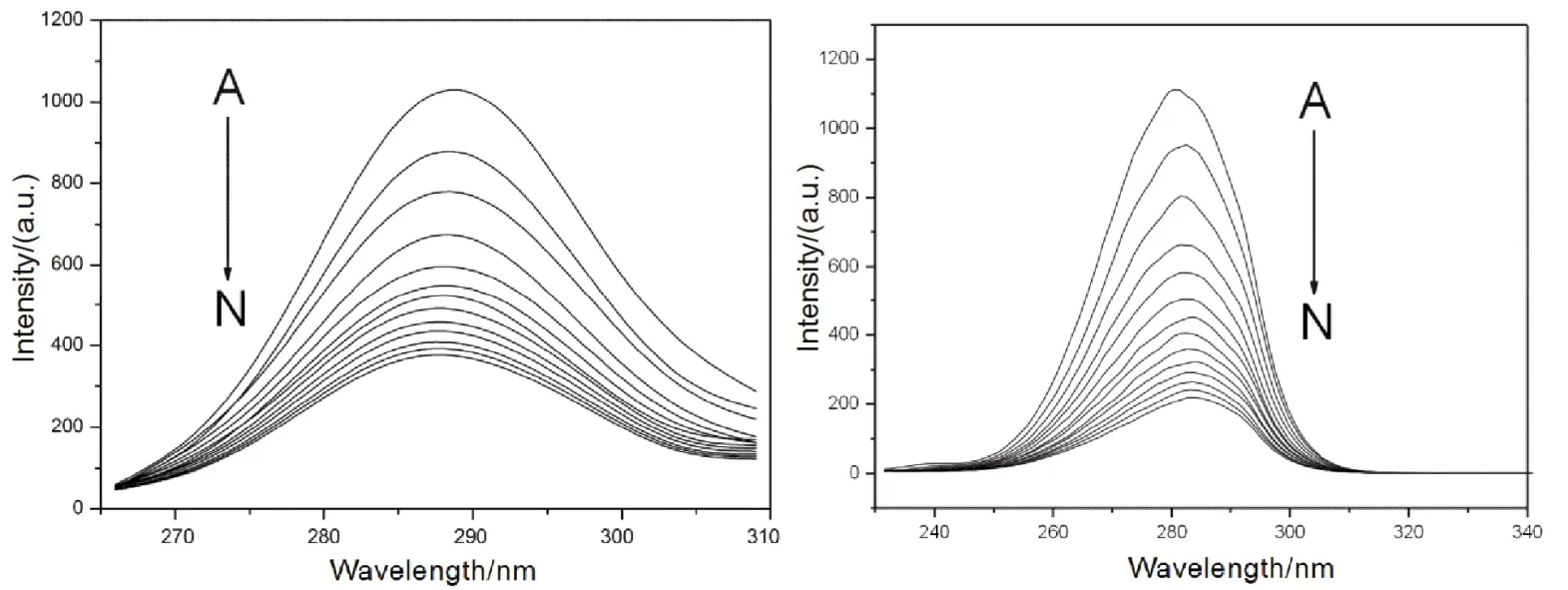
圖7 Morin與BSA相互作用的同步熒光光譜Fig. 7 Synchronous fluorescent spectra of BSA-Morin system.Left, Δλ = 15 nm; right, Δλ = 60 nm. Δλ = 60 nm, c(BSA) = 1.0 × 10-5 mol·L-1;105c(Morin)/(mol·L-1), A-N: 0.0, 0.4, 0.8, 1.2, 1.6, 2.0, 2.4, 2.8, 3.2, 3.6, 4.0, 4.4, 4.8, 5.2, respectively.
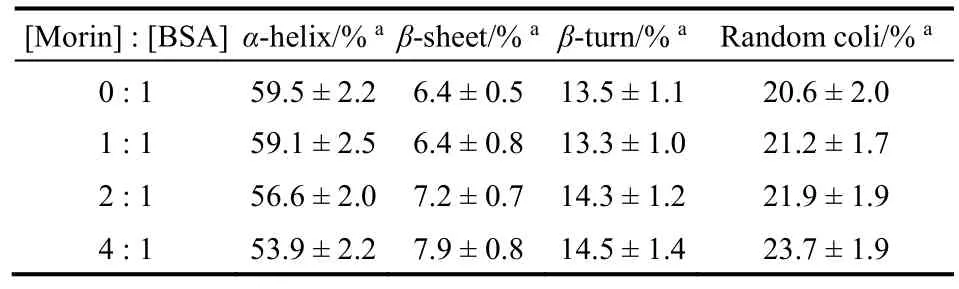
表4 Morin作用下BSA各二級結構百分比Table 4 Fractions of different secondary structures of BSA bound with Morin.
使用圓二色譜可以進一步研究Morin對BSA構象的改變(圖8)。BSA在遠紫外區表現出兩個明顯的負峰譜帶(208和222 nm),為典型的蛋白質α-螺旋結構的特征峰。隨著Morin濃度增加,BSA特征峰的強度顯著降低,且降低幅度與Morin濃度正相關,說明Morin對BSA的二級結構產生了破壞。表4列出了SELCON 3軟件分析得到的不同Morin濃度條件下BSA各二級結構的含量17。可以發現,當[Morin] : [BSA]為4 : 1時,蛋白質α-螺旋百分比從59.5%下降到53.9%,而無規結構的比例從20.6%上升到23.7%,說明BSA分子的二級結構在Morin的作用下有所破壞25。同時,加入Morin前后,BSA的CD光譜基本形狀變化不大,表明Morin和BSA發生相互作用后,BSA的二級結構還是以α-螺旋為主。
3.6 分子模擬
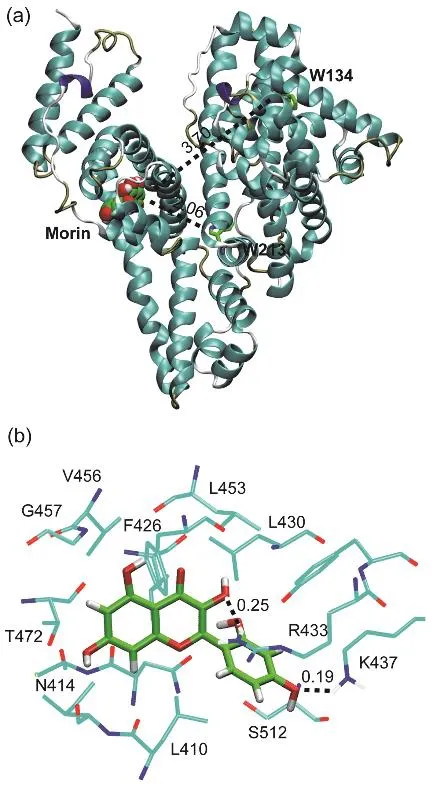
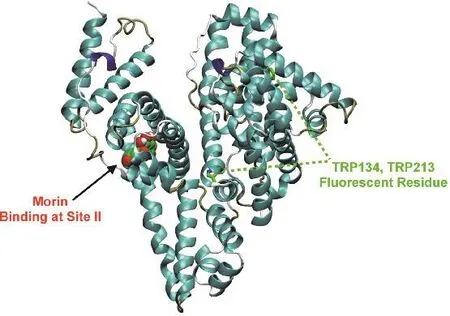
圖9 (a) Morin在位點II對接構象;(b) Morin周圍0.5 nm范圍內的氨基酸殘基Fig. 9 (a) Docking poses of Morin in site II;(b) the nearest residues around Morin within 0.5 nm.
黃酮類化合物在血清白蛋白亞結構域II A(site I)和亞結構域III A (site II)的結合均有報道41,且黃酮類化合物的官能化對結合位點的影響較大42;之前的研究則表明Morin結合在HSA的site I位點16。圖9a給出了Morin-BSA體系的最低能量結構。Morin的結合區域位于Ibuprofen位點,即site II。Morin與BSA兩個色氨酸殘基(W134和W213)的質心距離分別為3.70和2.06 nm,這與熒光共振能量轉移實驗的計算出的結果相符。圖9b顯示了Morin附近的氨基酸殘基,包括:L410、N414、L430、F426、R433、K437、L453、V456、G457、T472和S512,可以發現Morin主要與周圍疏水性的氨基酸殘基的支鏈發生接觸。此外,可以觀察到Morin分子上的羥基與R413、K437的側鏈間氫鍵的產生,與熱力學結果相符。
4 結論
熒光光譜和紫外-可見光譜結果表明Morin對BSA熒光的猝滅是靜態猝滅過程;計算出的焓變和熵變說明Morin與BSA結合的驅動力主要是氫鍵和范德華力。根據熒光共振能量轉移(FRET)理論和分子模擬結果,Morin在BSA上的結合位點位于亞結構域III A的位點II,且Morin分子與BSA兩個色氨酸殘基之間的平均距離為3.09 nm。Morin分子與BSA分子的結合會導致BSA分子結構發生了改變,其α-螺旋含量降低,無規結構比例上升。
黃酮類化合物與血清白蛋白的結合往往是自發進行的,熒光猝滅類型通常是靜態猝滅,但其結合驅動力卻存在一定的差異。例如,槲皮素、橙皮素、甲基橙皮素與HSA的結合驅動力為靜電作用力43,而血竭總黃酮tFSD與HSA的相互作用以非靜電作用為主44,這表明黃酮類化合物取代基的種類和位置對其與生物大分子的相互作用有較大的影響。
BSA的氨基酸序列與HSA非常類似,二者同源性約為80%,因此其空間結構也十分相近,然而本文獲得的結合熱力學參數表明Morin與HSA及BSA的相互作用類型存在一定的差異。根據戚祖德等人16的數據,Morin與HSA的結合自由能比BSA更大(298 K條件下ΔG?分別為-29.5和-27.1 kJ·mol-1),表明Morin與HSA之間的結合更強。同時,Morin與HSA相互的ΔH?和ΔS?均大于0,因此其相互作用力類型為疏水作用力,說明Morin與HSA和BSA之間的相互作用力類型也具有明顯的差異。分子模擬結果表明:這可能是由于Morin在HSA和BSA分子上的結合位點不同導致的,即Morin傾向于結合在HSA的亞結構域II A的位點I上16;而與BSA結合時,則結合在BSA的亞結構域III A的位點II。這些研究結果為了解桑色素分子的藥理提供基礎知識,為設計、修飾和篩選黃酮類藥物分子提供有益的啟發與指導。

