飼料魚溶漿影響黃顙魚的膽汁酸代謝及脂肪沉積
高敏敏 吳代武 周露陽 何 杰 葉元土 蔡春芳 吳 萍郁 濃 孫 飛 張銀照 浦琴華
(1. 蘇州大學基礎醫學與生物科學學院, 蘇州 215123; 2. 浙江豐宇海洋生物制品有限公司, 舟山 316000;3. 浙江一星實業股份有限公司, 海鹽 314300)
膽汁酸(Bile acid, BA)是膽汁的重要組成成分,是膽固醇在代謝過程中所產生的一系列膽烷酸的總稱, 一般以鈉鹽或鉀鹽的形式存在, 稱為膽汁酸鹽。膽汁酸合成的經典途徑是以膽固醇為原料, 通過一系列酶促反應生成膽酸(Cholic acid, CA)和鵝脫氧膽酸(Chenodeoxycholic acid, CDCA), 膽固醇7α羥化酶(Cholesteral 7α hydroxylase, CYP7A1)是此反應的限速酶[1]。合成的膽汁酸在肝毛細膽管膜處的膽鹽輸出泵(Bile salt export pump, BSEP)介導下形成膽汁流, 分泌到毛細膽管, 經膽汁外排進入小腸[2]。膽汁酸在回腸被重吸收入門靜脈, 進入血循環。膽汁酸在肝細胞血竇面基底膜上的牛磺膽酸鈉協同轉運蛋白(Na+-taurocholate contransport peptide, NTCP)介導下被肝細胞所攝取[3], 再經BSEP被分泌入膽小管。膽汁酸從肝臟合成, 貯存于膽囊, 隨膽汁分泌入小腸, 在回腸被重吸收再通過門靜脈回到肝臟的循環過程稱為膽汁酸的腸肝循環[4]。膽汁酸腸肝循環是維持體內膽汁酸池大小穩定的重要調節環節, 也是調節膽汁酸合成速率的重要機制。
牛磺酸是蛋氨酸、半胱氨酸的代謝終產物, 近年來的研究表明牛磺酸在哺乳動物體內具有廣泛的生物學功能, 包括: 參與膽汁酸的合成和脂肪的代謝, 促進脂肪的乳化作用和脂類物質(如脂溶性維生素)的消化吸收等。肝臟合成的游離膽汁酸與牛磺酸結合成牛磺膽酸(Taurocholic acid)及牛磺鵝脫氧膽酸(Taurochenodeoxycholic acid)后, 與BSEP的親和力增強, 促進了膽汁酸的分泌[5]。隨著魚粉替代蛋白的研究, 牛磺酸在魚類中的研究也受到廣泛地關注, 但主要是探討其在生長性能、魚體免疫方面的影響[6], 尚無關于牛磺酸對魚類膽固醇、膽汁酸代謝的相關報道。膽固醇、膽汁酸的代謝平衡對魚體健康有重要影響, 高膽固醇會引起脂肪代謝障礙[7]; 而膽汁酸可有效促進魚體脂肪的代謝,減少組織脂肪沉積[8]。因此, 研究牛磺酸對魚類膽固醇、膽汁酸代謝的具有重要意義。前期研究發現以魚粉生產過程中的壓榨液濃縮物——魚溶漿(Stickwater, SW)為蛋白源, 可顯著降低黃顙魚飼料產品中的魚粉需求量, 但同時, 魚溶漿會降低魚體脂肪沉積量[9], 因此本文深入探討魚溶漿對黃顙魚膽汁酸代謝及其組織分布的影響, 為魚溶漿對魚類膽固醇、膽汁酸代謝提供科學依據。黃顙魚(Pelteobagrus fulvidraco), 隸屬鲇形目(Siluriformes)、鲿科(Bagridae)、黃顙魚屬(Pelteobagrus), 是一種優質名貴經濟魚類, 偏肉食性, 具有脂肪含量高的特點, 是研究膽汁酸代謝的優選對象。
1 材料與方法
1.1 試驗材料
試驗魚粉為Companfa Pesouera del Pacffico Centro S.A.(Lima, Peru)生產的超級蒸汽魚粉, 魚溶漿由浙江豐宇海洋生物制品有限公司提供, 制備過程見Wu等[9]。魚粉、魚溶漿主要營養成分見表1。魚溶漿中牛磺酸水平是魚粉的5.3倍。
1.2 試驗日糧的制備
以30%魚粉日糧為對照(FM), 在無魚粉日糧中分別添加約8% (SW8)、17% (SW17)、25% (SW25)的魚溶漿(干物質), 設計4組等氮等能日糧(表 2)。在試驗配方中, 以混合油脂(魚油∶磷脂油∶豆油=1∶1∶2)平衡各試驗日糧脂肪含量, 以磷酸二氫鈣保持各試驗配方總磷含量, 大豆濃縮蛋白、棉籽蛋白和雞肉粉同比例變化保持氨基酸平衡, 以米糠粕保持試驗日糧配方比例平衡。玉米蛋白粉作為黃顙魚日糧色素來源而各在配方中保持一致。日糧的制作與Wu等[9]一致, 原料粉碎后過60目篩, 按照表 2進行飼糧原料的配合。用混合機混合均勻后,用華祥牌HKj200制粒機加工成制成直徑1.5 mm,長3—5 mm的顆粒飼糧。所有的試驗飼糧風干后-20℃密封保存備用。
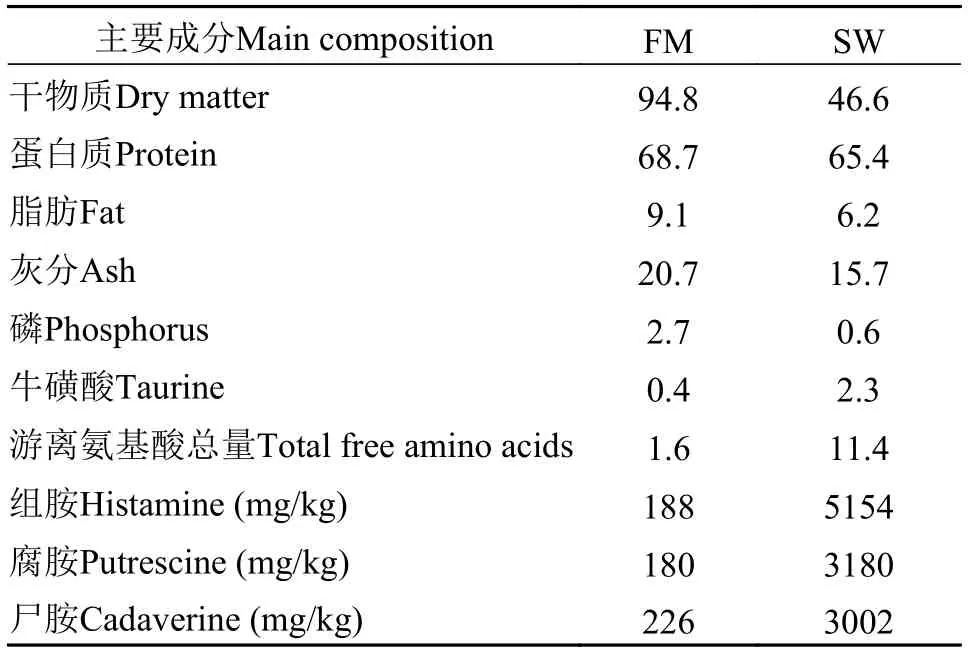
表 1 試驗用魚粉、魚溶漿主要成分分析Tab. 1 Chemical composition of experimental fish meal and stickwater (g/100g)
試驗日糧營養成分實測值見表 2, 各組間蛋白質、脂肪、總磷、能量水平無顯著差異。SW8、SW17和SW25組組胺、腐胺、尸胺較FM組升高明顯, SW25組是FM組的21.5、14.0和10.5倍。SW17、SW25組試驗日糧牛磺酸水平比FM組高55.6%和88.9%。日糧丙二醛、過氧化值無明顯差異, 僅酸價呈現一定程度升高, 表明油脂氧化程度差異性不顯著。
1.3 試驗魚與養殖管理
養殖試驗在浙江一星養殖基地池塘網箱中進行, 在面積為40 m × 60 m的池塘中設置試驗網箱(規格為1.5 m× 1.5 m × 2.0 m) 12個, 以海鹽縣長山河河水為水源。為保證池塘溶氧均勻, 池塘中間設置1臺1.5 kW的葉輪式增氧機, 同時設置1臺2.2 kW的微孔增氧鼓風機。每2個網箱之間, 在水下1.8 m的深度放置一個直徑為0.5 m的圓形微孔增氧盤(增氧盤由直徑20 mm納米曝氣管制成), 投喂期間關閉增氧設備, 投喂前使用微孔增氧1h, 其余時間使用葉輪式增氧。
試驗用黃顙魚苗購自浙江省湖州農業合作社,運輸前停食24h。0.3%食鹽溶液浸泡15min消毒后,200尾/網分配到試驗網箱中暫養, 馴養2周。選取規格整齊的黃顙魚種, 0.3%食鹽溶液浸泡15min消毒后, 隨機分成4組, 每組設3個重復(n=3), 共12個試驗網箱, 每個網箱46尾黃顙魚。黃顙魚初始體重為(15.67±0.11) g。
試驗魚網箱適應2周后開始正式投喂。每天投喂3次(5:30—7:00、12:00—13:30和18:00—20:00),日投喂量為體重的3%—5%, 三餐投喂比例2∶2∶3,每10天估算1次魚體增重, 調整投喂量, 正式投喂60d。每天6:00和18:00記錄池塘水溫, 試驗期間水溫25.5—34.4℃。每5天測定水下30 cm的水環境,養殖期間水體溶解氧濃度>7.0 mg/L, pH 8.0—8.4,氨氮濃度<0.10 mg/L, 亞硝酸鹽濃度<0.005 mg/L,硫化物濃度<0.05 mg/L。
1.4 樣品采集
在試驗正式開始時, 隨機抽取黃顙魚6尾, 作為初始樣本用于全魚體成分分析。正式養殖試驗60d后, 停食24h, 進行試驗結束采樣工作。包括以下內容: 每個網箱黃顙魚進行稱重, 計算增重率。每網箱隨機取4尾魚保留全魚樣品, 用于體成分分析。隨機取10尾魚, 以1 mL無菌注射器自尾柄靜脈采血, 自然凝固30min, 3500 r/min、室溫離心10min,取上層血清混合, 液氮速凍后于-50℃冰箱保存, 用于血清生理指標的分析; 解剖10尾魚取肝胰臟和腸道內容物分別混合, 肝胰臟用于脂肪、膽汁酸測定,腸道內容物膽汁酸含量分析; 每網箱隨機取3尾魚肝胰臟組織小塊置于滅酶EP管中, 液氮速凍, 于-80℃保存備用, 用于基因學分析。
1.5 樣品分析
主要營養成分原料、日糧、全魚樣品用粉碎機低溫粉碎均勻, 用LGJ-18B型冷凍干燥機干燥至恒重測定水分; 凱氏定氮法(GB 5009.5-2010)測定粗蛋白質含量; 索氏抽提法(GB/T 14772-2008)測定粗脂肪含量; GB 5009.4-2010中方法測定粗灰分含量; 采用分光光度法(GB/T 6437-2002)測定總磷的含量; 能量采用XRY-1C型氧彈式熱量計測定。
牛磺酸的測定原料、日糧中氨基酸、牛磺酸含量的測定參考吳代武等[10]的分析方法。
生理指標血清谷草轉氨酶(AST)、谷丙轉氨酶(ALT)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、膽固醇(CHOL)、膽汁酸(BA)和甘油三酯(TAG)采用雅培C800全自動生化分析儀測定。
肝胰臟、腸道內容物與生理鹽水1∶9, 組織勻漿, 5000 r/min離心10min。取上清液用雅培C800全自動生化分析儀測定膽汁酸含量。
熒光實時定量 PCR(qRT-PCR)取適量肝臟(不超過100 mg), 液氮研磨成粉末狀后, 加入1 mL Trizol (生工)完全覆蓋粉末, 待融化后快速轉移至1.5 mL RNAase free EP管中, 按照Trizol法提取樣本的總RNA。之后采用Prime ScriptTMRT reagent kit with gDNA Eraser (TaKaRa)將RNA反轉錄成cDNA, 反轉錄產物稀釋后于-20℃保存用于熒光定量分析。
基因序列依據高敏敏等[11]基因測序結果, 利用Primer Premier 5設計定量引物, 引物序列見表 3, 蘇州金唯智公司合成。熒光定量采用SYBR Premix ExTaqTMⅡ試劑盒(Takara, Japan), 反應條件為: 預變性95℃ 30s, 變性95℃ 5s, 退火溫度20s, 40個循環。溶解曲線程序為: 95℃ 15s, 60℃ 30s, 20min,95℃ 15s。以DEPC水替代模板作為負對照, 采用2-ΔΔCt方法來測定目的基因的相對表達量[12]。
1.6 計算與分析
原始數據經Excel 2003初步整理后, 用SPSS 19.0進行單因素方差分析(One-Way ANOVA), 事后進行Duncan氏多重比較分析試驗數據的差異顯著性, 結果以平均值±標準差(Mean±SD)表示, 以P<0.05為差異顯著水平。
2 結果
2.1 黃顙魚器官組織膽汁酸含量與膽汁酸循環
黃顙魚肝胰臟、血清、腸道內容物中總膽汁酸含量黃顙魚肝胰臟、血清、腸道中膽汁酸水平見圖 1。SW8和SW17組黃顙魚肝胰臟、血清、腸道內容物中膽汁酸水平均與FM組無顯著差異, 而SW25組肝胰臟膽汁酸水平降低了76.3% (P<0.05), 血清、腸道內容物中膽汁酸水平分別升高了125.7%、123.3%(P<0.05)。
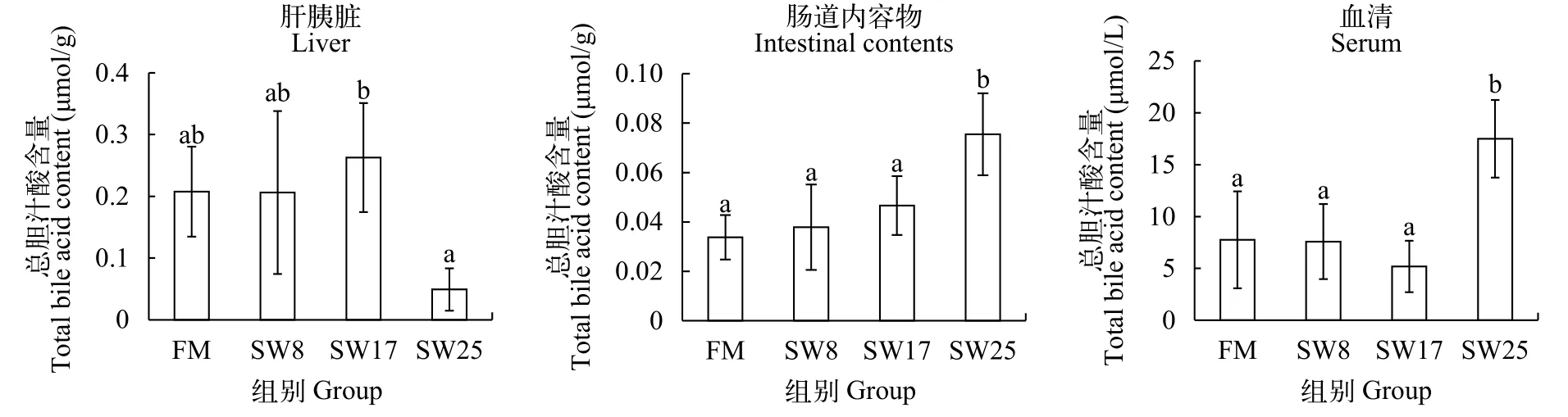
圖 1 魚溶漿對黃顙魚肝胰臟、血清、腸道內容物膽汁酸水平的影響Fig. 1 Effects of stickwater on bile acid in liver, serum, intestine of yellow catfish
膽汁酸腸肝循環代謝關鍵基因的 mRNA 表達活性無魚粉日糧中添加8%—25%魚溶漿對黃顙魚肝胰臟CYP7A1 mRNA的表達量沒有顯著影響(P>0.05, 圖 2), 而BSEP、ABCC4、NTCPmRNA的表達量隨魚溶漿添加量增加而呈現上升趨勢,SW25組的表達量比FM組高16.9%、68.2%和222.8%,ABCC4、NTCP基因表達量變化顯著(P<0.05)。
結果表明, 無魚粉日糧中添加8%—17%的魚溶漿對黃顙魚肝胰臟膽汁酸的合成沒有顯著性的影響, 對膽汁酸的分泌作用有顯著性的影響。25%魚溶漿不影響膽汁酸的合成, 但會促進肝胰臟膽汁酸向血液、腸道中轉移。
2.2 黃顙魚魚體脂肪沉積的變化
魚溶漿降低黃顙魚脂肪沉積與FM組相比,黃顙魚全魚蛋白質含量不受日糧魚溶漿添加量影響(圖 3), 但全魚脂肪含量降低, SW25組變化顯著(P<0.05), 肝胰臟脂肪含量變化與之相似, SW17和SW25組變化顯著(P<0.05)。
黃顙魚血脂含量與轉氨酶活性各試驗組血清AST和ALT無顯著差異(表 4), 表明肝胰臟細胞未受到損傷。SW8組血清CHOL最高, 但與FM組無顯著差異(P>0.05), SW17和SW25組CHOL比FM組低11.9%—16.6%。與FM組相比, 攝食魚溶漿日糧的黃顙魚血清TAG水平降低了32.5%—47.9%,SW17和SW25組變化顯著(P<0.05), 血清GLU、HDL和LDL水平無顯著差異。結果表明, 在日糧中添加25%魚溶漿促進魚體脂肪的代謝過程, 降低脂肪沉積。
3 討論
3.1 魚溶漿對黃顙魚膽汁酸腸肝循環代謝的影響
前期研究發現, 在黃顙魚日糧中以魚溶漿為蛋白源, 會降低魚體脂肪沉積[9], 在此基礎上, 本文深入探討魚溶漿對黃顙魚膽汁酸代謝及其組織分布的影響。結果表明, 與魚粉日糧相比, 無魚粉日糧中添加25%的魚溶漿, 肝胰臟膽汁酸水平降低了約76%, 而血清、腸道中膽汁酸水平升高了125%。試驗結果表明魚溶漿的使用是黃顙魚膽汁酸代謝差異變化的主要原因, 而魚溶漿中哪些因素會導致膽汁酸代謝的差異? 依據魚溶漿、試驗日糧中主要化學成分的分析, 主要包括小肽、牛黃素胺、生物胺、油脂氧化產物等含量在無魚粉日糧中存在較大的差異。
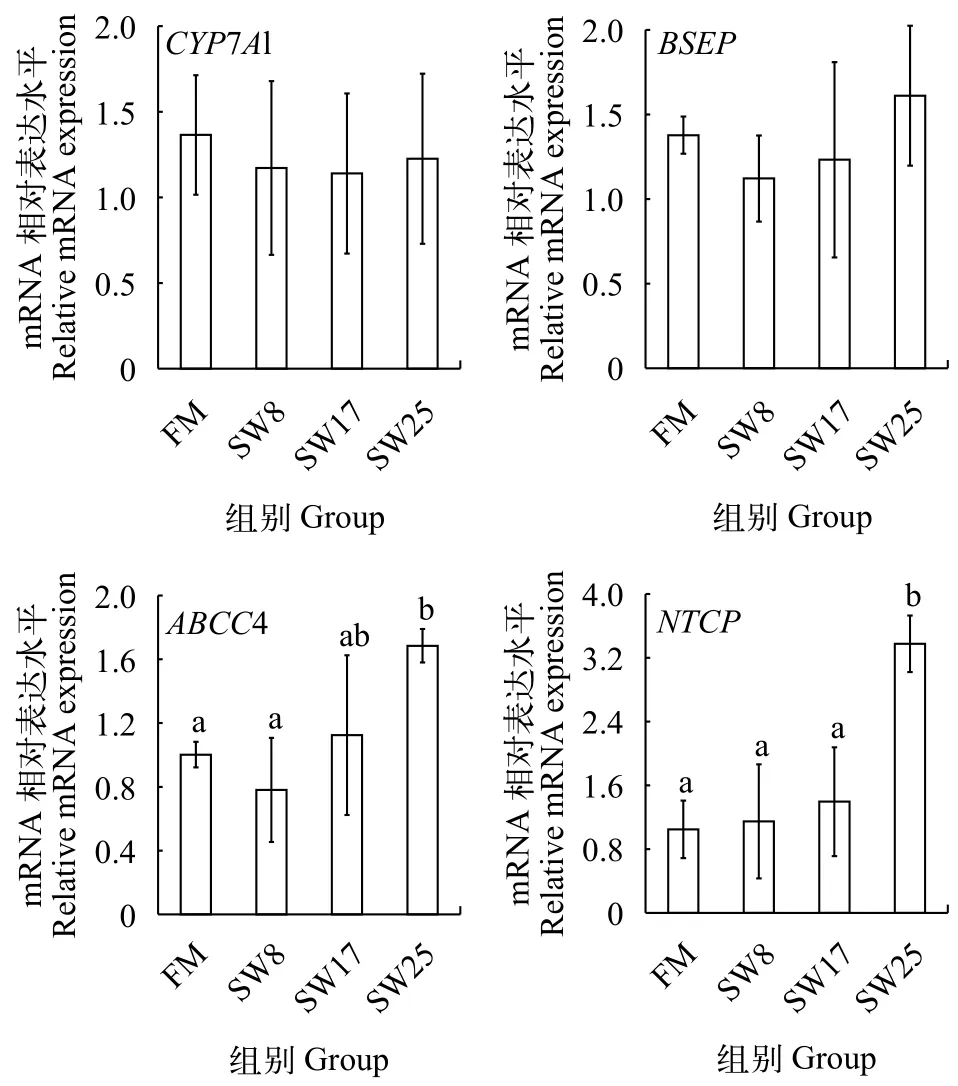
圖 2 魚溶漿對黃顙魚肝胰臟CYP7A1、BSEP、ABCC4、NTCP mRNA的表達量的影響Fig. 2 Effects of stickwater on the expression of CYP7A1, BSEP,ABCC4 and NTCP in liver
高敏敏等[11]的研究表明, 油脂氧化會導致血清膽汁酸水平降低, 在本試驗中油脂氧化程度差異較小, 表明油脂氧化不是本試驗中黃顙魚膽汁酸代謝差異性變化的影響因素。各組試驗魚血清AST和ALT無顯著差異(表 4), 表明黃顙魚肝胰臟沒有出現損傷, 也不是膽汁酸代謝差異的主要原因。
與魚粉相比, 魚溶漿主要含溶解于水中的蛋白質、小肽、生物胺、游離氨基酸等(表 1)。本研究在日糧中添加25%魚溶漿, 黃顙魚肝胰臟BSEP表達量上調、腸道膽汁酸水平增加, 是否受組胺等生物胺的影響有待進一步研究。目前很少有生物胺對魚類膽汁酸代謝的影響見報道, 僅何杰等[13]發現在日糧中添加84.60 mg/kg的組胺不影響黃顙魚血清膽汁酸、膽固醇含量。有研究表明牛磺酸在膽汁酸代謝過程中具有重要的生物學功能[14—16]。牛磺酸在魚體大量以游離形態存在, 原料魚在蒸煮過程中牛磺酸更多的進入壓榨液, 所以魚溶漿牛磺酸含量遠高于魚粉(表 1)。研究表明, 肝臟合成的游離膽汁酸與牛磺酸結合形成牛磺膽酸(Taurocholic acid)及牛磺鵝脫氧膽酸(Taurochenodeoxycholic acid), 增加日糧牛磺酸供應, 魚體牛磺膽酸、牛磺鵝脫氧膽酸水平會顯著升高[11,17]。肝臟合成的膽汁酸依靠肝毛細膽管膜處BSEP分泌到毛細膽管[2],與游離膽汁酸相比, 結合膽汁酸與BSEP的親和力增強[5,18]。增加日糧魚溶漿添加量, 提高牛磺酸供應, 可能導致魚體牛磺膽酸、牛磺鵝脫氧膽酸水平會升高, 導致肝胰臟BSEPmRNA的表達量上調。BSEPmRNA的上調促進了肝胰臟膽汁酸向膽管分泌, 引起腸道膽汁酸水平的升高, 大量研究也驗證了日糧供應牛磺酸會促進膽汁酸的分泌作用[14—16]。膽汁酸的腸肝循環是維持體內膽汁酸池大小穩定的重要調節環節。陳文等[16]的研究表明, 牛磺酸會促進膽汁酸隨糞便的排出, 機體以膽固醇的降解來補充膽汁酸的排出, 從而起到降低血清CHOL的作用, 意味著魚溶漿的使用會導致腸道膽汁酸的流失,這也會在一定程度上促進肝胰臟膽汁酸向腸道的補充分泌。
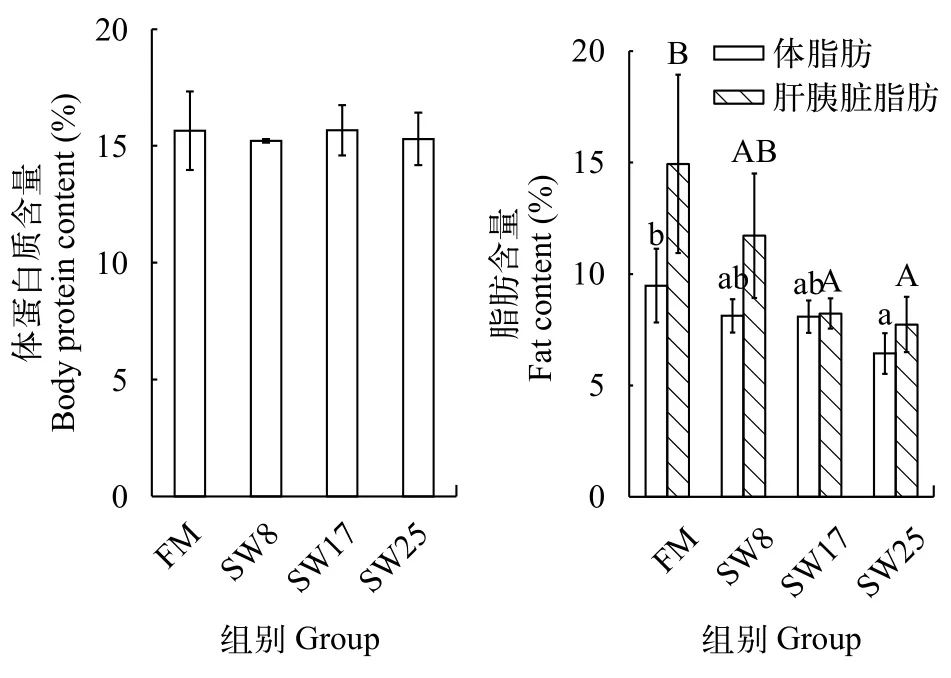
圖 3 魚溶漿對黃顙魚體成分的影響Fig. 3 Effects of stickwater on weight gain and body composition of yellow catfish
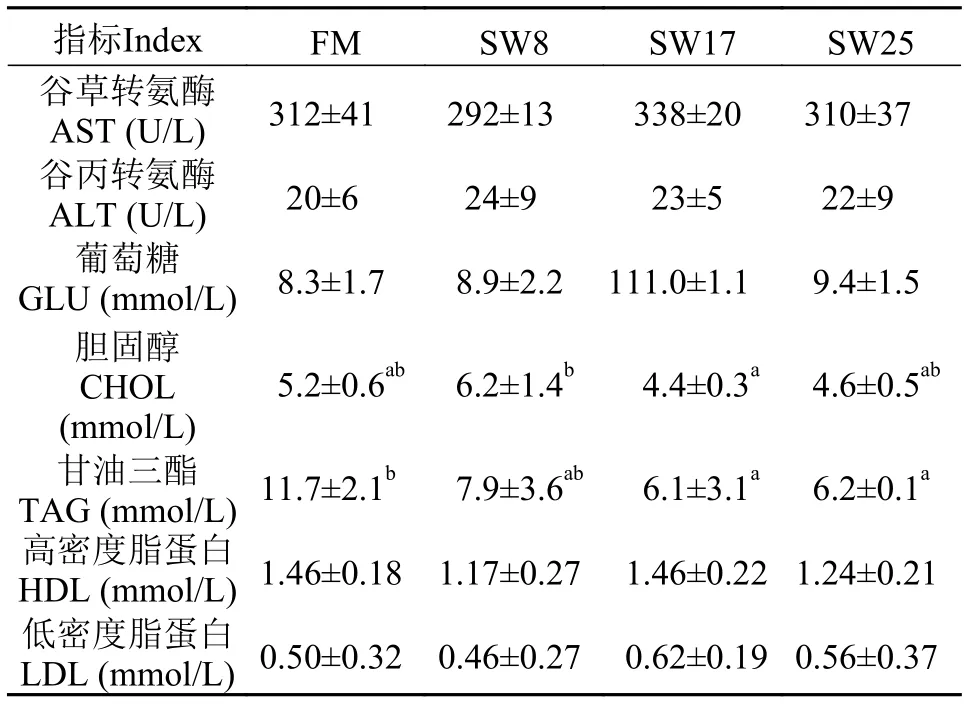
表 4 黃顙魚血清生理指標Tab. 4 Serum physiological indexes of yellow catfish
ATP-結合盒轉運蛋白C4 (ATP Binding Cassette Transporter C4, ABCC4), 也稱多藥耐藥相關蛋白4 (Multidrug resistance-associated protein 4,MRP4), 位于肝細胞基底膜上, 大量動物實驗證明ABCC4對膽汁酸向血液轉移具有重要生理作用[19,20]。在哺乳動物的研究發現, 肝臟ABCC4蛋白表達上調使膽汁酸改道向血液轉移, 最終隨尿液排出體外[21,22]。與BSEP相比, ABCC4與結合膽汁酸親和力更強[23],故ABCC4表達量隨魚溶漿添加量增加而上調,25%魚溶漿影響顯著, 導致了肝胰臟膽汁酸向血液轉移, 血清膽汁酸水平顯著高于魚粉組。
血循環中的膽汁酸可在肝細胞血竇面基底膜上的NTCP介導下被肝細胞所攝取[3], 日糧添加25%的魚溶漿導致肝胰臟膽汁酸向腸道、血液轉移、降低了肝胰臟膽汁酸的含量, 使NTCPmRNA的表達量上調, 促進了膽汁酸的重吸收作用。為了驗證肝胰臟膽汁酸水平的降低是否會促進膽汁酸的從頭合成, 我們分析了膽汁酸合成限速酶[1]——CYP7A1 mRNA的表達水平, 結果發現魚溶漿并不會影響膽汁酸的合成作用。Liaset等[24]發現高牛磺酸的酶解魚漿有降低CYP7A1 mRNA表達量的趨勢, 而膽汁酸的合成量沒有變化。陳文等[16,25]認為牛磺酸僅在有外源膽酸鹽的條件下才會誘導CYP7A1的大量表達, 但其誘導機制尚不清楚。總之, 魚溶漿促進肝胰臟膽汁酸向腸道、血液的分泌, 而膽汁酸的合成能力沒有增強, 當肝胰臟從血液重吸收的膽汁酸不足以彌補自身損失時, 便導致了肝胰臟膽汁酸水平的下降。
3.2 魚溶漿對黃顙魚脂肪沉積代謝的影響
膽固醇、膽汁酸的代謝平衡對魚體健康有重要影響, 高膽固醇會引起脂肪代謝障礙[7,26]; 而膽汁酸可有效乳化脂肪, 促進魚體脂肪的代謝, 減少組織脂肪沉積[8,27]。TAG、CHOL是體內重要的脂類物質, 血清CHOL的增高常伴隨TAG的增高[28]。脂肪組織是體內最大的CHOL儲存池, 而血清CHOL水平反映了脂肪吸收、代謝狀況[29]。血清CHOL過高會引起脂肪代謝障礙, 陳強等[26]發現血清CHOL增加會造成肝臟CHOL的過度積累, 病變肝臟(花肝、土肝、綠肝等)的比例上升。在本研究中, 添加25%的魚溶漿, 黃顙魚血清TAG、CHOL均低于魚粉組, TAG降低顯著, 表明魚溶漿可有效促進脂肪的代謝, 而全魚和肝胰臟的脂肪含量降低,意味著魚溶漿對降低魚體脂肪沉積有顯著影響。前期研究也發現草魚日糧中魚溶漿添加量增加, 血清CHOL、TAG呈降低趨勢[30], 與本研究結果相似。這可能與魚溶漿中牛磺酸含量高有關, 研究表明牛磺酸參與膽汁酸的合成和脂肪的代謝, 促進脂肪的乳化作用和脂類物質(如脂溶性維生素)的消化吸收等, Li等[31]的研究表明牛磺酸可有效降低血清CHOL和TAG水平。
HDL和LDL是CHOL的主要運輸者[32], 分別將CHOL運入和運出肝臟, 血清LDL與CHOL水平正相關[28], 草魚日糧中添加6%的魚溶漿使血清HDL升高而LDL降低, 但未出現顯著變化[30], 在本試驗中HDL和LDL無顯著變化, 表明25%的魚溶漿對血清HDL和LDL影響不顯著。
4 結論
無魚粉日糧中添加25% 魚溶漿(干物質), 對黃顙魚膽汁酸的合成沒有顯著影響, 但促進了膽汁酸從肝胰臟向血液、腸道中轉移; 牛磺酸可能是引起膽汁酸代謝變化的主要因素之一; 魚溶漿促進了魚體脂肪的能量代謝作用, 降低全魚、肝胰臟脂肪沉積量。

