基于膠原蛋白的干細胞3D打印研究進展
倪添雨,張雅潔,劉 敏,裴仁軍
(中國科學院蘇州納米技術與納米仿生研究所,江蘇 蘇州 215123)
1 前 言
隨著醫(yī)療手段的進步,器官移植和修復技術得到了極大的發(fā)展,器官移植也已成為終末期器官疾病的主要治療手段。但由于目前供體器官極度短缺,器官移植很受限制。近年來,組織工程技術飛速發(fā)展,人們已經可以在體外培養(yǎng)各種仿生組織或器官以供器官移植,比如已經有了應用組織工程制造的胃、骨、皮膚、脊髓、食道等。但傳統(tǒng)的人造器官或仿生支架無生理活性,還存在諸多不足,譬如:支架技術的空間分辨率限制了細胞滲透到支架材料內部的速度,細胞不能均勻貫穿整個支架;無法精確地將不同種類的細胞按照人體組織器官的結構準確定位,不能形成類似于天然組織器官的三維結構;直接使用支架接種細胞可能會導致血管化的缺失、供氧不足、容易引起組織或器官的壞死等[1]。
直至2003年,Mironov等[2]基于生物自組裝原理提出“細胞打印”的設想。細胞打印技術能夠將細胞、生長因子和支架結合在一起形成一個完整的整體結構,且各種類型的細胞能夠按照正常的解剖結構準確定位,通過細胞、生長因子和支架等之間的相互作用,行使正常的生物學功能(見圖1[3])。細胞打印技術發(fā)展至今,已經有了相對成熟的3種方式,分別是:擠出成型打印、噴墨打印和激光輔助打印[4],3者中擠出成型打印方法簡單、價格低廉,是目前使用最廣泛的細胞打印方式。擠出成型打印是指以受控方式迫使生物材料通過噴嘴噴射含有細胞的連續(xù)長絲以構造3D結構的技術[5]。其中,生物材料通常指水凝膠,利用其高含水量、優(yōu)良的生物相容性和溫和的凝膠條件,促進細胞封裝,把不利于細胞活性的影響降至最低[6,7]。目前最常用的水凝膠材料有聚乙二醇(PEG)、海藻酸鹽、殼聚糖、透明質酸和膠原蛋白等。其中,膠原蛋白是一種廣泛存在于人體組織內的蛋白質,具有接近正常組織表面的生理生化特性和優(yōu)良的生物可降解性,是一種優(yōu)良的組織工程材料[8]。
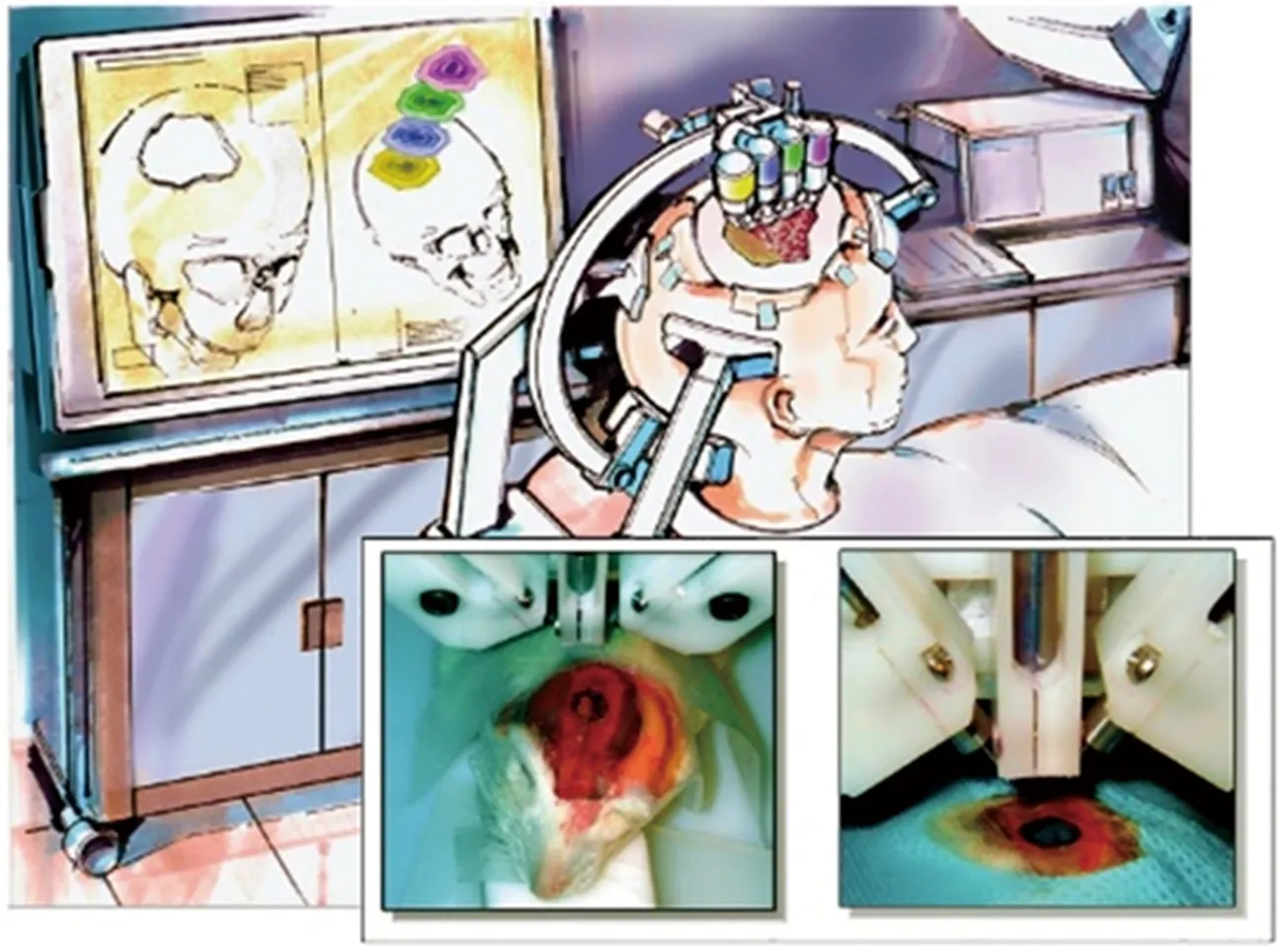
圖1 在大鼠顱骨缺損處用噴墨打印纖維蛋白原、凝血酶和顯像染料驗證原位生物打印的可行性[3]Fig.1 Conceptual vision of in-situ bioprinting,with feasibility demonstrated by inkjet printing fibrinogen,thrombin and visualization dye into a rat calvarial defect[3]
而在細胞的選擇上,干細胞相較于分化完全的功能細胞有著明顯的優(yōu)勢。干細胞具有長期的自我更新能力和廣泛的分化潛能,理論上可以提供無限數(shù)量的細胞[9]。干細胞來源廣,在適當?shù)恼T導下能進行定向分化,能更好地促進器官修復與再生。因此,干細胞3D打印被認為是組織工程中最有潛力的技術。
2 干細胞3D共打印
正常的生理組織具有自我更新和修復能力,參與修復更新的主要是組織特異性干細胞,如造血干細胞、表皮干細胞、神經干細胞等。隨著干細胞技術的不斷發(fā)展,干細胞分離、培養(yǎng)、移植等方面都取得了突破性的進展,并越來越多地應用于臨床治療中。至2016年底,全球已有13種干細胞治療藥物獲批上市,可用于治療急性心肌梗死、退行性關節(jié)炎、赫爾勒綜合征等疾病[10]。
在干細胞治療中,最有治療潛力的細胞是多能干細胞(PSCs),包括胚胎干細胞(ESCs)和誘導多能干細胞(iPSCs)[9]。但ESCs的臨床應用受到倫理限制,iPSCs的臨床應用受到安全性(尤指致瘤風險)、臨床療效及成本等限制,所以目前干細胞治療以成體干細胞治療為主[10]。成體干細胞治療根據部位的不同,可以選用間充質干細胞(MSCs)及神經干細胞(NSCs)等。表1列舉了常見的干細胞、支架材料及其應用。
傳統(tǒng)的細胞支架是在已成型的支架中種植細胞,體外培養(yǎng)后再植入體內,這種方式難免會遇到諸多組織移植的問題,如支架技術的空間分辨率低、細胞不能滲透到支架內部、血管化的缺失導致組織供養(yǎng)不足及壞死等。而干細胞的狀態(tài)及行為與其生存的微環(huán)境密切相關,支架材料的硬度、表面特征、孔隙結構、降解性等對干細胞的活性和功能也有一定的影響,同時,材料的化學組成會影響細胞的粘附、遷移、增殖和后續(xù)組織的形成[30]。良好的支架材料應該既能為細胞提供增殖和分泌基質的微環(huán)境,又能維持細胞表型以及功能的表達。因此,選用細胞包埋水凝膠比傳統(tǒng)支架形成后種植細胞有更多優(yōu)點,包括能更好地注入細胞和控制細胞分布等[31]。

表1 水凝膠封裝干細胞的應用舉例Table 1 Examples of stem cells encapsulated by hydrogel
Notes:CPCs:Cardiac progenitor cells;PCL:Polycaprolactone;PAM:Polyacrylamide;PU:Polyurethane;PEG:Polyethylene glycol;PLGA:Poly(lactic-co-glycolic acid)
3 膠原蛋白及其細胞支架
膠原蛋白是人體中分布最廣泛的蛋白質,大約占蛋白質總量的30%[32],在脊椎動物中已經發(fā)現(xiàn)了28種不同的膠原蛋白,類膠原蛋白的種類更加豐富[33]。膠原蛋白分子存在獨特的功能域,是由3條左旋且平行的α鏈形成的三螺旋結構。甘氨酸在三螺旋結構中有至關重要的地位,因為它是最小的氨基酸,能被三螺旋結構緊密包裹在內部[34];此外,該結構中還存在許多垂直于螺旋軸的氫鍵,將肽鏈緊密地連接在一起,使三螺旋結構更加穩(wěn)定[35]。
膠原蛋白作為一種天然生物大分子材料,來源廣泛且與人體多數(shù)組織的生理性質相近,已被廣泛地應用于組織工程中,尤其是血管[36]和骨組織[37]修復。并且膠原蛋白中含有的精氨酸-甘氨酸-天冬氨酸(RGD)序列可以與干細胞相互作用,制成的3D膠原支架可以增加細胞的粘附、增殖和分化[38],同時,膠原支架的降解成分在新組織形成過程中可以被細胞重復利用,十分有利于促進組織修復[39]。但單純的膠原蛋白用于組織支架制備,存在難于塑形、缺乏一定的力學性能、在生物體內降解過快等問題。為了滿足組織修復中的復雜需求,膠原蛋白通常與其他高分子材料復合,制造出功能各異的細胞支架。
在膠原蛋白中添加其他天然的高分子材料可以發(fā)揮它們不同的理化性質,優(yōu)勢互補,能更好地促進細胞粘附、生長和增殖。Madhavan等[36]在膠原凝膠中加入彈性蛋白及殼聚糖,其拉升率和極限應力明顯提高。Buttafoco等[40]將膠原蛋白和彈性蛋白以1∶1的比例共混電紡,制備出的纖維膜支架能很好地支持血管平滑肌細胞生長及增殖。同樣地,膠原蛋白復合絲素蛋白[41]、透明質酸[42]等天然高分子材料后,力學性能都有明顯提升。
雖然天然高分子的生物相容性好,但其機械性能、降解速率等還不能媲美許多人工合成的高分子材料,所以研究者們也使用膠原蛋白與人工合成高分子復合,以制備性能優(yōu)良的組織工程支架。其中常用于與膠原蛋白復合的人工合成高分子材料有聚己內酯(PCL)、聚對二氧雜環(huán)己酮(PDO)和聚乳酸-羥基乙酸共聚物(PLGA)等。膠原蛋白與PCL共混后電紡制備的支架力學強度高、能在體內保持穩(wěn)定結構,有望成為傳統(tǒng)人工血管的代替物[43]。PDO與其他材料相比,具有形狀記憶功能、力學性能理想、抗原性低和降解速率慢等特性,與膠原蛋白共混后進行電紡得到的支架,可以模擬血管微環(huán)境的力學和形態(tài)學性能[44]。膠原蛋白復合PLGA制備的支架能促進內皮細胞的粘附及延伸,并保持細胞表型[43]。
膠原蛋白支架發(fā)展至今,已有許多機械強度、降解速度、細胞親和力都有很好改善的仿生支架面市。總而言之,現(xiàn)有的膠原仿生支架大多是通過交聯(lián)、側鏈引入等方法將膠原蛋白與其他材料復合制備的,而在支架制備工藝上使用較多的是經典的靜電紡絲法、冷凍干燥法、氣體發(fā)泡法和致孔劑制孔法等。然而,這些方法制備的支架存在孔徑大小和空間分布難以控制等不足[45],無法為細胞提供最佳的生存空間。基于膠原蛋白利用3D打印技術構建細胞3D打印一體化策略,一方面利用3D打印技術實現(xiàn)快速、精確、可控地構造仿生組織替代物,另一方面利用膠原蛋白的特性為細胞提供良好的微環(huán)境,提高細胞的存活率和增殖率。
4 基于膠原蛋白的干細胞3D打印
4.1 物理凝膠法
物理交聯(lián)水凝膠主要是通過高分子鏈間的纏結或者非化學鍵(如氫鍵和親/疏水相互作用等)形成,具有動態(tài)特征,可以實現(xiàn)溶液-凝膠的可逆變化。常見的物理凝膠方法有熱誘導的鏈纏結、分子自組裝等[46]。
4.1.1 熱誘導的鏈纏結致凝膠化
許多聚合物的凝膠化是由熱驅動的過程,它們對溫度升高或降低響應的直接表現(xiàn)為溶解度的改變,實際是親水和疏水鏈段比率的改變,所以又被稱為具有“溫敏性”。根據轉變行為的不同,分別定義為低臨界溶解溫度(LCST)和高臨界溶解溫度(UCST)[46]。
在干細胞3D打印中,這種具有溫敏性的可注射水凝膠是研究熱點。Tan等[47]使用PLGA封裝細胞形成多孔微球,再混合膠原蛋白/瓊脂溶液,利用微管擠壓法在冷平臺上打印,可立即形成復合水凝膠。37 ℃孵育24 h,水凝膠中形成膠原纖維,為細胞提供更好的附著(如圖2)。Wang等[48]將人MSCs封裝進一種由Ⅰ型膠原蛋白、硫酸軟骨素和一種復雜聚合物組成的復合水凝膠,其中的復雜聚合物是N-異丙基丙烯酰胺、丙烯酸、丙烯酰氧基琥珀酰亞胺、聚(環(huán)丙烷碳酸鹽)甲基丙烯酸羥乙基酯的嵌段共聚物,在室溫附近顯示出具有LCST的相變行為。該水凝膠需要在4 ℃下注射成型,能夠在37 ℃的環(huán)境中于6 s內發(fā)生凝膠化。這種復合型水凝膠具有與人類心肌相匹配的模量和柔性、良好的可注射性、透氧性、力學性能和可降解性,可用作心血管組織工程中生長因子和細胞的載體。Song等[49]將人源脂肪間充質干細胞(ADSCs)與殼聚糖/β-甘油磷酸鹽/膠原蛋白混合,37 ℃下很快形成凝膠。殼聚糖/β-甘油磷酸鹽是一種溫敏型水凝膠,膠原蛋白的參與可以促進細胞增殖,維持細胞形態(tài)和細胞活性。這種新型水凝膠具有良好的組織相容性,為ADSCs的生長提供了良好的三維微環(huán)境。
熱誘導的鏈纏結致凝膠化方法,不利用其它誘導條件,如pH調節(jié)、誘導劑、UV光等,僅通過溫度控制膠原復合水凝膠快速成型,凝膠中的干細胞和生長因子的生物活性可以得到很好的保存,在干細胞3D打印中有著很好的應用前景。
4.1.2 自組裝致凝膠化
非化學鍵分子自組裝是一種重要的凝膠化機理,在蛋白質水凝膠中尤為常見。自組裝的定義是在沒有外部的干預下,分子鏈在至少一個維度上自發(fā)形成新的有序結構。弱非共價鍵,包括氫鍵、范德華力和疏水相互作用,能使大分子折疊成具有明確定義的結構和功能構象。膠原蛋白的分層自組裝依賴于其氨基酸排列,由三螺旋結構進一步促成膠原微纖維,最終形成膠原水凝膠[46]。
膠原蛋白水凝膠在成分和結構上與天然細胞外基質相似,且對成骨分化有著促進作用,被廣泛用于三維基質以支持骨髓間充質干細胞(BMSCs)的增殖和分化。Zhang等[50]提取小牛皮膚的膠原蛋白,在中性條件下與新生兔BMSCs混合注入模具,30 min實現(xiàn)凝膠化。結果表明在無任何生長因子添加的條件下,膠原水凝膠對BMSCs仍具有固有的成軟骨分化誘導性,對臨床軟骨再生有極大幫助。
除了直接將干細胞封裝在水凝膠中,研究者們還提出了使用納米微球封裝干細胞的概念,與水凝膠一起使用可以增加細胞橋接作用。DeVolder等[51]通過在凝膠內摻入可水解的PLGA微粒來調節(jié)膠原蛋白凝膠的機械性能。一定直徑的PLGA微球能刺激膠原原纖維的物理締合作用,顯著改變凝膠的彈性和硬度,同時對凝膠的抗?jié)B透性影響很小。Chen等[52]使用水包油包水雙乳液溶劑蒸發(fā)法制備3-羥基丁酸酯和3-羥基戊酸酯的共聚物(PHBV)微球,將小鼠神經前體細胞(NPCs)接種在PHBV微球上,再將含有細胞的微球、層粘連蛋白、神經生長因子(NGF)等封裝入膠原蛋白中,37 ℃下孵育2 h以形成水凝膠,這種水凝膠通過更緊密的包裝以及將細胞接種到凝膠空間中可進一步促進基質材料與細胞橋接。
4.2 離子作用凝膠法
海藻酸鹽是從褐藻中提取的一種無規(guī)嵌段共聚物,其水溶液在許多二價金屬陽離子(如Ca2+、Zn2+等)的作用下會發(fā)生分子鏈和離子的螯合作用,使海藻酸鹽分子鏈形成螺旋狀結構并成對地包裹和環(huán)繞在陽離子周圍。由于海藻酸鹽溶膠-凝膠轉變過程條件溫和,其本身對細胞沒有明顯的負面作用,且在需要的時候可發(fā)生可逆轉變,因而被廣泛用于細胞封裝。
海藻酸鹽可以很好地與膠原蛋白復合成細胞載體,在干細胞打印中有很好的應用前景。Nguyen等[53]利用海藻酸鹽和Ca2+的交聯(lián)作用,用膠原蛋白/海藻酸鹽封裝人MSCs和人臍靜脈內皮細胞(HUVECs),擠出至培養(yǎng)基中孵育,交聯(lián)成型后分別進行了動態(tài)培養(yǎng)和靜態(tài)培養(yǎng),證明了膠原蛋白在促進成骨和血管生成方面有獨特功能。
隨著生物3D打印技術的不斷進步,研究者們越來越不滿足于單一結構的打印方式,其中最典型的是利用海藻酸鹽和膠原蛋白復合的核-殼打印方式。Olmos等[54]設計了用于細胞包封的大鼠Ⅰ型膠原蛋白/海藻酸鹽核-殼結構水凝膠,他們用同心雙噴嘴同時噴射注有大鼠BMSCs的膠原蛋白溶液的核和含海藻酸鹽溶液的殼,在氯化鈣離子浴中制備雙層水凝膠結構,以獲得纖維結構的支架。該研究在殼結構中加載生物活性分子,比如藥物、生長因子或是基因等,在細胞靶向治療和組織工程應用中具有極好的前景。Perez等[55]也使用了膠原蛋白/海藻酸鹽的核-殼結構封裝兔MSCs,裝載有MSCs的膠原溶液作為核,海藻酸鹽溶液作為殼,通過鈣離子交聯(lián)成型,再進一步孵育用于骨組織工程的細胞培養(yǎng)。這種生物墨水可由生物3D打印機模塑成任何確定的形狀,其本身也可保持連續(xù)的纖維結構。Yeo等[56]通過計算機控制的三軸打印系統(tǒng)打印了多層的載有細胞的網狀結構。他們使用Ⅰ型豬腱膠原蛋白混合人ADSCs作核結構,以純海藻酸鹽作為殼結構,使用氯化鈣溶液進行氣溶膠處理以暫時交聯(lián)殼層中的海藻酸鹽部分,使得載有細胞的膠原組分可以穩(wěn)定地保留在圓柱形核-殼的核心區(qū)域中。此復合型水凝膠在成肝誘導分化培養(yǎng)基誘導后,表現(xiàn)出高水平的肝特異性基因表達,說明使用這種組合工藝制造的載有細胞的核-殼結構,可能具有作為用于組織再生的細胞負載結構的顯著潛力。
單純的海藻酸鹽水凝膠存在細胞附著點少、交聯(lián)后收縮、降解性差等缺點,即使經較長期的培養(yǎng),海藻酸鹽與細胞構建體仍缺乏如膠原原纖維和蛋白多糖類的連續(xù)網絡,這對于組織工程支架的應用是不利的。而海藻酸鹽復合膠原蛋白水凝膠結合了兩者的優(yōu)勢,有著良好的生物相容性、廣泛的來源和較強的可塑性等特點,尤其是在二價陽離子中交聯(lián)速度極快、可在細胞存活的條件下成膠,呈現(xiàn)出“1+1>2”的效應。
4.3 共價作用凝膠法
化學交聯(lián)水凝膠則是通過高分子鏈間的共價鍵交聯(lián)形成,與物理交聯(lián)水凝膠相比,化學交聯(lián)在穩(wěn)定水凝膠基質方面表現(xiàn)更好。研究者們也已經設計了多種生物相容的化學反應用于在基質內細胞存在的條件下直接形成水凝膠[46]。
4.3.1 光引發(fā)致凝膠化
某些化合物在特定波長光的照射下會產生活性中心,從而引發(fā)聚合反應,在空間中聯(lián)結成交聯(lián)網絡進而形成水凝膠,比較典型的有核黃素和甲基丙烯酸修飾的大分子等。
核黃素又被稱為維生素B2,在堿性條件下易被破壞。核黃素誘導的膠原蛋白光交聯(lián)是一種非細胞毒性的交聯(lián)方式,能強化水凝膠的機械性能。Koh等[57]研發(fā)了一種核黃素誘導的光交聯(lián)膠原蛋白/透明質酸水凝膠,紫外光照射3 min即可使凝膠成型。用這種水凝膠包封扁桃體衍生的間充質干細胞(T-MSCs),代替?zhèn)鹘y(tǒng)的BMSCs應用于半月板組織工程,能刺激纖維軟骨相關的基因表達,也能一定程度上解決同種異體移植的問題。Choi等[58]將甲基丙基酸修飾到殼聚糖上,混合雞胸骨Ⅱ型膠原蛋白和MSCs,并以核黃素作為光引發(fā)交聯(lián)劑,暴露于可見藍光(VBL)下幾十秒之后形成水凝膠。其中摻入的轉化生長因子-β1(TGF-β1)進一步增強了MSCs的成軟骨分化能力。實驗結果表明,皮下植入該水凝膠干細胞共混培養(yǎng)物后,顯示出很高的軟骨修復潛力。
甲基丙烯酸酯基團中含有共軛雙鍵,用其修飾的蛋白在紫外光的照射下易轉變?yōu)榧ぐl(fā)態(tài),產生活性中心從而引起光化學反應。Yang等[59]利用膠原蛋白上的賴氨酸與甲基丙烯酸酐上的ε-氨基發(fā)生酰胺化反應合成Ⅱ型膠原甲基丙烯酰胺,使膠原能夠實現(xiàn)光交聯(lián)。實驗結果表明,功能化修飾不僅保護了膠原蛋白的天然三螺旋構象,而且賦予其光交聯(lián)能力,可用于有明確定義的復雜組織結構的精細加工,為3D細胞打印提供了一種理想的生物墨水材料。Gaudet等[60]用甲基丙烯酸酯功能化修飾膠原蛋白,這種合成反應可以保留膠原蛋白的基本性質,并使其在波長為365 nm的紫外光照射下發(fā)生凝膠化,且儲能模量比修飾前增加5倍,其封裝的人源MSCs也能很好地存活。Du等[61]將帶有膠原結合域的骨形態(tài)發(fā)生蛋白2(CBD-BMP2)微纖維、BMSCs以及甲基丙烯酰胺修飾的明膠共混液,3D打印出一定形貌后以光引發(fā)劑I2959作交聯(lián)劑紫外光照射1~5 min可發(fā)生凝膠化,結果表明該膠原微纖維可以更安全有效地誘導BMSCs分化為成骨細胞。
PEG是公認的一種良好的生物材料,在一定條件下能形成水凝膠,此外還可對四臂聚乙二醇(4arm-PEG)進行進一步的化學修飾,從而構成性能更優(yōu)的水凝膠。Collin等[62]設計了一種由四臂-琥珀酰亞胺基戊二酸酯醚-聚乙二醇(4S-StarPEG)交聯(lián)的Ⅱ型去端肽膠原蛋白/透明質酸的可注射水凝膠,用于封裝NPCs和ADSCs,在37 ℃下約8 min可以發(fā)生凝膠化,該水凝膠系統(tǒng)在培養(yǎng)基中保持形狀穩(wěn)定并且具有支持細胞生長的能力。因牙髓干細胞(DPSCs)可以分化成軟骨細胞,Yao等[63]使用Ⅰ型和Ⅱ型膠原蛋白和4S-StarPEG交聯(lián)形成水凝膠,包封在Ⅰ型和Ⅱ型膠原水凝膠中的DPSCs和DPSCs衍生的軟骨細胞在水凝膠中仍保持較高的活動性,可以移植到退化的椎間盤中以修復受損組織。Amer等[64]用降冰片烯修飾4arm-PEG,這種PEG可以與雙半胱氨酸交聯(lián)劑(CVPLSLYSGC)在紫外光照射下發(fā)生交聯(lián)。他們將其和人ESCs衍生的胰腺祖細胞包埋進大鼠尾Ⅰ型膠原蛋白,37 ℃下UV照射6 min發(fā)生凝膠化,這種水凝膠可以維持細胞活性并誘導細胞向胰腺分化。Chen等[65]將雙鍵修飾的結冷膠和Ⅰ型膠原與干細胞混合,構建負載干細胞的水凝膠,通過光/離子雙重交聯(lián)可以顯著提高水凝膠的固化速度以及機械性能,并用于血管形成研究(見圖2)。
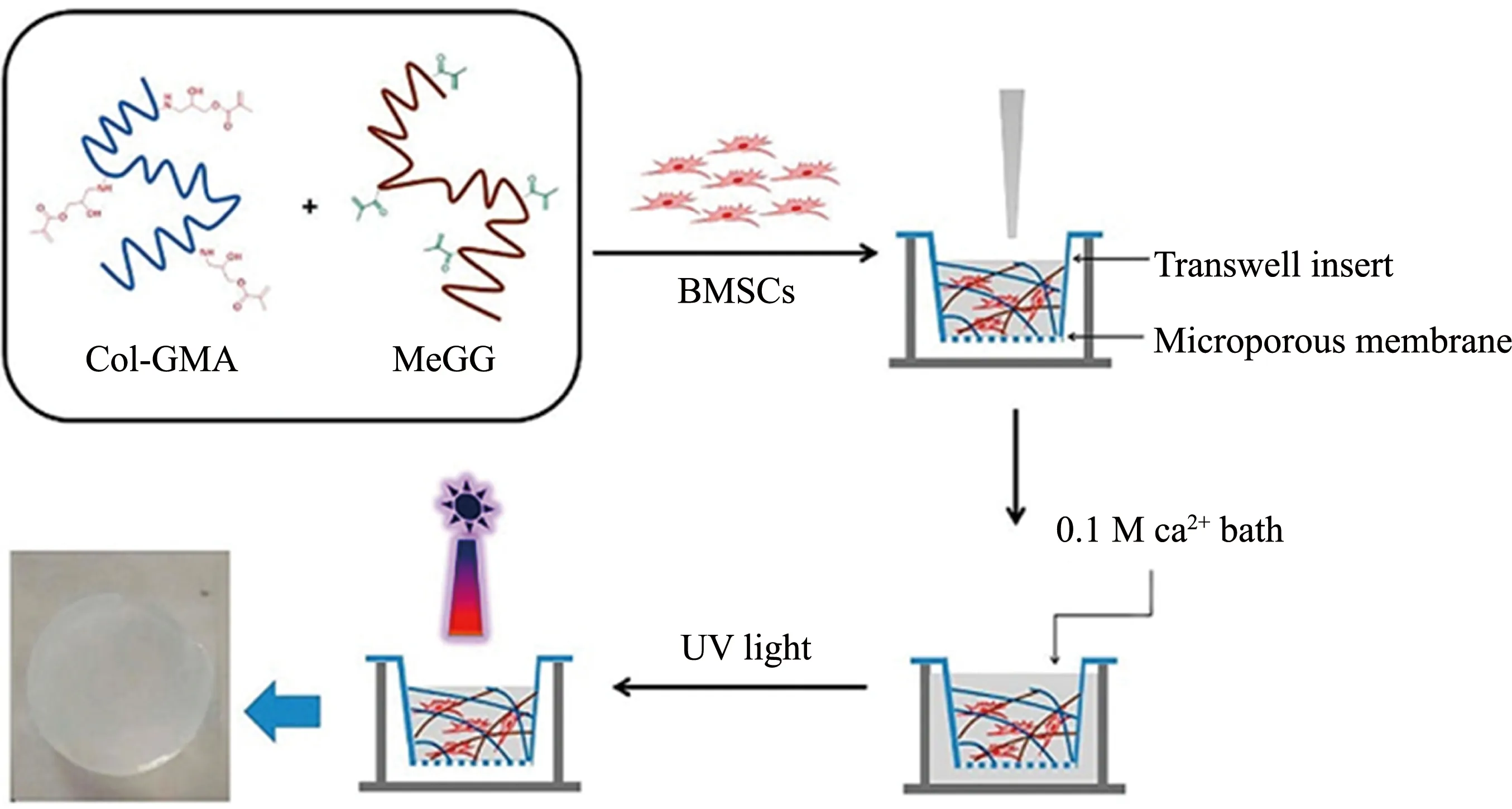
圖2 包封BMSCs的膠原蛋白/結冷膠水凝膠的制備[65]Fig.2 Preparation of BMSCs-encapsulating methacrylated gellan gum/collagen hydrogel[65]
4.3.2 點擊化學致凝膠化
研究者還設計了多種生物相容的點擊反應用于在基質內細胞存在下直接形成水凝膠[66],如炔烴和疊氮化物之間的Huisgen 1,3-偶極環(huán)加成,該反應在銅(Ⅰ)催化下溫和且高效,在許多情況下既不需要保護基也不需要純化步驟。該反應中的疊氮基和炔基與生物分子的反應可忽略不計,在水性環(huán)境中具有良好的穩(wěn)定性,可用于靶向引導合成和基于活性的蛋白質分析[67]。為了避免銅(Ⅰ)引入的細胞毒性,研究者們也開發(fā)了無銅(Ⅰ)催化的[3+2]疊氮-炔烴環(huán)加成法[68]、烯烴-硫醇產生穩(wěn)定硫醚鍵的點擊反應、2-氰基苯并噻唑(CBT)與巰基點擊反應[69]等,大大提高了生物3D打印應用范圍。Xu等[70]開發(fā)了一種硫醇化的膠原與丙烯酸酯共聚物組成的可注射水凝膠,用于包封BMSCs,利用巰基與碳碳雙鍵的Michael加成反應,實現(xiàn)生理條件下(37 ℃、pH 7.4)的快速凝膠化,最快可在0.4 min內成膠,儲能模量最大可達55.6 kPa。大鼠的心肌梗塞實驗也證明,該水凝膠能對心臟的功能性再生有積極作用。Lee等[71]利用疊氮化物-炔烴環(huán)加成反應成功實現(xiàn)了將生長因子固定在膠原蛋白表面。利用這種思路可以把一些特異性基團引入膠原分子,使膠原高效、定向發(fā)生凝膠化,這在干細胞3D打印中有廣泛的應用前景。
4.3.3 酶促凝膠化
用酶和相應底物反應,使蛋白質或多肽鏈發(fā)生共價交聯(lián)形成分子內或分子間的交聯(lián)網狀結構,比單純使用化學交聯(lián)劑要更加綠色,也減少了細胞毒性。Kuo等[72]從小鼠表皮提取膠原蛋白,對其進行酪胺化修飾,并與內皮集落形成細胞(ECFCs)、MSCs、過氧化氫和辣根過氧化氫酶共混,37 ℃下可以在10 min凝成膠原蛋白水凝膠。經過模擬細胞外基質條件和小鼠體內條件培養(yǎng)實驗,證明了可注射和酶促交聯(lián)的膠原-酚羥基水凝膠適用于支持人類祖細胞形成體外和體內3D血管網絡。Mitra等[73]發(fā)現(xiàn)利用賴氨酰氧化酶介導膠原交聯(lián)可以調節(jié)膠原水凝膠的機械性能并調節(jié)MSCs向成骨分化的表型,能很好地改善成骨移植的特性。
4.3.4 醛基縮合致凝膠化
在一定的溫度下,有相互作用的基團會發(fā)生反應,進而使分子交聯(lián)成凝膠網絡,經典的有羥醛縮合和醛醛縮合等。Wise等[74,75]用膠原蛋白/殼聚糖水凝膠封裝MSCs,利用β-磷酸甘油酯和乙二醛的交聯(lián)作用,在37 ℃下使用“油包水”的方法制造含有細胞的微珠。微珠水凝膠包封干細胞的形式為藥物遞送和組織修復提供了一定的方便性,在骨移植組織工程中有一定程度的應用。Wang等[76]用水油乳化法制備殼聚糖/膠原蛋白復合微珠,簡而言之就是將殼聚糖、牛型Ⅰ型膠原蛋白、β-磷酸甘油酯、乙二醛和MSCs按照一定比例混合,在冰水浴中預冷,葉輪攪拌后獲得均勻的水油乳劑,再將溶液溫度提高到37 ℃,一段時間后形成凝膠。其中乙二醛和β-磷酸甘油酯作為物理和化學交聯(lián)劑,為基質材料提供共聚合作用。Wang等[77]的另一篇文章指出,β-磷酸甘油酯引發(fā)的殼聚糖/膠原蛋白水凝膠比純膠原或純殼聚糖凝膠的機械性能更高,但β-磷酸甘油酯的存在會使人BMSCs的代謝活性降低。
5 結 語
傳統(tǒng)的2D培養(yǎng)已經無法滿足干細胞的發(fā)展需求,且存在很多缺陷,3D干細胞培養(yǎng)倍受重視和推廣。尤其是干細胞3D打印技術摒棄了傳統(tǒng)的批量化生產的模式,可以根據患者需求量體裁衣,制備個性化的植入物,從而實現(xiàn)對受損部位的修復,這些優(yōu)勢特點在組織器官重建領域的價值被寄予厚望。但是,由于干細胞3D打印的條件嚴格,要求材料兼顧細胞活性、無毒無害、快速凝膠等,適合的材料十分有限。
膠原蛋白作為細胞分泌的細胞外基質的主要成分之一,具有優(yōu)良的生物相容性、可降解性和弱抗原性等特征,用作干細胞3D打印材料有著巨大的優(yōu)勢。許多研究者通過物理、化學交聯(lián)復合其它材料等方法來制備膠原支架。物理凝膠方法不用添加額外的物質,綠色環(huán)保。但物理凝膠法與大分子的自身性質密切相關,可以實現(xiàn)溶液-凝膠的可逆變化,穩(wěn)定性不夠。與物理凝膠方法相比,化學凝膠法處理材料的交聯(lián)程度更高、時空精確度更高,能顯著提高膠原蛋白水凝膠的使用性能。但是化學交聯(lián)過程中可能會引入外源性物質,這些物質經過化學反應或者細胞作用分解成其他小分子,致使材料具有細胞毒性,還需謹慎使用。
隨著干細胞3D打印技術的快速發(fā)展,解決干細胞3D打印生物材料問題是助力干細胞3D打印臨床應用的關鍵,進而為將來真正實現(xiàn)器官打印提供強有力的支持,為解決器官供體短缺問題開辟出新的路徑。

