納米活性材料在間充質干細胞治療中的應用
張 然,羅文亞,朱明盛,吳 瑾,黃興祿,孔德領,2
(1.南開大學生命科學學院 生物活性材料教育部重點實驗室,天津 300071)(2.南開大學 徐榮祥再生生命科學中心,天津 300071)
1 干細胞治療及納米生物活性材料
干細胞是一類具有增殖和分化潛能的細胞,即具有自我更新復制新生命體的潛力。研究證實,干細胞可以修復、替代受損和死亡的細胞,激活處于休眠和靜默狀態的細胞。干細胞旁分泌各種促細胞生長因子、抑炎因子、抗凋亡因子等,參與和誘導多種免疫調控機制,促進細胞與細胞間、細胞與細胞基質間信號的傳導[1]。因此,干細胞作為種子細胞,在疾病治療中體現出重要的臨床應用價值和前景。
盡管干細胞在疾病治療中具有顯著的優勢和重要的地位,但其在實際應用中仍然存在很多問題。首先是安全性,在干細胞培養過程中添加物如動物血清、胰酶等可能會對人體造成危害,細菌、支原體等外源致病因子的污染會增加質控難度。其次是移植有效性,目前較難提取高純度的干細胞,同時,干細胞移植后的存活率較低。所以,干細胞與生物材料在疾病治療中的聯合應用就應運而生了。目前常用的生物材料有微納米材料、水凝膠及生物膜仿生材料等。
其中納米材料因其獨特的理化性質在調控干細胞行為方面起著越來越重要的作用,包括示蹤干細胞在體內的命運和分布、誘導干細胞定向分化、促進干細胞疾病“歸巢”、刺激干細胞旁分泌行為和調控干細胞周圍組織微環境等。在干細胞治療方面,納米生物活性材料是一類本身具有生物活性或通過修飾、包覆等手段額外地附加功能性活性分子的材料,可主動調控干細胞增殖、分化或遷移等,也可輔助干細胞協同促進干細胞發揮在疾病治療上的作用,成為了近幾年的熱點話題之一。本文將重點綜述這類納米生物活性材料在調控干細胞治療方面新的研究進展。
2 干細胞分類及間充質干細胞特性
目前細胞治療中主要用到的干細胞分為3類,包括胚胎干細胞、成體干細胞和誘導多功能干細胞。其中,胚胎干細胞是早期胚胎(原腸胚期之前)或原始性腺中分離出來的一類細胞,它具有體外培養無限增殖、自我更新和多向分化的特性。成體干細胞包括間充質干細胞、神經干細胞、血液干細胞和表皮干細胞等,可取自動物體的骨髓、脂肪、上皮、血液等多種部位。誘導多功能干細胞是通過導入外源基因使體細胞去分化得到的一類多能干細胞,具有多向分化潛能,在體內可以分化為3個胚層來源的所有細胞,在體外可誘導分化成多種細胞,如表皮樣干細胞[2]、晶狀體上皮細胞[3]、心肌細胞[4]等。間充質干細胞(mesenchymal stem cells,MSCs)因其來源豐富、易于獲取、可多向分化為多種下游功能細胞,被作為目前細胞治療中應用最廣泛的種子細胞。
間充質干細胞的來源比較廣泛,主要包括脂肪、骨髓、臍帶和臍帶血等,在細胞治療應用方面具有多種優勢:① 強大的增殖能力,其具有高的端粒酶活性,一定程度上可無限自我復制;② 低免疫原性,因細胞可從同源/同體生物體獲取,不易被機體免疫系統識別,所以間充質干細胞移植后不會發生免疫排斥反應;③ 多向分化潛能,可向下游多種功能細胞分化,包括脂肪細胞、成骨細胞、軟骨細胞等[5];④ 歸巢作用,鑒于損傷炎癥部位會分泌一些細胞因子或炎性因子等,其濃度向周圍環境呈現梯度性分布,故間充質干細胞移植后可主動趨向這些因子,向炎癥部位歸巢從而發揮治療作用,這也是細胞遷移、植入組織并發揮功能和保護作用的重要步驟;⑤ 倫理學問題,自體來源的間充質干細胞不存在類似胚胎干細胞在來源等方面的倫理學問題。而且,越來越多的研究表明,間充質干細胞除了極少數可通過歸巢至損傷部位修復組織外,其主要是通過旁分泌功能發揮其治療作用。因此,間充質干細胞自身或受到疾病部位微環境調控時,能夠產生一系列不同的細胞因子,包括促血管生成因子(VEGF、PDGF、Ang-1、bFGF)、免疫調節因子(IL-10、HGF、TGFb)、促細胞新生因子(EGF、IGF)、抗細胞凋亡因子(Bcl-2)等[6,7],如圖1所示。

圖1 間充質干細胞分泌的多種具有不同功能的生長因子Fig.1 Various growth factors secreted by mesenchymal stem cells with different functions
基于以上特性,間充質干細胞已被廣泛用于帕金森綜合癥[8]、阿爾茨海默癥[9]、心血管疾病[10]、肌肉退行性疾病[11]等多種疾病的治療。經過近年來的發展,其越來越多的應用已走向臨床試驗。如2011年12月中國人民解放軍第105醫院神經內科的汪青松等對臍帶間充質干細胞移植治療腦梗死和帕金森綜合癥的療效和安全性進行了臨床研究,目前正處于II期臨床試驗階段[12]。2012年3月中國人民武裝警察部隊總醫院的安沂華等就臍帶間充質干細胞股動脈介入移植治療脊髓損傷的安全性和有效性開展臨床試驗,目前正處于II期臨床試驗階段[13]。間充質干細胞部分臨床試驗可參見表1。
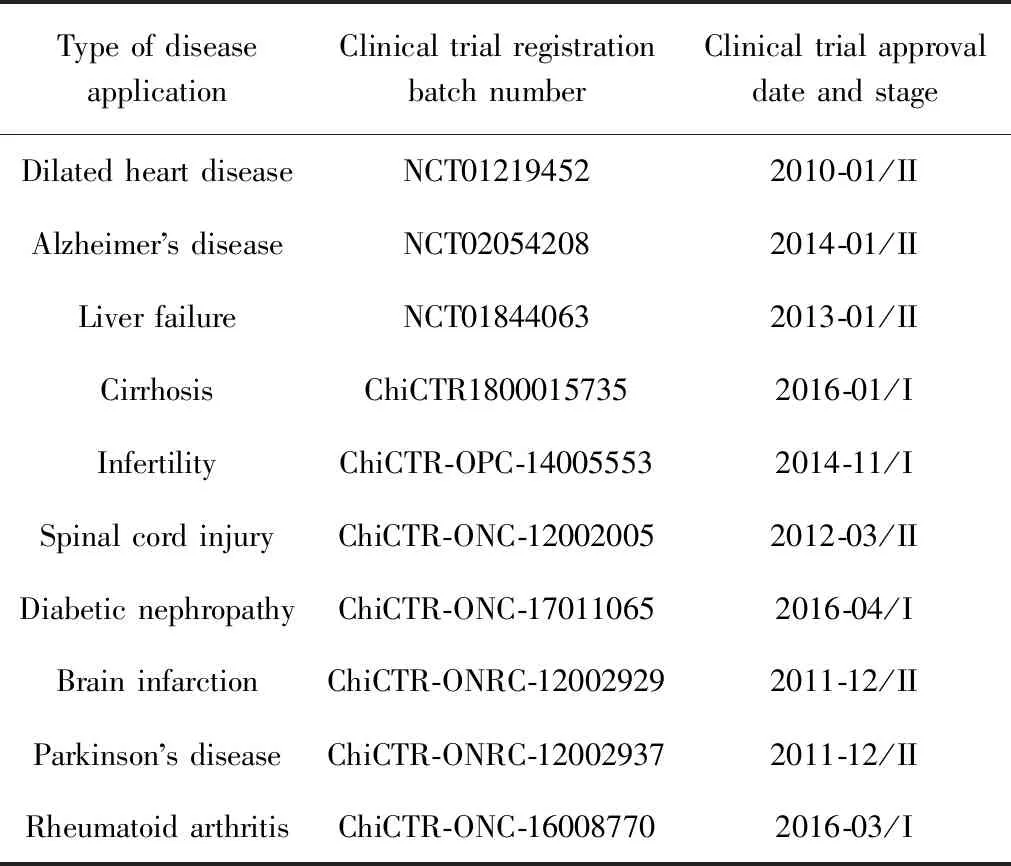
表1 間充質干細胞臨床試驗Table 1 Clinical trial of mesenchymal stem cells
3 納米材料在間充質干細胞應用方面的設計思路
納米材料用于間充質干細胞中主要有兩方面的應用,一是設計開發納米探針示蹤干細胞命運,二是利用納米顆粒自身特性或設計開發納米藥物來提高干細胞治療效率。
在間充質干細胞用于疾病治療方面,決定細胞治療效果的關鍵和前提是細胞移植或注射后要有足夠數量的干細胞到達病灶部位。因此,這就要求我們必須掌握以下幾方面的信息:① 干細胞移植或注射后在體內的存活和滯留狀態;② 干細胞進入體內的命運,尤其是是否以及如何到達病灶;③ 干細胞在體內的最終命運歸宿如何。要想充分了解這些信息,現有的成像技術或多或少會存在一些弊端,如小分子探針的細胞滯留時間短、體內代謝速度快;光學成像無法在臨床上應用;單一成像模式存在弊端等。納米探針因其尺寸上的生物學效應、作為載體平臺負載多種成像模式等方面的優勢,能夠克服目前一些成像技術的弊端,而被應用于了解干細胞在體內的命運。
進入體內或到達疾病靶組織后,干細胞如何發揮治療作用是決定干細胞發展潛力的主要因素。目前,間充質干細胞治療效果還有待進一步提高,其效果不理想的原因包括:干細胞定向遷移至損傷部位的能力較弱,且最終富集于損傷部位的數量有限;干細胞的旁分泌作用僅改善了整體組織微環境效應,而特異性或定向性針對某一種因子的調控能力不足。研究表明,人為干預這個治療過程能有效地彌補或提高治療效率。基于納米材料的優勢,一些納米材料自身或附加功能分子能夠主動調節干細胞的行為,從而提高治療上的效果。其設計原理主要分為自身具有一定生物活性的納米材料和附加某些生物活性分子的納米材料。附加的生物活性分子包括化學小分子藥物、核酸類藥物、多肽類藥物、細胞因子,如圖2所示。
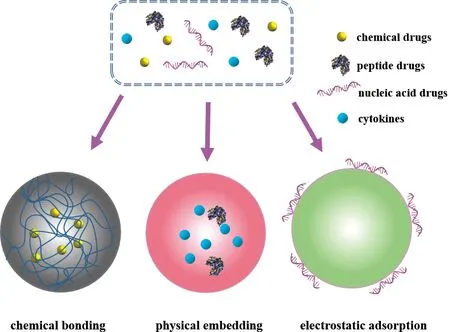
圖2 附加于納米材料的生物活性分子及其與納米材料之間的負載方式Fig.2 Bioactive molecules loaded on nanomaterials and their loading patterns with nanomaterials
4 納米探針示蹤間充質干細胞體內命運
4.1 納米探針設計原理
與傳統探針相比,納米探針不僅具有良好的生物相容性和穩定性[14],而且可作為載體負載各種功能小分子,有效提高納米材料的靶向性、延長其在體內的循環時間,并可顯著提高成像清晰度。因此,納米探針一經發現便引起了廣泛的關注。納米探針可根據所要檢測細胞的特性進行設計,像內部包覆和嵌入、表面電荷吸附、特定配體修飾等手段[15],從而實現對干細胞的標記、特定疾病部位的靶向。
按材料來分,納米探針主要分為有機納米探針和無機納米探針[16]。有機納米探針具有生物相容性好、體內循環時間長、負載可控等優勢,但在體內不穩定易導致信號失真,一般僅作為載體應用,自身無法直接用于成像;無機納米探針性質穩定、納米顆粒可控、可自身成像,但在體內不易被快速清理而易導致蓄積性毒性。按成像模式來分,可分為單一模式成像納米探針和多模式成像納米探針[17,18]。單一模式納米探針易于在材料制備和標準化上進行控制,但往往受限于各種檢測設備;多模式納米探針可以彌補各種成像模式的缺陷,實現“一針多用”的通用化成像方式,但不易可控標準化制備、各成像模式可能相互干擾。
4.2 單一模式成像納米探針
熒光成像納米探針是研究者開發的最為常見的納米探針,代表性的有量子點、硅基探針、碳點等。Li等[19]在CdTe/ZnS核殼量子點(QDs)表面用短肽(RGD)和氨基-環糊精(CD)來修飾,得到的短肽-環糊精-量子點(RGD-CD-QDs)納米載體增強了間充質干細胞對納米顆粒的攝取,從而提高了成像的信號強度。Lei等[20]使用PEG修飾CdSe/ZnS核殼量子點(PEG-CdSe/ZnS),通過二硫鍵與Tat肽偶聯作為納米探針。研究發現,PEG包覆量子點可減少細胞毒性、延長體內循環時間,從而實現偶聯Tat肽的PEG-CdSe/ZnS在體內長期追蹤移植的間充質干細胞。基于硅的納米材料也可以用于體內干細胞的追蹤。Liu等[21]利用二氧化硅修飾釕納米顆粒(SiO2@Ru)來標記移植的間充質干細胞,并可以促進間充質干細胞的分化。Shao等[22]用檸檬酸和乙二胺通過水熱法制備了基于檸檬酸的碳點及其衍生物1-乙基-5-氧-1,2,3,5-四氫-咪唑-[1,2-a]吡啶-7-羧酸(Et-IPCA)。研究表明,基于檸檬酸的CDs和Et-IPCA能夠長期跟蹤和促進骨髓間充質干細胞的成骨分化,并表現出良好的生物相容性和低毒性。Barron等[23]利用肽包裹的碳納米點追蹤間充質干細胞在體內的分布,并監控其增殖、分化過程。結果顯示碳納米點對間充質干細胞無不良影響,這為碳納米點應用于組織修復和再生奠定了基礎。
近年來,聚集誘導發光(aggregation-induced emission,AIE)的發現引起了人們極大的興趣。相對于傳統熒光成像納米探針,AIE材料在單分子分散狀態下熒光較弱甚至不發光,而在聚集狀態下可發出較強的光。因此,AIE納米顆粒兼具AIE分子和納米顆粒的優點,被廣泛應用于對間充質干細胞的標記和示蹤。有機納米點包裹AIE分子制備的成像用納米顆粒,能夠長期精確地示蹤移植到體內的間充質干細胞的行為,為干細胞治療監測、細胞優化給藥等方面提供了重要的信息[24]。Li等[25]將AIE分子與二氧化硅納米顆粒相結合用于監測干細胞的行為,為移植后干細胞的命運提供了重要的信息。
光學成像較難穿透深層組織,探針很難對體內干細胞進行示蹤。磁共振成像(magnetic resonance imaging,MRI)、正電子發射斷層成像(positron emission computed tomography,PET)具有較好的組織穿透性,可應用于移植干細胞在體內的成像。MRI是通過細胞內吞超順磁性氧化鐵(SPIO)納米顆粒,利用核磁共振原理成像對移植后干細胞的遷移和歸巢進行示蹤[26,27]。Liu等[28]利用低分子量的兩親性多聚乙炔與SPIO納米顆粒形成穩定的納米顆粒,該納米顆粒縱向弛豫時間(T2)的弛豫率較高,成像效果良好,能夠精確地示蹤間充質干細胞。PET成像是利用半衰期較短的放射性核素來標記干細胞,通過對放射性核素的定位實現對移植干細胞的示蹤[29]。Dwyer等[30]采用碘化鈉同向轉運體遞送放射性核素(I-131)至間充質干細胞,進行原位成像。該方法的一個主要優點是能夠非侵入式攝取示蹤劑(I-131),從而更多地靶向間充質干細胞,并提高成像的清晰度。
4.3 多模式成像納米探針
為了提高納米探針成像的準確性和精確性,并實現成像的多功能化,多模式成像納米探針應運而生[31]。多模式成像將不同的成像方式有機結合,綜合多種成像方式的優勢,增加了檢測深度、提高了檢測分辨率和靈敏度,可提供更為全面的成像信息。將間充質干細胞與多模式成像納米探針結合,用于腫瘤靶向的診療體系,通過光學成像、MRI和PET等成像方式的有機結合,實現了對腫瘤部位干細胞的精確示蹤[32]。在間充質干細胞的檢測中,Sung等[33]制備了一種同時負載SPIO納米顆粒和羅丹明B-硫氰酸鹽的二氧化硅納米顆粒,可實現熒光和核磁共振雙模式成像,實現體內外對移植干細胞的精確示蹤。
5 納米生物活性材料調控干細胞行為
5.1 納米材料調控干細胞行為
近年來,研究發現一些納米顆粒不僅起著載體的作用,其自身還能夠主動調節生物體的活動[34]。這些納米顆粒通過調控一些分子信號通路,從而參與干細胞的增殖、分化、旁分泌。以氧化鐵納米顆粒為例,鐵代謝是維持機體平衡的重要組成部分,很多蛋白的功能依賴鐵的存在,氧化鐵納米顆粒釋放的鐵離子能夠干預干細胞一些關鍵因子的表達,如上調細胞核轉錄因子HIF-1α的表達[35]。目前,納米材料主動調控干細胞行為主要表現為:① 通過不同的機制促進干細胞增殖[32,36-39];② 調節干細胞分化為不同類型的細胞,包括神經細胞、心肌細胞、脂肪細胞和成骨細胞[32,36-39];③ 增強間充質干細胞的旁分泌功能,刺激其產生更多的抗炎和促血管生成因子[35,40-44],如表2所示。

表2 不同納米材料對間充質干細胞的調控機制及其在疾病治療中的應用Table 2 The regulation mechanism of different nanoparticles on mesenchymal stem cells and its application in the treatment of diseases
一些金屬納米顆粒具有促進或抑制干細胞分化的能力[36]。金納米顆粒的大小、形狀和表面修飾可以影響干細胞對納米顆粒的攝取,從而影響其對干細胞的調節作用[34]。在誘導間充質干細胞成骨分化時,70 nm的棒狀金納米顆粒顯著促進了成骨分化,而當長度為40 nm時則對干細胞的成骨分化產生抑制作用。同樣,二氧化鈦納米顆粒的粒徑、形狀不同時,對干細胞的調控作用也可能截然不同[32]。另一些研究發現,氧化鐵納米顆粒可以在與間充質干細胞共培養中提高心肌細胞的間隙連接蛋白43(Cx43)的表達,這對于與間充質干細胞的間隙連接通信至關重要,可產生更高水平的電生理心臟生物標志物,提高對心臟修復有利的旁分泌,從而達到治療的目的。Huang等[45]報道了一種包載磁性鐵納米顆粒,增加了CXC趨化因子受體4型(CXCR4)的表達,提高了干細胞的歸巢效應。同時通過MRI對注射的攜帶包載磁性鐵納米顆粒的干細胞進行體內示蹤發現,這種納米顆粒有效提高了干細胞對急性腦創傷的修復效果。
石墨烯和氧化石墨烯納米顆粒是介導干細胞生長和分化的理想材料[38]。兩者的不同表面特性對調節小鼠誘導多能干細胞增殖和分化具有不同的效果。石墨烯納米顆粒加速誘導多能干細胞分化,而氧化石墨烯納米顆粒則維持細胞處于未分化狀態[39]。而對于硅納米顆粒而言,介孔二氧化硅納米顆粒也可以用于干細胞的調控[32]。聚合物納米顆粒在干細胞的調控中也起到重要作用。當殼聚糖納米顆粒與干細胞共孵育時,干細胞顯示出很好的肝靶向能力和控釋特性,并可以刺激其旁分泌釋放出大量的肝細胞生長因子(HGF)和血管內皮生長因子(VEGF),顯著改善急性肝衰竭[41]。
5.2 納米材料附加功能分子調控干細胞行為
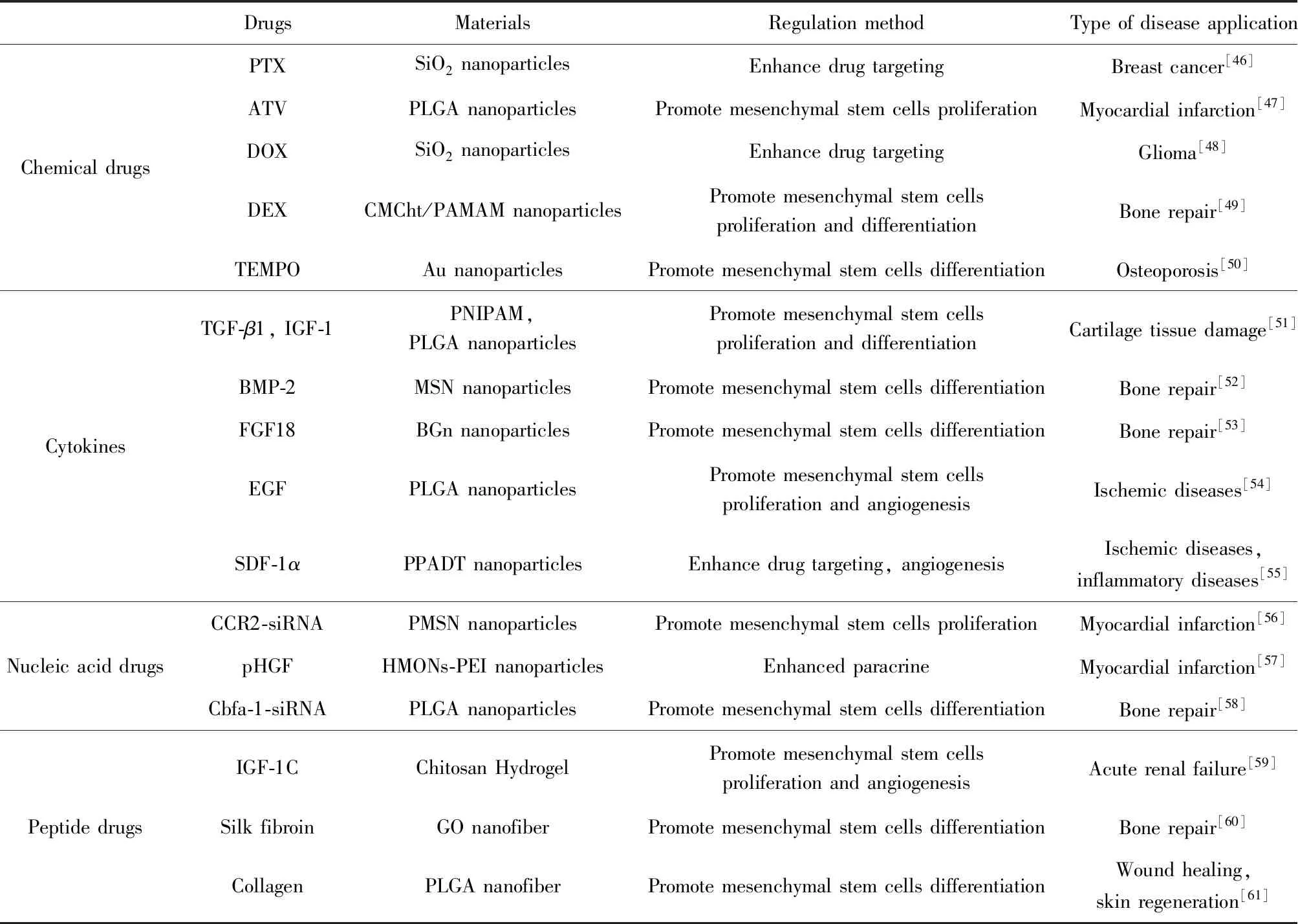
在納米材料上負載具有生物活性的分子(如化學小分子藥物、細胞因子、核酸類藥物、多肽類藥物等),來增強干細胞增殖、分化、旁分泌等功能,是目前研究的熱點。納米顆粒主要作為載體,提高這些功能分子向干細胞的遞送和轉染效率。如表3所示。
5.2.1 化學小分子藥物
負載化學小分子藥物的納米顆粒可實現對藥物的緩釋和控釋,從而增強MSC在治療中的存活。Wu等[46]將紫杉醇(PTX)加載到二氧化硅納米球中,并摻入金納米棒形成具有介孔的納米球(GNR@HPMOs-PTX)。間充質干細胞與1000 μg/mL GNR@HPMOs-PTX共同孵育得到GNR@HPMOs-PTX@MSC,在光熱處理后,可有效殺死乳腺癌細胞。注射24 h后體內成像顯示,GNR@HPMOs-PTX@MSC比GNR@HPMOs-PTX在腫瘤組織中的分布更均勻且顯著抑制腫瘤的生長。在Li等[48]的研究中,用二氧化硅納米顆粒作為多柔比星(DOX)的遞送載體(SN-DOX),通過與MSC膜蛋白CD73和CD90特異性結合使SN-DOX有效錨定在間充質干細胞上。這種結合方式延長了納米顆粒在間充質干細胞上的保留時間,同時負載藥物DOX可以被運送至整個腫瘤組織。而且,負載SN-DOX的間充質干細胞可有效地靶向腫瘤細胞以促進腫瘤細胞的凋亡。Li等[50]觀察到金納米顆粒以濃度響應的方式被細胞高度攝取,故將2,2,6,6-四甲基哌啶-N共軛氧化物(TEMPO)綴合在金納米顆粒表面,實現了TEMPO向細胞中的高效遞送。研究還發現,高濃度的Au-PEG-TEMPO納米顆粒可有效降低特定培養條件下間充質干細胞的活性氧(ROS)水平,且促進其成骨分化,可用于骨質疏松癥和其他疾病的干細胞移植。
表3納米材料附加功能分子對間充質干細胞的調控機制及其在疾病治療中的應用
Table3Theregulationmechanismofmesenchymalstemcellsbyfunctionalmoleculesofnanoparticlesanditsapplicationindiseasetreatment
DrugsMaterialsRegulationmethodTypeofdiseaseapplicationChemicaldrugsPTXSiO2nanoparticlesEnhancedrugtargetingBreastcancer[46]ATVPLGAnanoparticlesPromotemesenchymalstemcellsproliferationMyocardialinfarction[47]DOXSiO2nanoparticlesEnhancedrugtargetingGlioma[48]DEXCMCht/PAMAMnanoparticlesPromotemesenchymalstemcellsproliferationanddifferentiationBonerepair[49]TEMPOAunanoparticlesPromotemesenchymalstemcellsdifferentiationOsteoporosis[50]CytokinesTGF-β1,IGF-1PNIPAM,PLGAnanoparticlesPromotemesenchymalstemcellsproliferationanddifferentiationCartilagetissuedamage[51]BMP-2MSNnanoparticlesPromotemesenchymalstemcellsdifferentiationBonerepair[52]FGF18BGnnanoparticlesPromotemesenchymalstemcellsdifferentiationBonerepair[53]EGFPLGAnanoparticlesPromotemesenchymalstemcellsproliferationandangiogenesisIschemicdiseases[54]SDF-1αPPADTnanoparticlesEnhancedrugtargeting,angiogenesisIschemicdiseases,inflammatorydiseases[55]NucleicaciddrugsCCR2-siRNAPMSNnanoparticlesPromotemesenchymalstemcellsproliferationMyocardialinfarction[56]pHGFHMONs-PEInanoparticlesEnhancedparacrineMyocardialinfarction[57]Cbfa-1-siRNAPLGAnanoparticlesPromotemesenchymalstemcellsdifferentiationBonerepair[58]PeptidedrugsIGF-1CChitosanHydrogelPromotemesenchymalstemcellsproliferationandangiogenesisAcuterenalfailure[59]SilkfibroinGOnanofiberPromotemesenchymalstemcellsdifferentiationBonerepair[60]CollagenPLGAnanofiberPromotemesenchymalstemcellsdifferentiationWoundhealing,skinregeneration[61]
5.2.2 細胞因子
細胞因子可誘導間充質干細胞定向分化,采用納米材料包封的方法可實現細胞因子的緩慢釋放。骨形態發生蛋白-2(BMP-2)是有效的骨誘導生長因子,但在體內易被蛋白酶快速降解。將其固定在二氧化硅納米顆粒表面形成BMP-2肽功能化介孔二氧化硅納米粒子(MSNs-pep),與MSN相比具有更好的細胞相容性和較大的細胞攝取率。體外和體內實驗表明,MSNs-pep促進了間充質干細胞成骨分化,且具有誘導體內異位骨形成的能力[52]。由于表皮生長因子(EGF)在體液中被快速降解,Wang等[54]將攜帶EGF的聚乳酸-羥基乙酸共聚物(PLGA)納米顆粒(NP-EGF)包封在藻酸鹽水凝膠微膠囊中(NP-EGF@BM),從而使EGF與間充質干細胞表面受體相互作用促進間充質干細胞的增殖。將由間充質干細胞和NP-EGF@BM整合的膠原水凝膠注射到體內發現,膠原水凝膠改善了注射部位間充質干細胞的保留和存活,而釋放的EGF增強了間充質干細胞的增殖及血管生成因子的分泌,從而誘導血管的形成。Tao等[55]將基質細胞衍生因子-1α(SDF-1α)摻入含有ROS反應性基團硫代縮酮的新型聚合物聚(1,4-亞苯基丙酮二亞甲基硫代縮酮)(PPADT)中,形成了一種ROS響應性納米顆粒。將MSC和SDF-1α-PPADT注射入皮膚缺陷的小鼠體內后,由于ROS可使硫代縮酮鍵斷裂,使SDF-1α向靶向傷口有效釋放,從而促進間充質干細胞向傷口及其周圍的趨化性,誘導傷口血管形成并加速傷口愈合。因此,ROS響應性納米顆粒可以用于針對具有ROS升高的各種疾病的生物靶向療法,例如缺血性疾病和炎性疾病。
5.2.3 核酸類藥物
基因工程是改善間充質干細胞體內功能的一種方法,間充質干細胞的遺傳修飾通常通過病毒載體實現,但由于該方法生產成本高且存在體內免疫反應,因而具有一定的局限性。相反,非病毒載體克服了這些缺點,具有適合擴大生產和減少免疫刺激的優點,例如新興的納米材料作為非病毒載體可負載小干擾RNA(siRNA)等,實現對間充質干細胞的修飾從而對其產生調控作用。缺血性心臟中Ly6Chigh單核細胞的募集和浸潤與趨化因子CCL2/受體CCR2(CCL2/CCR2)信號傳導相關,需要通過靶向CCL2/CCR2來控制促炎單核細胞,改善對MSC移植有不利影響的炎性微環境。Lu等[56]將附載siCCR2的光致發光多孔硅納米顆粒(PMSN)與MSC應用于缺血性心肌損傷的治療,siCCR2在Ly6Chigh炎性單核細胞中靶向CCR2表達,減少了這些細胞在梗塞中的積累,從而提高間充質干細胞移植的功效并改善心肌重塑。低分子量的聚乙烯亞胺(PEI)通過共價鍵綴合在中空介孔有機二氧化硅納米顆粒(HMONs)表面后,不僅降低了PEI的細胞毒性,而且還在HMONs上形成陽離子表面,改善了HMONs的基因負載和保護能力。Zhu等[57]使用加載肝細胞生長因子基因(pHGF)的HMONs-PEI轉染間充質干細胞,發現轉染pHGF的間充質干細胞旁分泌作用得到增強,在心肌梗塞大鼠模型的移植中減輕了心肌細胞凋亡并促進了血管形成。納米材料表面涂覆siRNA也可實現對間充質干細胞的誘導。Su等[58]制備的PLGA納米顆粒,其核心負載軟骨分化相關蛋白(SOX9),外層用靶向核結合因子a1(Cbfa-1)的siRNA包覆。研究發現,使用PLGA納米顆粒轉染的間充質干細胞在mRNA和蛋白質水平表達了成熟軟骨細胞的標志物。
5.2.4 多肽類藥物
模擬生長因子生物活性的肽通過共價偶聯與材料結合,可模擬間充質干細胞的生長微環境從而控制干細胞的命運。Feng等[59]將胰島素樣生長因子1(IGF-1)的C結構域肽(IGF-1C)通過共價鍵連接在殼聚糖上合成生物活性水凝膠,通過旁分泌作用增加了間充質干細胞的活力,為間充質干細胞提供了有利的微環境。在缺血性腎臟中共移植殼聚糖-IGF-1C水凝膠和間充質干細胞,可增加MSC移植的存活率、促進血管生成、減輕纖維化并顯著改善腎功能。絲素蛋白是一種很有前途的天然生物相容性蛋白質,Shuai等[60]將絲素蛋白與氧化石墨烯制成納米纖維復合材料,加速了間充質干細胞的生長及早期細胞粘附,可在缺乏成骨分化培養基的情況下誘導間充質干細胞成骨分化,促進骨組織形成以進行骨修復。膠原蛋白通過構成真皮組分和促進上皮細胞附著來幫助傷口愈合。在Ma等[61]的研究中,通過與CD29抗體(Ab)綴合制備膠原/PLGA聚合物納米纖維支架(NFSs),以模擬天然細胞外機制的特性和結構。由于NFSs上的Ab可特異性識別并結合間充質干細胞表面的CD29抗原,使間充質干細胞在該支架上快速附著并在特定的傷口環境中向表皮分化,進而促進急性全層皮膚創傷中的傷口愈合和皮膚再生。
6 結 語
干細胞是疾病治療中非常重要的種子細胞,但是目前干細胞治療存在移植后存活率低、不能可視化治療等問題,而生物活性納米材料可實現移植后干細胞在體內的示蹤,實現干細胞的可視化治療,同時納米材料可負載化學藥物、基因藥物等,大大提高干細胞的治療效果。
納米技術在輔助或干預干細胞在疾病中的治療發揮著越來越重要的作用,通過標記和示蹤干細胞更好地了解了干細胞是否以及如何發揮治療效用,通過納米顆粒本身或負載一些功能分子可誘導干細胞定向分化、促進干細胞向損傷部位的“歸巢”、刺激干細胞旁分泌、調控干細胞周圍組織微環境等,從而顯著提高疾病治療效果。從目前論文發表趨勢來看,這種結合勢將會越來越普遍和深入。
生物活性納米材料與干細胞的聯合應用為疾病的治療提供了新的思路,這方面研究涉及生物學、材料學、醫學和化學等多門類交叉學科,涉及亟待解決的瓶頸性難題還很多。例如,干細胞靜脈注射后主要會被肺部截留,到達疾病部位的會非常有限;干細胞標記用納米探針會隨著細胞的擴增在細胞內得到稀釋,所以單細胞的成像信號會越來越低;生物活性納米材料對干細胞的正面調控是否能轉化到臨床應用。隨著納米技術的發展,我們期望越來越多的瓶頸問題能夠得到解決。

