成纖維細胞生長因子 FGF11、13、18對小鼠毛囊第一生長周期作用的研究
曹校瑞,高淑媛,牛 姝,程笳琪,赫曉燕
(山西農業大學動物科技學院,山西太谷030801)
毛囊是皮膚重要而復雜的附屬結構,是一個再生組織,不斷經歷生長期、退化期和靜止期3個時期,這個過程叫做毛發周期。其中,小鼠出生后1~23 d為毛囊的第一生長周期,其中1~12 d為生長期,13~18 d為退化期,19~22 d為靜止期,23 d毛囊進入再生長期。毛囊第一生長周期作用過程復雜,由多種酪氨酸蛋白激酶受體生長因子調節,包括胰島素生長因子、表皮細胞生長因子、成纖維細胞生長因子和血小板源性生長因子。成纖維細胞生長因子(Fibroblast growth factors,FGF)家族的成員參與很多不同類型細胞的增殖、遷移、分化和存活,參與控制血管生成[1-2],通過與其受體FGFR結合來進一步調控毛發的生長。
FGF11和FGF13都是FGF11亞家族的成員,在舌頭發育中,FGF11和 FGF13都有表達,其中FGF11作用有限,FGF13可能參與間葉細胞增殖和分化[3],但FGF13的功能基本上仍是未知的,FGF13在胚胎中樞和周圍神經系統也有顯著廣泛的表達[4]。FGF18屬于FGF8亞族的一員,FGF18是多向性的生長因子,可以刺激間葉細胞、上皮細胞和組織的增殖,如肺、腎、心、睪丸、脾臟、骨骼、肌肉和大腦[5]。然而FGF11在皮膚毛囊形成和發育過程中作用的研究從未報道過,有報道提到FGF13在出生后1~4 d的新生小鼠皮膚毛囊隆起部和基底層高表達,FGF18信號在成年小鼠毛囊發育靜止階段維持毛囊干細胞的靜止狀態,促進毛囊從靜止期向生長期過渡[6-10]。但是在出生后小鼠毛發生長發育第一個周期中,這3個生長因子是如何表達的,起到什么作用,還沒有系統全面的研究過。本試驗首先采用免疫組化技術檢測FGF11、FGF13和FGF18蛋白在小鼠毛囊第一生長周期的背部皮膚中的分布,其次采用實時熒光定量PCR技術從基因水平檢測FGF11、FGF13和FGF18基因在小鼠毛囊第一生長周期背部皮膚中的表達量,最后通過蛋白免疫印跡技術檢測FGF11、FGF13和FGF18蛋白在小鼠毛囊第一生長周期背部皮膚中的表達量。旨在探究FGF11、FGF13和FGF18對小鼠毛囊第一生長周期的影響,為研究毛發生長機制提供一定的理論基礎。
1 試驗材料
1.1 試驗動物及取材 從山西醫科大學購買ICR小鼠(動物合格證號:0107010),飼養一段時間,待小鼠適應新環境后,進行合籠。從觀察到陰道栓開始記懷孕天數。 取出生后 3、5、8、13、16、18、20 d 和23 d小鼠背部皮膚,每次隨機選取3只日齡相同的小鼠的皮膚組織,每只小鼠背部皮膚取若干分為三部分,其中一部分先用Bouin氏固定液進行固定,隨后進行組織包埋。剩下二部分放入液氮中保存。
1.2 主要試驗藥品、試劑與耗材 FGF11兔抗多克隆抗體(Biorbye,Orb101545)、FGF13兔抗多克隆抗體(Abcam,Ab153808)、FGF18兔抗多克隆抗體(Biorbye,Orb1778)、兔 Streptavidin-HRP試劑盒(康為公司)、TRIZol Reagent(Invitrogen公司);SYBR PremixEx TaqⅡ、PrimeScriptTMRT reagent Kit with gDNA Eraser(TaKaRa公司)等。
2 方法
2.1 免疫組化
2.1.1 石蠟切片的制備 常規方法制片,片厚6 μm。試驗組織修整→脫水、透明→浸蠟→包埋→修塊→切片、展片、烤片→做好標記,放入切片盒備用。
2.1.2 免疫組織化學試驗 采用免疫組化試劑盒,按說明書進行試驗。切片脫蠟與復水→封閉→陽性組滴加兔抗 FGF11(1∶150)、FGF13(1∶200)、FGF18(1∶200)、對照組滴加同等體積PBS緩沖液→4℃過夜孵育→磷酸鹽緩沖液(PBS)沖洗→滴加生物素標記羊抗兔二抗工作液,孵育10 min→PBS緩沖液沖洗→滴加鏈酶親和素(SABC)→PBS緩沖液沖洗→二氨基聯苯胺(Diaminobenzidine,DAB)+H2O2顯色→蘇木精染色→封片→觀察,采集圖像,每個樣品取6張切片,每張切片選取五個視野。
2.1.3 圖像采集與數據分析 使用圖像分析軟件Image-pro plus6.0,對每張切片采集的5個視野進行分析,得出每個樣品的陽性反應平均光密度值。使用SPPS17.0軟件分析統計表得到每組值的均值和標準偏差,進行方差分析。
2.2 實時熒光定量PCR
2.2.1 小鼠背部皮膚總RNA及cDNA的提取 采用TRIZol法,提取出生后小鼠背部皮膚總RNA,使用反轉錄試劑盒將其反轉錄為cDNA。反應完成后,測量濃度,放在-20℃保存。
2.2.2 PCR引物的設計及擴增 登錄NCBI查詢小鼠FGF11、FGF13、FGF18及內參β-actin基因的序列,用Primer 5軟件設計引物,引物序列如下:

將上述引物送華大基因科技服務有限公司合成,之后進行普通PCR擴增,切膠條送華大基因科技服務有限公司測序。測序成功后進行實時熒光定量PCR。
2.2.3 熒光定量 PCR檢測 FGF11、FGF13、FGF18在出生后小鼠皮膚中的表達 利用實時熒光定量PCR檢測FGF11、FGF13、FGF18在出生后小鼠皮膚中的表達。以反轉錄得到的cDNA為模板,β-actin作為內參基因及上述引物進行熒光定量PCR擴增。制備好反應體系后在StepOnePlus Real-Time PCR中進行擴增。按照RT-PCR Kit說明書操作,每個樣品4個重復,反應體系為10 μL。反應條件:預變性95℃ 30 s,95℃ 5 s,57℃ 30 s,72℃ 15 s,循環數為40個,終延伸72℃ 10 min。試驗數據采用2-ΔΔCT,所有數據用SPSS 17.0進行統計分析,熒光實時定量 PCR結果均用均值±標準差(Means±SD)表示,其中各基因的表達量所示結果均由內參基因β-actin的表達量進行校正,所有數據采用SPSS 17.0統計軟件進行單因素方差分析檢驗。
2.3 蛋白免疫印跡技術
2.3.1 出生后小鼠背部皮膚總蛋白的提取 根據總蛋白提取試劑盒的試驗步驟說明書提取皮膚組織的總蛋白,測定濃度后將樣品放入-80℃保存。
2.3.2 蛋白免疫印記(Western Blot)每個樣品總蛋白上樣量為300 μg,每個樣品3個重復,根據濃度算出體積。總體系30 μL,之后進行SDS-聚丙烯酰胺凝膠電泳。經制膠和加樣、電泳和轉膜后,在孵育盒中配制抗體 FGF11(1∶300)、FGF13(1∶400)、FGF18(1∶300)進行4℃過夜孵育后得出含有蛋白印記的NC膜,按照eECL Western Blot Kit高靈敏度化學發光檢測試劑盒說明書配制發光液,均勻涂在NC膜上,用凝膠成像儀曝光,暗室壓膠片。
2.3.3 蛋白免疫印記圖像分析 利用Image J分析FGF11、FGF13、FGF18蛋白和β-actin蛋白條帶灰度值,然后用軟件分析數據。
3 結果
3.1 免疫組織化學結果 免疫組織化學結果顯示,在小鼠背部皮膚真皮乳頭、毛基質、外根鞘、膨大部、皮脂腺和表皮均有FGF13的免疫陽性反應,主要在細胞質中表達,在陰性對照組均未見FGF13的陽性反應(見中插彩版圖1 A-D a-d)。在小鼠背部皮膚真皮乳頭、毛基質、內根鞘、外根鞘、皮脂腺、膨大部和表皮均有FGF18的免疫陽性反應,在細胞質和細胞核中都有表達,在陰性對照組均未見FGF18的陽性反應(見中插彩版圖1 E-H e-h)。在小鼠背部皮膚真皮乳頭、毛基質、內根鞘、外根鞘和皮脂腺均有FGF11的免疫陽性反應,在陰性對照組均未見FGF11的陽性反應(見中插彩版圖1 I-L i-l)。 FGF11、FGF13、FGF18 的光密度值見表 1。
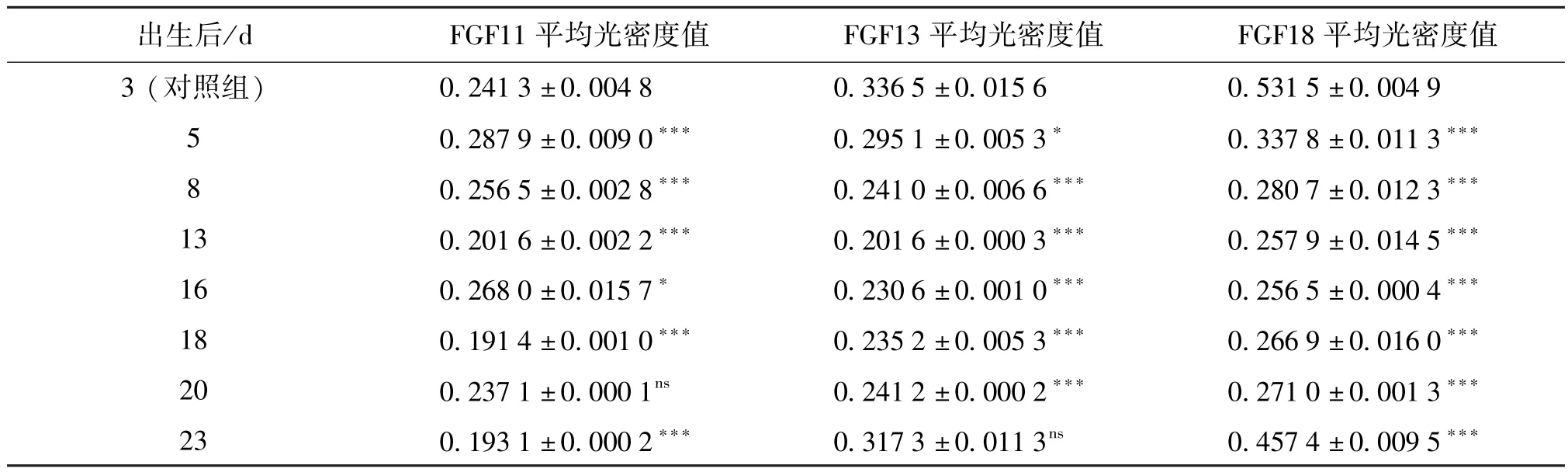
表1 出生后小鼠背部皮膚FGF11、13、18蛋白陽性反應物平均光密度值
3.2 RT-PCR結果 如圖2,經過PCR儀擴增,得到大小分別為109 bp、121 bp、132 bp 的 FGF11、FGF13、FGF18基因核酸片段。在NCBI將測序結果序列比對后確實為小鼠的FGF11、FGF13、FGF18基因。
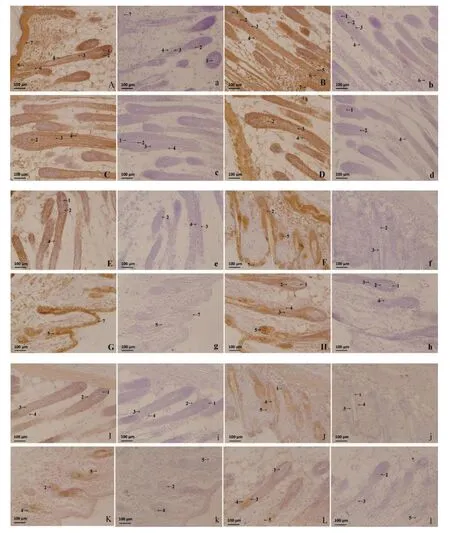
圖1 FGF13、FGF18、FGF11蛋白在出生后小鼠背部皮膚中的表達
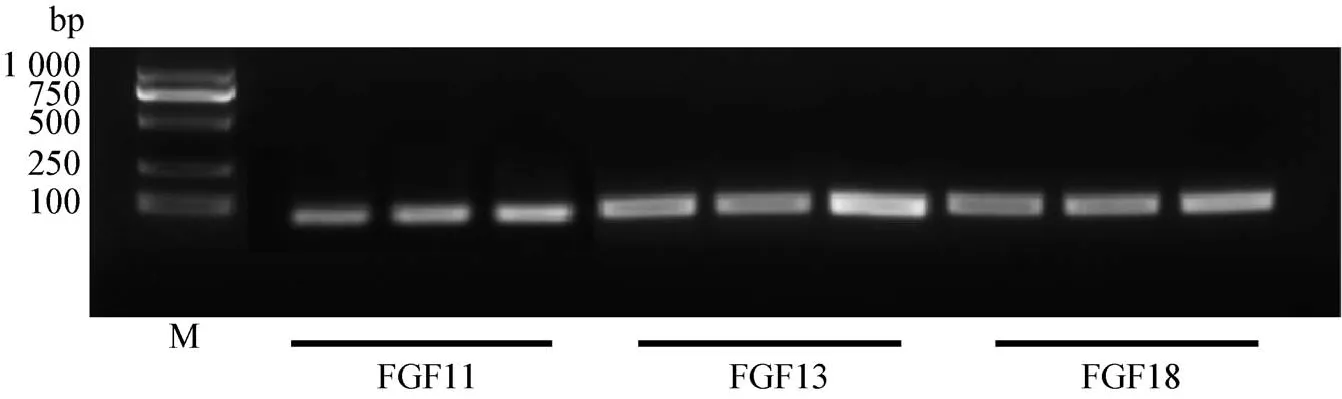
圖2 FGF11、FGF13、FGF18基因PCR擴增產物
通過 RT-PCR實驗測定了 FGF11、FGF13、FGF18基因在小鼠背部皮膚中的相對表達量,β-actin作為內參基因。利用2-ΔΔCT法得于出生后小鼠皮膚FGF11、FGF13、FGF18 mRNA的相對表達量,出生后3天的相對表達量為對照組,其統計圖見圖3,出生后FGF11 mRNA在5日齡表達量最高,在生長期表達量逐漸下降;FGF13 mRNA表達量在生長期逐漸下降,靜止期及退化期逐漸上升;FGF18 mRNA表達趨勢與FGF11相似。
3.3 蛋白免疫印跡結果 通過Western Blot檢測FGF11、FGF13、FGF18在小鼠背部皮膚組織中的表達量發現:在不同日齡小鼠背部皮膚中均有FGF11、FGF13、FGF18蛋白的存在,大小依次為 25 kDa、25 kDa、28 kDa,出生后,FGF11在5日齡表達最高,但是整體并沒有一定的趨勢;FGF13在3日齡表達最高,13日齡表達最低,從16日齡表達量開始上升;FGF18在3日齡小鼠背部皮膚中表達量最高,16日齡最低,從18日齡開始表達量又開始上升。其條帶見圖4,蛋白分析統計見圖5。

圖3 出生后小鼠背部皮膚FGF11、FGF13、FGF18和β-actin基因相對表達量統計
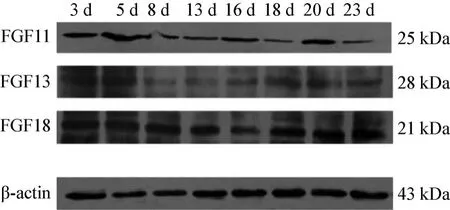
圖4 出生后小鼠背部皮膚FGF11、FGF13、FGF18和β-actin的曝光條帶
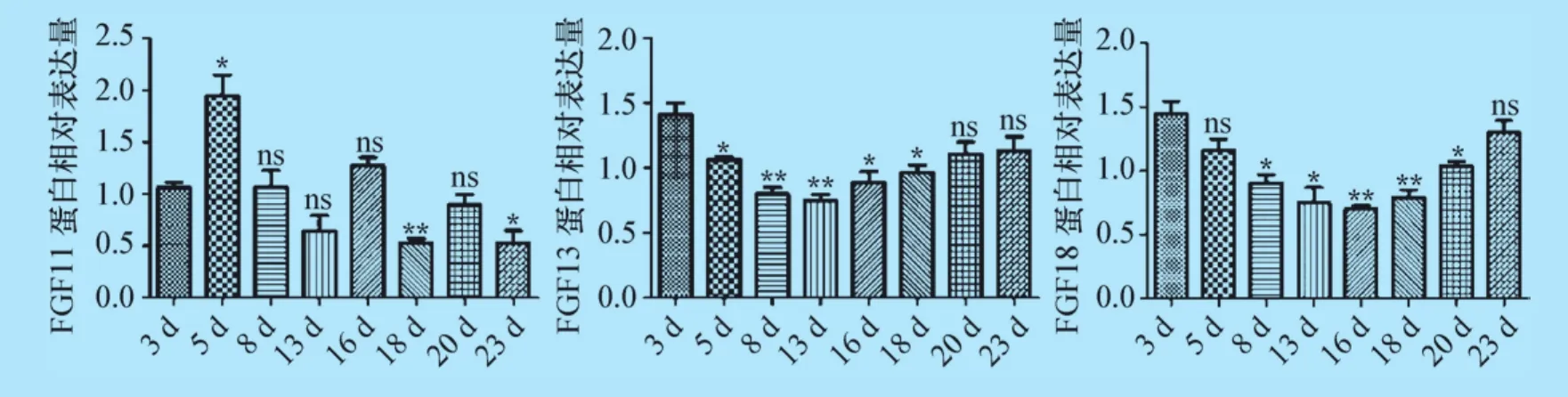
圖5 FGF11、FGF13、FGF18在出生后小鼠背部皮膚組織中蛋白印記分析統計圖
4 討論
出生后,毛囊出現周期性的活動模式,這種循環模式被稱作是毛發周期[11]。本試驗首先選取出生后1~23 d的小鼠背部皮膚,包埋后通過H.E.染色技術觀察其形態結構,選取出生后3 d、5 d、8 d、13 d、16 d、18 d、20 d 和23 d 的小鼠,其中,3 d、5 d、8 d 毛囊分別處于生長期;13 d、16 d、18 d 毛囊處于退化期;20 d毛囊處于靜止期;23d毛囊進入再生長期。
IHC-P試驗顯示,FGF11表達于小鼠背部皮膚真皮乳頭、毛基質、內根鞘、外根鞘和皮脂腺,且在細胞質和細胞核都有表達,有試驗證明,FGF11是細胞內蛋白,主要在細胞核內結合和控制電壓門控通道,進而在某些促有絲分裂和細胞存活的相關活動中發揮作用[12]。光密度統計、RT-PCR、WB結果均顯示FGF11的表達量忽高忽低,沒有發現一定的規律。表明FGF11對于出生后小鼠背部皮膚毛囊生長周期可能沒有明顯和特定的調節作用。不過,在生長期Ⅲc(5 d)和退化期Ⅲ(16 d),FGF11的表達量分別高于生長期和退化期的其他階段,其原因需要今后試驗的進一步研究。
IHC-P試驗得出,小鼠背部皮膚真皮乳頭、毛基質、內根鞘、外根鞘、膨大部、皮脂腺和表皮均有FGF13的免疫陽性反應,主要在細胞質中,在膨大部的陽性免疫反應較強,內根鞘免疫陽性反應很弱。RT-PCR實驗顯示,FGF13 mRNA從3 d開始一致下降,在13 d表達量最低,從16 d開始表達量上升。Western Blot試驗顯示的FGF13蛋白表達趨勢與定量表達趨勢一致。結果提示,FGF13在膨大部表達量高,這與前人所提出的試驗結果一致,而毛囊干細胞主要位于膨大部,干細胞以循環的方式不斷處于活躍和靜止狀態,說明FGF13對于毛囊的自我更新有一定的作用;且FGF13在生長期表達量較高,退化期表達量降低,靜止期表達量增加,再生長期表達量又升高,說明FGF13可能誘導毛囊從靜止期向再生長期過渡,可以促進對毛囊生長,可能的解釋是,毛囊進入再生長期主要取決于自主的、依賴于固有的信號和非自主的、因周圍大環境激活劑傳遞過來的信號,而靜止期FGF13信號增強,超過了毛囊干細胞活躍的閾值,刺激毛囊干細胞激活,進而進入了再生長期。
FGF18可能誘導真皮乳頭細胞分泌生長因子影響毛囊細胞,或可能會作用于血管內皮細胞影響血液循環[13]。Kawano M等人的研究發現,當生長期皮下注射FGF18,基質細胞增殖立刻被抑制,毛囊生長強烈被抑制。相比之下,當靜止期皮下注射FGF18時,沒有迅速的反應,但是經過一段時間后(3~8周),實驗組毛發生長早于對照組,對照組皮下注射的是磷酸鹽緩沖溶液[14]。Kimura-Ueki M等人試驗敲除FGF18,顯示出靜止期縮短[15]。而且,真皮乳頭的FGF18在靜止期早期表達量多于晚期。還有研究說對體外膨大部干細胞FGF18是抑制效應。本試驗沒有添加或者敲除FGF18,是研究了毛囊正常發育過程中FGF18的表達情況。IHC-P試驗得出,在小鼠背部皮膚真皮乳頭、毛基質、內根鞘、外根鞘、膨大部、皮脂腺、膨大部和表皮均有FGF18的免疫陽性反應,在細胞質和細胞核中都有表達,但是內根鞘陽性免疫反應物較少,在外根鞘陽性反應物較高。RT-PCR試驗顯示,FGF18 mRNA從3 d表達量開始逐漸降低,到了16 d降到最低,18 d開始上升。Western Blot試驗顯示,FGF18蛋白表達趨勢與定量表達趨勢一致。結果提示,FGF18在生長期期間的表達量從高到低,退化期表達量降到最低,靜止期表達量又增加,再生長期表達量高于靜止期,可見由于FGF18信號的增加,毛囊進入了再生長期,試驗得出FGF18在毛囊循環周期中在靜止期向生長期過渡期有一定的作用,可以促使毛囊從靜止期進入再生長期,可能是因為FGF18誘導真皮乳頭細胞分泌生長因子,影響毛囊細胞,也可以刺激真皮成纖維細胞,乳頭細胞以及表皮角化細胞的DNA合成。
5 結論
5.1 通過 NCBI設計了小鼠 FGF11、FGF13和FGF18的特異性引物,通過PCR技術進行擴增,得到大小分別為109 bp、121 bp、132 bp的基因片段。
5.2 在小鼠毛囊生長第一個周期,FGF11可能沒有明顯和特定的調節作用;FGF13可能對于毛囊的自我更新有一定的作用,誘導毛囊從靜止期向再生長期過渡,促進毛囊生長;FGF18在毛囊從靜止期向生長期過渡期有一定的作用,可以促使毛囊從靜止期進入再生長期。

