醫院制劑水合氯醛口服溶液微生物限度檢查方法的建立
曾蔚欣 劉敏 劉俊麗

[摘要] 目的 建立有效、簡單、經濟的醫院制劑水合氯醛口服溶液微生物限度檢查方法,并用建立的方法對3個批次的樣品進行微生物限度檢查。 方法 依據現行《中國藥典》2015年版四部通則的相關要求,選用薄膜過濾法進行樣品的前處理,選用5種菌株進行方法學驗證。 結果 微生物計數檢查的5種菌種的回收率均在0.5~2.0范圍內,控制菌檢查大腸埃希菌合格。 結論 水合氯醛口服溶液的微生物限度檢查方法經驗證符合2015年版《中國藥典》的要求。
[關鍵詞] 水合氯醛口服溶液;薄膜過濾法;微生物限度檢查;方法學驗證;中國藥典2015年版
[中圖分類號] R927.33 ? ? ? ? ?[文獻標識碼] A ? ? ? ? ?[文章編號] 1673-7210(2019)05(c)-0096-04
[Abstract] Objective To establish an effective, simple and economical microbial limit test method for Chloral Hydrate Oral Solution of hospital preparations, which was used to carry out microbial limit test for three batches of samples. Methods According to the related requirement of the four general rules of the 2015 edition of Chinese Pharmacopoeia, membrane filtration was used for sample pretreatment. 5 strains were selected for methodological verification. Results The recovery ratio of the five strains of microbial counts were within the range of 0.5 to 2.0, and Escherichia coli tested by control bacteria was qualified. Conclusion After verification, the microbial limit test for Chloral Hydrate Oral Solution can meet the requirements of the 2015 edition of Chinese Pharmacopoeia.
[Key words] Chloral Hydrate Oral Solution; Membrane filtration method; Microbial limit test; Methodological verification; 2015 edition of Chinese Pharmacopoeia
首都醫科大學附屬北京世紀壇醫院(以下簡稱“我院”)制劑水合氯醛口服溶液為口服溶液劑,可用于治療失眠、煩躁不安及驚厥[1],也是輔助檢查前常用的鎮靜藥,其吸收率高,胃腸刺激輕,起效速度快,且與全身麻醉的成本效益比較,更加經濟方便[2-4]。微生物污染是影響藥品生產質量和引發藥品不良反應的重要因素之一,因此,為了保證藥品的質量,必須對藥品進行微生物限度檢查,檢查方法也應根據藥典的變化及時更新。根據2015年版《中國藥典》微生物限度檢查法的規定[5],口服溶液劑的需氧菌總數應不得超過102 cfu/mL,霉菌和酵母菌數應不得超過101 cfu/mL,大腸埃希菌每1 mL不得檢出。本制劑的原質量標準微生物限度檢查方法為2010年版《中國藥典》的檢查方法,隨著2015年版《中國藥典》的正式實施,醫院制劑的質量標準也應隨之提高,檢查方法也應隨之更新,真正達到標準嚴格、質量可控,以保證用藥安全。本文參考了相關文獻[6-9],建立了適合于本品的微生物限度檢驗方法,并根據2015年版《中國藥典》四部的要求[5],對我院制劑水合氯醛口服溶液進行了微生物限度檢查的方法學適用性試驗,使該制劑的質量標準提升至現行藥典的水平,并用建立的方法,對3批樣品進行了微生物限度檢查,以期為該類藥物的微生物檢驗提供參考。
1 材料與方法
1.1 主要儀器
BT125D千分之一電子分析天平(賽多利斯科學儀器有限公司);YXQ-LS-50SⅡ自動高壓蒸汽滅菌器(上海博訊醫療生物儀器股份有限公司);SW-CJ-IFD超凈工作臺(浙江孚夏醫療科技有限公司);BSC-110 0IIA2-X生物安全柜(北京東聯哈爾儀器制造有限公司);SPX-250電熱恒溫培養箱30~35℃(康恒儀器實驗室設備有限公司);SPX-1000電熱恒溫培養箱42~44℃(江蘇天翎儀器有限公司);SPX-250電熱恒溫培養箱42~44℃(蘇州江東精密儀器有限公司);薄膜過濾器(上海那艾精密儀器有限公司);三目顯微鏡(日本奧林巴斯公司);VITEK2 Compact全自動細菌鑒定及藥敏分析系統(法國梅里埃生物制品有限公司)。
1.2 供試品
水合氯醛口服溶液(批號分別為20170704、2017 0705、20170706)由我院制劑室提供。
1.3 菌種
金黃色葡萄球菌[CMCC(B)26003]、銅綠假單胞菌 [CMCC(B)10104]、枯草芽孢桿菌 [CMCC(B)63501]、大腸埃希菌[CMCC(B)44102]、白色念珠菌[CMCC(F)98001]、黑曲霉[CMCC(F)98003]均來自中國食品藥品檢定研究院,且菌株傳代次數均不超過5代。
1.4 培養基
胰酪大豆胨液體培養基(TSB,批號:1703062);胰酪大豆胨瓊脂培養基(TSA,批號:1702032);沙氏葡萄糖瓊脂培養基(SDA,批號:1702242);麥康凱液體培養基(MacB,批號:160801);麥康凱瓊脂培養基(MacA,批號:1510009);稀釋液為0.9%無菌氯化鈉溶液(批號:1603072)。以上廠家均為北京陸橋技術有限公司生產,適用性檢查符合要求。
2 方法與結果
2.1 菌液的制備方法
金黃色葡萄球菌、銅綠假單胞菌、谷草芽孢桿菌:分別將金黃色葡萄球菌、銅綠假單胞菌、谷草芽孢桿菌接種至胰酪大豆胨液體培養基中,置于35℃培養箱中,培養24 h,用0.9%無菌氯化鈉溶液制成每1 mL含菌量為103~104 cfu的混懸液。
白色念珠菌:取白色念珠菌接種至胰酪大豆胨液體培養物中,置于25℃培養箱中,培養24 h,用0.9%無菌氯化鈉溶液制成含菌量為103~104 cfu/L的混懸液。
黑曲霉:將新鮮培養物接種至沙氏葡萄糖瓊脂斜面培養基中,置于25℃培養箱中,培養7 d,加入含0.05%(V∶V)聚山梨酯80的0.9%無菌氯化鈉溶液5 mL,洗下孢子并收集孢子懸液,制成含霉菌孢子數為103~104 cfu/L的黑曲霉孢子混懸液。
2.2 供試液的制備
取水合氯醛口服溶液兩瓶,混合均勻,作為供試品原液。取供試品原液10 mL,加入0.9%無菌氯化鈉溶液至100 mL,混合均勻,即為1∶10的供試液。
2.3 需氧菌總數計數方法適用性試驗
①試驗組:取供試品原液1 mL,加入0.9%無菌氯化鈉溶液100 mL中,混合均勻,按照《中國藥典》[5]2015年版四部通則1105項下非無菌產品的微生物限度檢查法進行試驗,采用薄膜過濾法過濾,用0.9%無菌氯化鈉溶液沖洗濾膜3次,每次約100 mL。在最后一次沖洗中用注射器注入1 mL 50~100 cfu的試驗菌液,待薄膜過濾器中無沖洗液后,取出濾膜,將薄膜菌面向上放置于制備好的胰酪大豆胨瓊脂培養基平皿中央,每種試驗菌株平行制備2個平皿,測定需氧菌總數。接種金黃色葡萄球菌、銅綠假單胞菌和枯草芽孢桿菌時,在33℃培養箱中培養3 d;接種白色念珠菌和黑曲霉時,在33℃培養箱中培養5 d。②供試品對照組:取供試品原液1 mL,同試驗組操作,不加入試驗菌液,測定供試品本底的需氧菌總數。③菌液對照組:取0.9%無菌氯化鈉溶液100 mL代替供試品同試驗組操作,測定菌落數。④回收比值的計算:根據試驗結果按下列公式計算:回收率(%)=(試驗組平均菌落數-供試品對照組平均菌落數)/菌液對照組平均菌落數×100%[10-11]。結果顯示:3批水合氯醛口服溶液,采用薄膜過濾法進行平行測定,金黃色葡萄球菌、枯草芽孢桿菌、銅綠假單胞菌、黑曲霉、白色念珠菌的回收率均在0.5~2.0范圍內,提示水合氯醛口服溶液的需氧菌檢查方法適用性驗證合格。見表1。
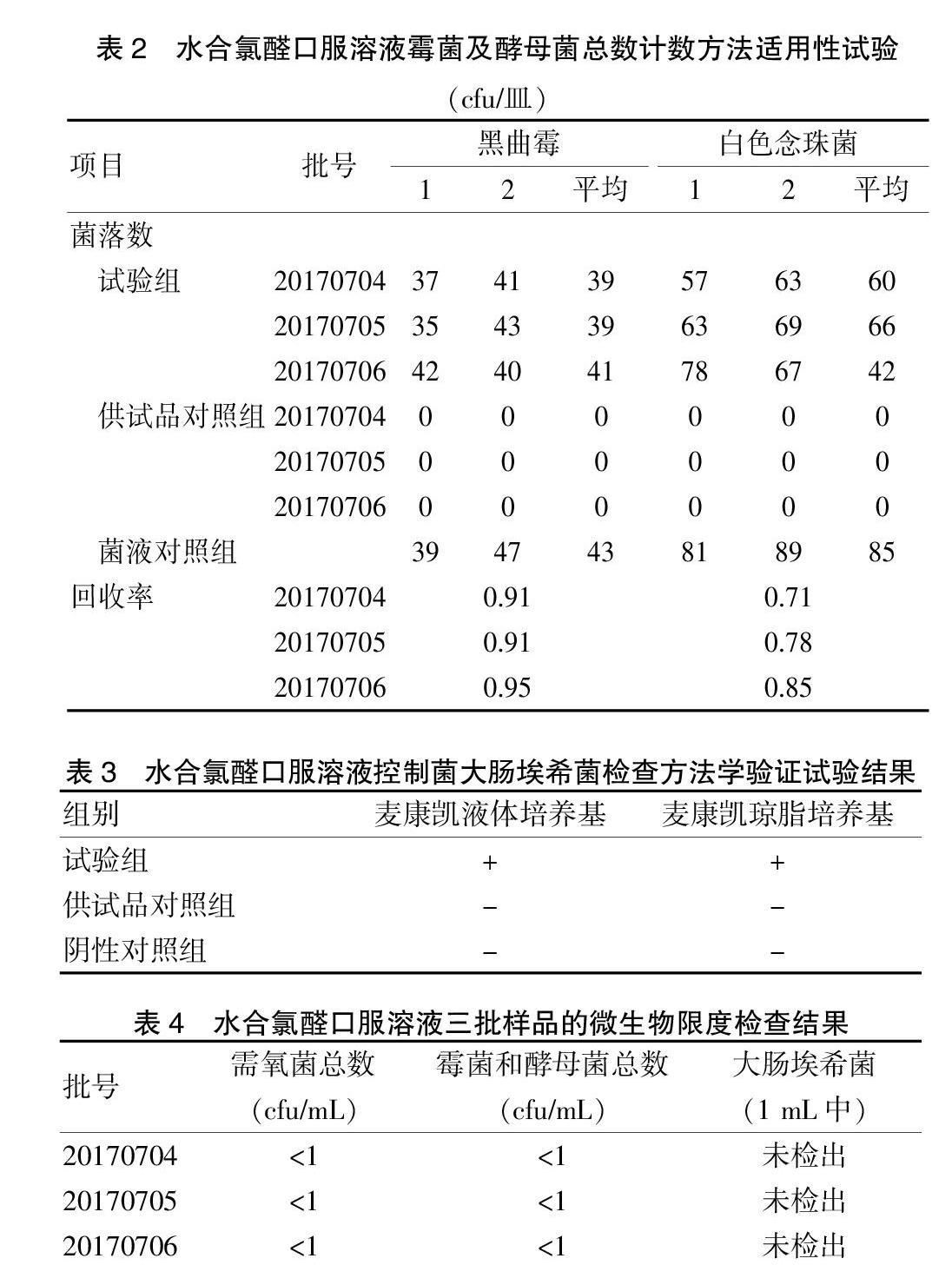
2.4 霉菌及酵母菌總數計數方法適用性試驗
①試驗組:按照“2.3”項下的試驗方法進行操作,將薄膜菌面向上放置于制備好的沙氏葡萄糖瓊脂平皿中央,每種試驗菌株平行制備2個平皿,置于20~25℃培養箱中培養24~120 h,逐日觀察結果并計數。②供試品對照組:取供試品原液1 mL,同試驗組操作,不加入試驗菌液,測定供試品本底的需氧菌總數。③菌液對照組:取0.9%無菌氯化鈉溶液100 mL代替供試品同試驗組操作,記錄菌落數。④回收比值的計算:根據試驗結果按下列公式計算,回收率(%)=(試驗組平均菌落數-供試品對照組平均菌落數)/菌液對照組平均菌落數×100%。結果顯示:3批水合氯醛口服溶液,采用薄膜過濾法進行平行測定,黑曲霉和白色念珠菌的回收率均在0.5~2.0范圍內,提示水合氯醛口服溶液的霉菌及酵母菌總數計數方法適用性驗證合格。見表2。
2.5 控制菌檢查方法適用性試驗
①試驗組:取上述1∶10的供試液10 mL,按照“2.3”項下試驗方法進行操作,取濾膜加至100 mL胰酪大豆胨液體培養基中并混勻,在33℃培養箱中培養18 h。取上述培養物1 mL,接種至麥康體培養基100 mL中,混勻,在43℃培養箱中培養48 h,取培養物劃線接種于麥康凱瓊脂平板上,在33℃培養箱中培養18 h,每日觀察菌落生長結果。②供試品組:取1∶10的供試液10 mL,采用薄膜過濾法,沖洗方式同需氧菌總數項下,在最后一次沖洗中用注射器注入1 mL稀釋液代替菌液同試驗組操作。③陰性對照組:取0.9%無菌氯化鈉溶液10 mL替代供試液,按試驗組操作進行試驗。結果顯示:供試品對照組和陰性對照組均未檢出大腸埃希菌,而試驗組檢出試驗菌,提示水合氯醛口服溶液的控制菌檢查方法適用性驗證合格。見表3。
2.6 水合氯醛口服溶液中國藥典2015年版微生物限度檢查
水合氯醛口服溶液微生物限度檢查結果:3批樣品的需氧菌總數均<1 cfu/mL(標準規定:不得超過102 cfu/mL);霉菌和酵母菌總數均<1 cfu/mL(標準規定不得超過101 cfu/mL)。大腸埃希菌1 mL中未檢出(標準規定:1 mL中不得檢出)。見表4。
3 討論
醫療機構制劑是醫療機構根據本單位的臨床需要,經批準后配制的自用藥品,是對市場藥品供應的有益補充,是臨床有使用需要,但市場上尚未供應的藥品[12]。微生物限度檢查是衡量藥物受污染程度的重要指標,與藥物的安全性有著密切的關系[13-14],微生物限度檢驗的方法也應隨著藥典的變化及時更新。與2010年版《中國藥典》比較,2015年版《中國藥典》在微生物限度檢查方法方面,結合現有國情,并借鑒歐美藥典先進經驗技術,在培養基的使用、菌種的選擇、回收率測定、計數方法等方面都做出了重大修行[15-19],并且,要求更為嚴格,確保檢驗結果更準確、更嚴謹,更傾向于與國際標準接軌[20]。根據2015年版《中國藥典》[5]規定,口服溶液劑應建立微生物限度檢查方法,并進行方法學驗證,以保證檢查方法的準確性和可靠性。因此,本文根據現行藥典的微生物限度檢查的相關要求,對我院20170704、20170705、20170706 3個批次的水合氯醛口服溶液進行了研究與驗證,經過平行試驗,建立了可靠、穩定的微生物限度檢查方法。本試驗試驗組菌落數回收率均在0.5~2.0范圍內,控制菌檢查大腸埃希菌合格。結果顯示,水合氯醛口服溶液微生物限度檢查方法學驗證合格,符合現行《中國藥典》(2015年版)[5]的要求,可為相關制劑的微生物方法驗證提供參考與借鑒。
[參考文獻]
[1] ?北京市食品藥品監督管理局.北京市醫療機構制劑規程:第一冊[M].北京:中國商業出版社,2014:142-143.
[2] ?王倩,許靜,季興.門診患兒安全應用水合氯醛鎮靜的經驗[J].藥學與臨床研究,2018,26(1):63-65.
[3] ?吳穎,王旭梅.水合氯醛用于嬰幼兒鎮靜的研究進展[J].實用臨床護理學電子雜志,2018,3(25):128-129.
[4] ?林曉芳.水合氯醛溶液院內用于兒童人群的規范化管理與風險防控探討[J].中國現代醫生,2018,56(16):109-111.
[5] ?國家藥典委員會.中華人民共和國藥典[M].四部.北京:中國醫藥科技出版社,2015:136-151.
[6] ?閔紅,楊曉莉,李翠,等.復方氯己定地塞米松膜微生物檢查方法學研究[J].中國抗生素雜志,2018,43(7):881-886.
[7] ?戴宇婷,倪兆武,侯晉芳.口服補液的微生物限度檢查方法學驗證[J].中國藥物經濟學,2017,12(2):20-22.
[8] ?田懷平,王玲,杜毅,等.射干合劑2015年版《中華人民共和國藥典》微生物檢查方法適用性研究[J].中國中醫藥信息雜志,2017,24(10):72-75.
[9] ?古麗巴哈爾·托乎提,艾山·艾比布勒,張明君,等.5種蒙藥醫院制劑微生物限度檢查方法建立及探討[J].食品安全質量檢測學報,2018,9(10):2522-2526.
[10] ?田懷平,林志燕,李超,等.兩種硫間苯二酚洗劑微生物限度檢查的方法建立及適用性研究[J].中國藥物應用與監測,2018,15(1):9-12.
[11] ?文玉輝,韓珍珍.11種醫院制劑微生物限度檢查方法驗證[J].臨床醫藥實踐,2015,24(10):763-765.
[12] ?岳毅樺.2012-2017年醫療機構制劑使用情況與發展趨勢[J].中國藥物經濟學,2018,13(10):28-31.
[13] ?宏偉,楊開金.藥品微生物限度檢查誤差分析及應對措施[J].北方藥學,2018,15(10):182-183.
[14] ?佘凡,許占鴿.藥品微生物限度檢驗誤差的影響因素及應對策略[J].中國衛生標準管理,2018,9(18):100-102.
[15] ?馮震,范一靈,楊美成.《中華人民共和國藥典(2015年版)》(四部)中微生物檢驗相關通則的增、修訂情況介紹[J].上海醫藥,2016,37(7):11-15.
[16] ?柴海毅.淺析微生物計數方法的回收率[J].醫藥工程設計,2013,34(1):30-31.
[17] ?由亞寧,陳雪芹,周志云,等.2005年版《中國藥典》和《歐洲藥典》菌落計數培養基比較[J].中國藥事,2010, 24(6):587-589.
[18] ?李紅.無菌、微生物限度及細菌內毒素檢查方法學驗證中常見問題及分析[J].全科口腔醫學雜志:電子版,2019, 6(2):26,30.
[19] ?李思,易偉,吳晶晶,等.不同中藥制劑微生物限度檢查方法學的研究[J].中國醫藥導報,2018,15(27):98-101.
[20] ?賈輝,姚東,王作君,等.《中國藥典》2010版與2015版微生物限度檢查法對兩種制劑檢測結果的比較研究[J].實用藥物與臨床,2019,22(2):169-173.
(收稿日期:2018-09-29 ?本文編輯:張瑜杰)

