短期重復口服雞α干擾素體內抑制H9N2亞型流感病毒復制
王萌,宋潔,范文輝,劉麗蓉,黃卓然,楊成程,吳昊,劉文軍,李晶
?
短期重復口服雞α干擾素體內抑制H9N2亞型流感病毒復制
王萌1,2,宋潔1,2,范文輝1,劉麗蓉1,2,黃卓然3,楊成程3,吳昊3,劉文軍1,2,李晶1,2
1 中國科學院微生物研究所 中國科學院病原微生物與免疫學重點實驗室,北京 100101 2 中國科學院大學,北京 100049 3 北京海淀外國語實驗學校,北京 100195
為研究口服雞α干擾素最佳的給藥頻率及與滅活病毒聯合使用對雞群的影響,文中將構建的原核表達質粒pET-22b-ChIFN-α轉入大腸桿菌BL21 (DE3),宿主菌經誘導表達收獲重組包涵體蛋白,經變性、純化、復性后獲得重組雞α干擾素。SDS-PAGE結果分析顯示,目的蛋白可在原核表達載體中高效表達,發酵液上清中目的蛋白濃度高達0.2 mg/mL,分子量約為20 kDa。將雞α干擾素稀釋至活性為2.5×104U/羽份,與滅活H9N2亞型流感病毒聯用以口服的方式免疫無特定病原 (SPF) 雞群,試驗結果表明,短期 (96 h) 重復免疫3次,雞α干擾素具有較好的安全性,可誘導雞群的外周血、脾臟及胸腺產生較高水平的抗病毒相關的誘導基因,攻毒結果顯示雞α干擾素使用次數為連續使用3–5 d雞群排毒率最低,體現出較好的抗流感病毒能力。本研究結果獲得了雞α干擾素的最佳免疫頻率及免疫時間,為干擾素的最佳臨床應用方法提供理論支撐。
雞α干擾素,H9N2亞型流感病毒,口服,短期重復
干擾素(Interferon,IFN) 是1957年英國學者Isaacs和Lindenmann利用雞胚絨毛尿囊膜研究流感病毒干擾現象時發現的[1]。它是一類重要的細胞因子,是由機體細胞受到病毒或其他誘生劑的作用而產生的一種分泌性糖蛋白,具有抑制細胞分裂、調節免疫、抗病毒、抗腫瘤等多種生物學活性[2],是生物體防御系統的重要組成部分。隨著我國養禽業的快速發展,各種禽類疫病的發生也逐漸增多,特別是禽流感的流行給養禽業造成了嚴重的經濟損失。禽流感是由A型流感病毒引起的一種禽類傳染病,禽流感亞型眾多,其中H9亞型流感病毒感染較為普遍[3],多表現為亞臨床感染,引起呼吸系統疾病、產蛋率下降或急性致死,當前主要應用疫苗預防該類疾病,由于流感毒株的變異,免疫失敗現象時有發生。隨著抗病毒化學藥品的禁用,將干擾素用于禽流感等病毒性疾病的治療藥物成為研究熱點。
與哺乳動物相似,大多數禽類基因組中亦發現3種干擾素基因有可注釋的基因組。雞的Ⅰ型干擾素 (IFN-α和IFN-β) 具有獨特的血清型,內含子較少,酸和熱穩定。與哺乳動物的干擾素不同,雞的IFN-α與哺乳動物的IFN-α全長相比只有24%的同源性,并且雞Ⅰ型干擾素編碼于Z性染色體上[4],Ⅰ型干擾素可被雞新城疫等病毒誘導大量產生。雞的Ⅱ型干擾素只有一個成員,即IFN-γ,調節免疫細胞的分化、成熟以及活性。不同于人有3種干擾素λ基因,雞只有一種Ⅲ型干擾素基因[5-6],雞的Ⅲ型干擾素目前發現與人類IFN-λ2具有相同的保守功能區,在上皮細胞和富含上皮的器官中表達量較高,其功能主要依賴于它的受體。
畜禽免疫的方式有多種,干擾素在臨床應用常分為口服和注射方式,口服給藥是一種較為便捷的投藥方式,口服給藥可以降低成本、副作用以及注射針頭可能帶來的血液傳染病的風險。并且畜禽的口腔、咽部及腸道的黏膜血管豐富,口腔黏膜上存在模式識別受體[7],可以識別結合干擾素α,從而刺激口腔黏膜免疫發揮作用。通過黏膜表面傳遞疫苗抗原會激活黏膜B細胞和T細胞,刺激sIgA抗體反應,有助于產生遠距離的黏膜免疫應答。同時雞的IFN-α耐酸,pH 2.0–10.0都很穩定,能有效誘導黏膜系統的特異性免疫力,干擾素在食道及胃腸道的生物學活性仍然存在,特別適合大規模養殖場,也可避免注射給藥帶來的應激反應。近年來,較多研究側重于干擾素誘導表達及純化方法的構建以及其活性的檢測,而探究如何高效地使用干擾素雞群以更好地抵抗流感病毒以及如何正確將干擾素用于臨床應用的報道并不多見。
為研究口服雞α干擾素最佳的給藥頻率及與滅活疫苗聯合使用對雞群的影響,本研究將構建的原核表達質粒pET-22b-ChIFN-α,轉入大腸桿菌BL21 (DE3) 宿主菌經誘導表達收獲重組包涵體蛋白,經變性、純化、復性后獲得重組雞α干擾素,將雞α干擾素稀釋至活性為2.5×104U/羽份,與滅活H9N2亞型流感病毒共同以口服的方式免疫SPF雞群,以期獲得最佳免疫頻率及最佳免疫時間,旨在為干擾素臨床應用的正確使用方法提供理論支撐。
1 材料與方法
1.1 質粒、菌、毒株及實驗動物
干擾素表達質粒pET-22b-ChIFN-α由本實驗室構建;大腸桿菌TOP10、BL21 (DE3) 由本實驗室保存;雞成纖維細胞 (DF-1)、犬腎細胞 (MDCK) 由本實驗室保存;SPF雞胚 (8日齡) 購自北京維通利華實驗動物技術有限公司;SPF白羽雞 (7日齡、8日齡) 購自濟南斯派福瑞禽業科技有限公司。H9亞型流感病毒A/Chicken/Taian/ 2013 (H9N2) 株 (TA株) 由青島蔚藍生物制品有限公司分離、鑒定及保存。
1.2 主要試劑與設備
Trizol Reagent購自美國賽默飛世爾科技公司;逆轉錄酶M-MLV、RNA酶抑制劑購自Promega公司;dNTPs、Oligo (dT) 和SYBR Premix ExTMkit購自大連寶生物有限公司;蛋白胨、酵母粉購自北京華博德億生物技術有限公司;蛋白預染Marker購自寶林科(北京) 生物科技有限公司;異丙基-β-D-硫代半乳糖苷(IPTG) 購自Promega。Scientz-ⅡD超聲波細胞破碎儀購自寧波新芝生物科技股份有限公司;AKTA purifier UPC10為美國GE公司生產;倒置顯微鏡產自重慶光電儀器有限公司;CO2培養箱產自日本三洋電機公司;HSP-160生化培養箱產自北京東聯哈爾儀器制造有限公司;7500實時定量PCR儀產自美國應用生物系統公司 (ABI);D1000高效組織細胞破碎儀購自湖北新縱科病毒疾病工程技術有限公司。本試驗所有引物由北京博邁德基因技術有限公司合成。
1.3 雞α干擾素的制備及活性測定
將重組質粒pET-22b-ChIFN-α轉化到大腸桿菌.BL21 (DE3) 中,涂平板,37 ℃過夜,挑取平板上長出的單菌落于5 mL按1︰1 000加入50 μg/mL氨芐(Amp+) 抗性的LB培養基中,將試管置于搖床上37 ℃、200 r/min培養至600值達0.5后,按1︰1 000加入1 mmol/L的IPTG誘導4 h。收集菌體,超聲 (400 W,超聲3 s,間歇4 s) 破菌后進行SDS-PAGE檢測目的蛋白表達情況,重組蛋白以包涵體形式存在。依次用PBS、2 mol/L尿素和1 mol/L NaCl溶液將表達產物各洗滌2遍,隨后加入6 mol/L鹽酸胍室溫下變性5 h至溶解,12 000 r/min 離心 15 min,分離出上清,加入3 mL的Ni-NTA agarose,旋轉儀上4 ℃旋轉結合4 h。以200 mmol/L咪唑洗脫目的蛋白,至考馬斯亮藍G-250蛋白檢測液不再變色。按1︰40將目的蛋白洗脫液逐滴加入復性液,確保整個過程中沒有沉淀析出,隨后靜置48 h。稀釋復性后的ChIFN-α經0.22 μm濾器過濾除菌,4 ℃保存,利用細胞病變抑制法測定重組雞α干擾素活性。
1.4 雞α干擾素口服疫苗的制備
測定H9N2病毒的血凝效價,無菌條件下用PBS溶液進行稀釋,若血凝效價≥26,按1︰1 000稀釋,若血凝效價<26,則按1∶100稀釋備用。取稀釋過的病毒200 μL注入SPF雞胚中,石蠟封口,將雞胚繼續放入培養箱中,37 ℃孵育3 d,每天翻轉2次,舍去24 h內死亡的雞胚。待雞胚孵育72 h后,取出置于4 ℃冰箱冷藏過夜,收獲雞胚尿囊液并進行無菌檢驗。按照1︰1 000的比例往尿囊液中加入經過0.22 μm微孔濾膜過濾過的甲醛溶液,隨后置于37 ℃搖床中50 r/min振蕩過夜,并根據血凝試驗檢測病毒血凝效價。取滅活后的病毒液加入剛傳代且狀態良好的MDCK細胞中培養,盲傳兩代后,取上層培養基進行血凝試驗檢測是否滅活完全。將雞α干擾素與滅活完全的病毒液混合,按照1︰1的比例制成口服候選疫苗LW001 (含2.5×104U/mL),用于口服免疫。同時設立滅活完全的病毒液陽性對照及PBS陰性對照組。
1.5 動物安全性試驗
每組選取1日齡和7日齡雛雞各10羽、5周齡雌性BALB/c小鼠10只、4月齡健康的雌性日本大耳白種兔6只,分別口服候選疫苗 (LW001) 0.3 mL和2 mL,觀察14 d,記錄局部反應和臨床癥狀。
1.6 SPF雞免疫試驗
將SPF雞隨機分為4組,每組26羽,試驗分組見表1,每羽雞免疫劑量為0.3 mL/只,口腔灌入,每隔48 h口服免疫一次。
分別在0 h、48 h、96 h及240 h每組隨機挑選4只SPF雞進行采樣,取外周血、脾臟、氣管及胸腺,剪取0.1 mg的組織塊,加入1 mL Trizol試劑,利用組織細胞破碎儀磨碎后放至離心管中研磨,使其充分裂解,?80 ℃保存備用。取外周血時按1︰1的比例加入抗凝劑后立即混勻,在離心管中按照1︰3的體積比加入Trizol試劑,總體積為1 mL;免疫時間點、免疫次數及采樣時間點見圖1。

表1 SPF雞分組免疫情況

圖1 免疫及采樣的試驗方案圖
1.7 熒光定量PCR測定體內干擾素誘導基因水平
將各時間段收獲樣品的總RNA用Oligo(dT) 引物進行反轉錄獲得cDNA,qPCR檢測IL-2、IL-12、CCR10、IFN-β、MHC-Ⅰ和GAPDH的mRNA水平,分別用表2中的引物進行擴增,以內參基因GAPDH作為對照。qPCR反應程序為:95 ℃預變性30 s;95 ℃ 5 s,60 ℃ 30 s,40個循環;60 ℃收集熒光。應用內參基因對校準樣本和待測樣本進行校正,進行相對定量檢測。
1.8 攻毒檢測SPF雞排毒率
口服給藥14 d后攻毒,TA株病毒液翅靜脈注射0.2 mL/只(105.0EID50/0.1mL),于攻毒第3、5、7日采集喉頭與泄殖腔棉拭子,處理后分別尿囊腔接種10–11日齡SPF雞胚5枚,0.2 mL/胚,孵育觀察5 d,逐胚測定雞胚液紅細胞凝集價,每個拭子樣品接種的5枚雞胚中,有1枚雞胚液的紅細胞凝集價不低于1︰16 (微量法),即判為病毒分離陽性,對病毒分離陰性的樣品,盲傳1次后再判定,計算排毒率。使用SPSS卡方檢驗對陽性率進行統計學分析,<0.01差異極顯著,<0.05差異顯著。
2 結果與分析
2.1 雞α干擾素表達純化及活性測定
通過SDS-PAGE、考馬斯亮藍染色、脫色液脫色后,可以發現目的蛋白(20 kDa) 在IPTG誘導下成功表達 (圖1A)。通過包涵體洗滌、分子篩純化后進行SDS-PAGE、考馬斯亮藍染色、脫色液脫色,結果如圖1B所示,雞α干擾素表達及純化結果較好。檢測活性結果顯示,根據在DF-1 (雞成纖維細胞) 上利用細胞病變抑制法檢測,利用Reed- Muench法計算,雞α干擾素的活性為106.5U/0.1 mL,即107.5U/mL,將其稀釋至2.5×104U/mL。

表2 qPCR引物序列表

圖2 雞α干擾素表達及純化結果
2.2 動物安全性檢測試驗
為了檢測雞α干擾素疫苗實驗室制品的安全性,分別給健康的雛雞、BALB/c小鼠及日本大耳白種兔接種候選疫苗,結果顯示,免疫的動物精神狀態、飲水、采食、糞便、注射局部等均無異常,無流感的臨床癥狀 (表3)。結果表明雞α干擾素以口服方式免疫實驗動物均是安全的。
2.3 口服雞α干擾素對雞群組織的影響
取8日齡的SPF雞,對雞群免疫5次,免疫間隔為48 h,并于0、48、96、240 h采集外周血、脾臟、胸腺,利用熒光定量PCR的方法檢測IL2、IL12、IFN-γ、MHC-Ⅰ、CCR10細胞因子的表達水平。
2.3.1 口服雞α干擾素對外周血的影響
雞外周血中干擾素及粘膜免疫相關細胞因子mRNA的表達水平如圖3所示。在免疫干擾素和滅活病毒后48 h (第2次口服免疫后),外周血中的細胞因子IL2、IL12、IFN-γ、CCR10及MHC-Ⅰ的mRNA表達均開始有上升趨勢,在96 h (第3次口服免疫后),上升趨勢達到高峰,在240 h時外周血中的細胞因子略微下降。結果顯示在96 h第3次口服干擾素后,與對照組相比,聯合使用干擾素與滅活病毒的試驗組 (LW001),IL2、IL12、IFN-γ及CCR10的mRNA的表達水平較單獨使用滅活病毒或單獨使用干擾素的mRNA表達水平高。各因子進行統計學分析得出,LW001組IL2的表達量與ChIFN-α組相比較,<0.05,兩組結果差異顯著;LW001組CCR10的表達量與ChIFN-α組相比較,<0.01,兩組在CCR細胞因子的mRNA表達水平上差異極顯著。結果說明短期多次聯合口服干擾素及滅活病毒,與抗病毒及天然免疫相關的細胞因子的表達水平較單獨給藥的對照組要高。

表3 雞α干擾素的動物安全性檢測
Clinical signs (?): alive without clinical symptoms.

圖3 短期口服干擾素外周血中細胞因子mRNA水平
2.3.2 口服雞α干擾素對胸腺的影響
雞胸腺中干擾素及粘膜免疫相關細胞因子mRNA的表達水平如圖4所示。在短期多次口服干擾素的試驗中,與對照組相比,第一次口服雞α干擾素疫苗后的第48 h時,只有IL12和IFN-γ細胞因子的mRNA表達水平上調,其他上調不明顯;第2次口服,在第96 h時,除IL-2和CCR10外,其余細胞因子mRNA水平均上調,LW001組中IFN-γ、MHC的mRNA表達水平與滅活病毒組相比差異極顯著 (<0.01),LW001組IL12的表達量與滅活病毒組相比差異顯著 (<0.05);在240 h時,細胞因子的mRNA表達量均有下降趨勢。結果得出,在較長期口服干擾素的試驗中,4 d時相比對照組,口服雞α干擾素疫苗,mRNA表達水平變化均有明顯的提高,持續2 d后開始下降。
2.3.3 口服雞α干擾素對脾臟的影響
雞脾臟中干擾素及粘膜免疫相關細胞因子mRNA的表達水平如圖5所示,脾臟的結果與外周血的結果相似。在短期重復口服干擾素的試驗中,與對照組相比,第一次口服雞α干擾素疫苗后,所有檢測的細胞因子mRNA水平在48 h表達量均上升;第2次口服雞α干擾素疫苗后,在96 h處,疫苗組的IL2、IL12、IFN-γ、MHC-I的mRNA的表達呈現顯著性上升水平;較長期口服雞α干擾素疫苗后,在第10天采樣檢測后得出,除IFN-γ仍持續保持高水平外,其余各組mRNA表達量均有下調趨勢。
2.4 攻毒后雞群排毒率檢測
免疫雞群4 d之后,使用H9亞型流感病毒進行攻毒試驗,于攻毒后的3、5、7 d采集拭子,在雞胚上利用EID50檢測其排毒率,攻毒結果見表4。
檢測其排毒量得出,短期重復使用雞α干擾素疫苗組 (96 h),在攻毒第3日排毒率為5/10,與攻毒對照組相比差異顯著 (<0.05),在攻毒第5日排毒率為2/10,雞群排毒率呈下降趨勢,與攻毒對照組相比差異極顯著 (<0.01),在攻毒第7日排毒率為2/10,雞群排毒率仍保持較低比例 (<0.01)。單獨使用滅活病毒組,效果不理想,與PBS組差異不顯著;單獨使用雞α干擾素組,排毒率最低的時間點也出現在96 h,顯示短期重復使用雞α干擾素也確實起到了抗病毒的作用,但效果沒有與滅活病毒聯用明顯。綜上LW001在連續使用96 h已達到保護效果,且使用效果優于其他對照組,因此為確保臨床使用效果,將LW001使用次數定為連續使用3–5 d。
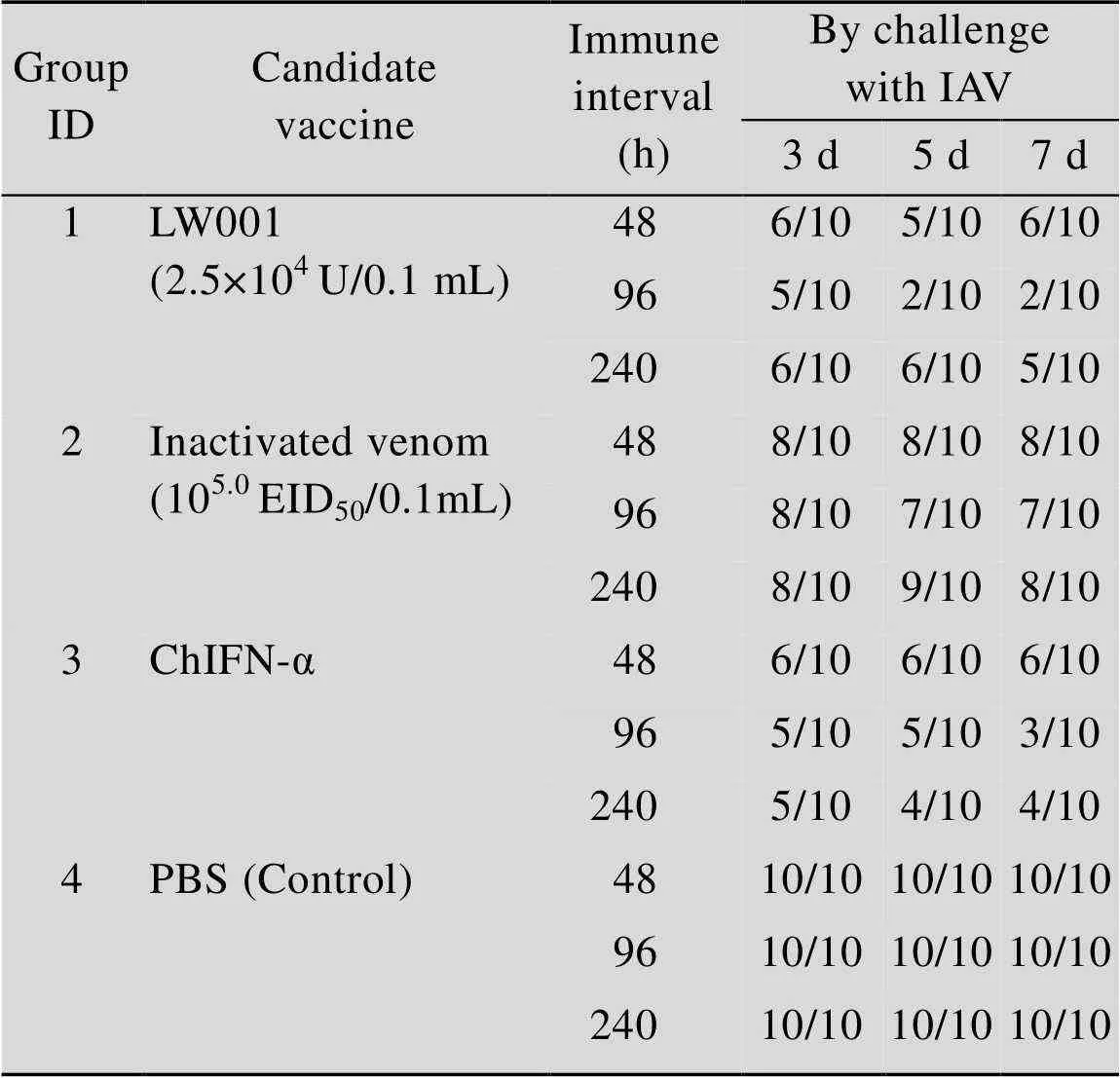
表4 攻毒后雞群排毒率檢測情況
3 討論
在動物的免疫調節中,細胞免疫與體液免疫無疑是最重要的。干擾素影響細胞免疫與體液免疫的同時其在免疫紊亂中也有一定的作用[8]。目前,干擾素α是首個批準的治療慢性乙型肝炎的藥物,干擾素α已被證明在促進肝內CD8-T淋巴細胞反應與全身Th1免疫反應方面有重要的作用[9]。其中,與細胞免疫相關的細胞因子有IL-2、IL-12、IFN-γ等,與體液免疫相關的細胞因子包括IL-4、IL-6、IL-12等。另外,CCR10則是對淋巴細胞歸巢中起作用的趨化因子受體,它們對淋巴細胞歸巢以及相應的記憶/效應淋巴細胞的分化起著重要作用。CCR10在各種類型的細胞中表達,如T細胞、黑素細胞和皮膚內皮細胞以及血液中的IgA型漿細胞。有研究表明將分化后的DC細胞暴露于Ⅰ型干擾素會誘導其MHC-Ⅰ、MHC-Ⅱ及共刺激因子的表達[10-12]。也有報道發現干擾素α可以促進人DC細胞的分化與活化[13-14],成熟的DC細胞可以產生促炎癥因子,如IL12等。Frydecka等[15]研究結果顯示干擾素α是促炎癥因子的潛在誘導劑,包括IL6。干擾素α通過JAK-STAT通路使接收干擾素信號的細胞內形成ISGF3復合物,該復合物誘導多種抗病毒基因的表達,如OAS、PKR等,并且有研究表明,雞干擾素α在細胞水平有較好的抗病毒作用[16],還有研究人員比較了各型干擾素的細胞活性,比較發現干擾素α的抗病毒活性最高[17]。文中側重于雞干擾素α作為免疫佐劑,作用于雞群的應用評價,采用短期重復的方案進行免疫雞群,檢測雞干擾素α與滅活毒疫苗聯用對雞的免疫調節作用及抗病毒作用。檢測了細胞因子在雞α干擾素滅活毒疫苗給藥后的表達情況,結果顯示與細胞免疫及與體液免疫緊密相關的細胞因子均顯著上升,說明口服雞α干擾素滅活毒疫苗可以調節雞的免疫水平,與先前文獻報道的結論相符,并對先前研究從臨床應用的角度加以補充。
據統計,約70%的病原體通過黏膜途徑進入宿主體內[18]。IAV的復制主要在呼吸道上皮細胞中完成。黏膜抗原的傳遞可以增強局部和全身的免疫反應,這為免疫提供了一種有利的途徑[19]。由于通過滴鼻的免疫途徑,單獨使用滅活病毒其免疫原性差[20-22],研究人員為了增強滅活病毒的免疫原性一般選取佐劑與其聯用。目前針對H9N2亞型流感病毒滅活疫苗的佐劑選擇有較多的研究,其中有以聚肌苷∶聚胞二酸(poly I︰C) 為佐劑的滅活疫苗,研究表明此疫苗可以快速提高抗體的水平并減少病毒滴度,其作用機制為上調Ⅰ型干擾素的產生并促進DC細胞的成熟與B細胞的活化,從而導致了CD4+T細胞與體液免疫應答[23-25]。文中以禽干擾素α作為佐劑與滅活病毒聯用,產生了較好的機體黏膜免疫應答。
在禽類的體內臟器中,脾臟為免疫穩態的重要器官,是反映先天免疫與適應性免疫反應是否發揮作用的臟器[26]。胸腺也是機體重要的免疫器官,它與免疫耐受、免疫反應以及免疫活性T細胞的產生密切相關。試驗結果表明雞α干擾素與滅活H9N2亞型流感病毒聯用在不同的免疫器官中可以引起不同的免疫調節,但是無論是外周血還是在脾臟和胸腺,均顯示以雞α干擾素為佐劑的滅活疫苗,較單獨服用干擾素或滅活病毒有更好的免疫性及抗病毒效果。另外,短期重復口服雞α干擾素滅活疫苗可以引起組織中免疫相關的細胞因子有規律的變化,細胞免疫密切相關IL2和IL12、傳遞抗原的重要分子MHC-Ⅰ[27]、巨噬細胞活化相關的IFN-γ[28]、黏膜免疫歸巢因子CCR10都明顯上調。這些mRNA的表達水平上調提示對應的蛋白會有可能上調,與抗病毒、免疫調節、細胞活化及免疫歸巢因子相關的基因轉錄水平上調,對應的蛋白會增強機體的免疫水平同時起到抗病毒作用。試驗數據顯示組織中大多細胞因子于96 h表達量最高,這與攻毒試驗中96 h時聯合用藥組排毒率最低的結果相符。當雞吸入干擾素α時,IL2和IL12促炎性因子的表達量上升,促進了適應性免疫的活化,機體的免疫應答處于動態平衡,機體也隨之產生抗炎機制以抵御炎癥的出現[29],因此細胞因子會呈現先升高隨后降低的規律性變化。
同時,脾臟是機體最大的血液過濾器[30],因此解釋了本試驗的研究數據,外周血與脾臟中細胞因子的表達量呈現相同變化趨勢的結果。根據本研究試驗數據,筆者建議家禽養殖場可通過每兩天給雞口服干擾素來增強雞的免疫能力。
文中將純化復性后的雞α干擾素作為免疫佐劑與滅活H9N2亞型流感病毒聯用,以口服的方式免疫SPF雞群。短期重復口服雞α干擾素后,雞群的外周血、脾臟及胸腺等體內產生較高的抗病毒相關基因的誘導表達,攻毒結果顯示雞α干擾素使用次數為連續使用3–5 d雞群排毒量最低,體現出較好的抗流感病毒能力。為了保證給藥完全,干擾素在免疫前24 h,雞群禁止飲水,免疫時按照100 mL/只的量計算出雞群一天需要的總飲水量,在雞場監控下保證雞群2 h內飲完。但目前雞α干擾素與病毒聯用劑型確定、佐劑種類對比、與抗原混勻條件等方面的優化工藝還未完善,另外,穩定性試驗、保存期試驗、批間重復性試驗等也將是后續工作的重點。
[1] Santhakumar D, Rubbenstroth D, Martinez-Sobrido L, et al. Avian interferons and their antiviral effectors. Front Immunol, 2017, 8: 49.
[2] Savan R, Ravichandran S, Collins JR, et al. Structural conservation of interferon gamma among vertebrates. Cytokine Growth Factor Rev, 2009, 20(2): 115–124.
[3] Schindler C, Levy DE, Decker T. JAK-STAT signaling: from interferons to cytokines. J Biol Chem, 2007, 282(28): 20059–20063.
[4] Goossens KE, Ward AC, Lowenthal JW, et al. Chicken interferons, their receptors and interferon-stimulated genes. Dev Comp Immunol, 2013, 41(3): 370–376.
[5] Karpala AJ, Morris KR, Broadway MM, et al. Molecular cloning, expression, and characterization of chicken IFN-λ. J Interferon Cytokine Res, 2008, 28(6): 341–350.
[6] Feller L, Altini M, Khammissa RAG, et al. Oral mucosal immunity. Oral Surg Oral Med Oral Pathol Oral Radiol, 2013, 116(5): 576–583.
[7] Srivastava A, Gowda DV, Madhunapantula SV, et al. Mucosal vaccines: a paradigm shift in the development of mucosal adjuvants and delivery vehicles. APMIS, 2015, 123(4): 275–288.
[8] Zdrojewicz Z, Pachura E, Pachura P. The thymus: a forgotten, but very important organ. Adv Clin Exp Med, 2016, 25(2): 369–375.
[9] Zhang Z, Zhang HF, Chen DW, et al. Response to interferon-α treatment correlates with recovery of blood plasmacytoid dendritic cells in children with chronic hepatitis B. J Hepatol, 2007, 47(6): 751–759.
[10] Crouse J, Kalinke U, Oxenius A. Regulation of antiviralT cellresponses by type Iinterferons. Nat Rev Immunol, 2015, 15(4): 231–242.
[11] Rouzaut A, Garasa S, Teijeira á, et al. Dendritic cells adhere to and transmigrate across lymphatic endothelium in response to IFN-α. Eur J Immunol, 2010, 40(11): 3054–3063.
[12] Parlato S, Santini SM, Lapenta C, et al. Expression of CCR-7, MIP-3β, and Th-1 chemokines in type I IFN-induced monocyte-deriveddendriticcells: importance for the rapid acquisition of potent migratory and functional activities. Blood, 2001, 98(10): 3022–3029.
[13] Aricò E, Belardelli F. Interferon-α as antiviral and antitumor vaccine adjuvants: mechanisms of action and response signature. J Interferon Cytokine Res, 2012, 32(6): 235–247.
[14] Santini SM, Lapenta C, Logozzi M, et al. Type I interferon as a powerful adjuvant for monocyte-derived dendritic cell development and activityand in Hu-PBL-Scid mice. J Exp Med, 2000, 191(10): 1777–1788.
[15] Frydecka D, Paw?owski T, Pawlak D, et al. Functional polymorphism in the interleukin 6 () gene with respect to depression induced in the course of interferon-α and ribavirin treatment in chronic hepatitis patients. Arch Immunol Ther Exp (Warsz), 2016, 64(S1): 169–175.
[16] Dai MM, Wu SY, Feng M, et al. Recombinant chicken interferon-alpha inhibits the replication of exogenous avian Leukosis virus (ALV) in DF-1 cells. Mol Immunol, 2016, 76: 62–69.
[17] Qu HR, Yang LM, Meng SS, et al. Thedifferentialantiviralactivitiesofchickeninterferonα (ChIFN-α) and ChIFN-β are related to distinctinterferon-stimulated gene expression. PLoS ONE, 2013, 8(3): e59307.
[18] Woodrow KA, Bennett KM, Lo DD. Mucosal vaccine design and delivery. Annu Rev Biomed Eng, 2012, 14: 17–46.
[19] Kang SM, Guo LZ, Yao QZ, et al. Intranasal immunization with inactivated influenza virus enhances immune responses to coadministered simian-human immunodeficiency virus-like particle antigens. J Virol, 2004, 78(18): 9624–9632.
[20] Akbari O, DeKruyff RH, Umetsu DT. Pulmonary dendritic cells producing IL-10 mediate tolerance induced by respiratory exposure to antigen. Nat Immunol, 2001, 2(8): 725–731.
[21] Hagenaars N, Mastrobattista E, Glansbeek H, et al. Head-to-head comparison of four nonadjuvanted inactivated cell culture-derived influenza vaccines: effect of composition, spatial organization and immunization route on the immunogenicity in a murine challenge model. Vaccine, 2008, 26(51): 6555–6563.
[22] Tseng LP, Chiou CJ, Chen CC, et al. Effect of lipopolysaccharide on intranasal administration of liposomal Newcastle disease virus vaccine to SPF chickens. Vet Immunol Immunopathol, 2009, 131(3/4): 285–289.
[23] Zhang AG, Lai HZ, Xu JH, et al. Evaluation of the protective efficacy of poly I:C as an adjuvant for H9N2 subtype avian influenza inactivated vaccine and its mechanism of action in ducks. PLoS ONE, 2017, 12(1): e0170681.
[24] Swayne DE. Avian influenza vaccines and therapies for poultry. Comp Immunol Microbiol Infect Dis, 2009, 32(4): 351–363.
[25] Tang YH, Lu JH, Wu PP, et al. Inactivated vaccine with adjuvants consisting of pattern recognition receptor agonists confers protection against avian influenza viruses in chickens. Vet Microbiol, 2014, 172(1/2): 120–128.
[26] Vignali DAA, Kuchroo VK. IL-12 family cytokines: immunological playmakers. Nat Immunol, 2012, 13(8): 722–728.
[27] Gainey MD, Rivenbark JG, Cho H, et al. Viral MHC class I inhibition evades CD8+T-cell effector responsesbut not CD8+T-cell priming. Proc Natl Acad Sci USA, 2012,109(47): E3260–3267.
[28] Schroder K, Hertzog PJ, Ravasi T, et al. Interferon-γ: anoverviewofsignals, mechanismsandfunctions. J Leukoc Biol, 2004, 75(2): 163–189.
[29] Chen Z, Bozec A,Ramming A, et al. Anti-inflammatoryand immune-regulatorycytokinesinrheumatoidarthritis. Nat Rev Rheumatol, 2019, 15(1): 9–17.
[30] Mebius RE, Kraal G. Structure and function of the spleen. Nat Rev Immunol, 2005, 5(8): 606–616.
Inhibition of the replication of H9N2 influenza virusby short-term repeated oral administration of chicken interferon α
Meng Wang1, 2, Jie Song1, 2, Wenhui Fan1, Lirong Liu1, 2, Zhuoran Huang3, Chengcheng Yang3, Hao Wu3, Wenjun Liu1, 2, and Jing Li1, 2
1 Key Laboratory of Pathogenic Microbiology and Immunology, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China 2 University of Chinese Academy of Sciences, Beijing 100049, China 3 Beijing Haidian Foreign Language Experiment School, Beijing 100195, China
To evaluate the optimal administration frequency for interferon-α (IFN-α) and the effect of its combined use with inactive virus on chicken flocks, the prokaryotic expression plasmid pET-22b-ChIFN-α was constructed and transferred intoBL21(DE3) host bacteria to induce the expression of chicken IFN-α and to harvest recombinant proteins inclusion bodies. The expression of recombinant chicken IFN-α was confirmed by SDS-PAGE, and the results demonstrated that the chicken IFN-α (20 kDa) was highly expressed using the prokaryotic expression vector with a concentration of 0.2 mg/mL in the medium. Chicken IFN-α was diluted to 2.5×104U/fowls and administered to immunized specific-pathogen-free chickens orally in combination with inactivated H9N2 subtype influenza virus. Chicken that received chicken IFN-α were safe after three repeated immunizations (96 h). In addition, chicken IFN-α could induce higher levels of antiviral-related inducible genes in peripheral blood, spleen, and thymus of chicken flocks. The results of a challenge assay revealed that the lowest detoxification rates of chicken IFN-α ranged from three to five days, suggesting a higher capacity to resist H9N2 subtype avian influenza virus. The present study obtained the optimal immune frequency and immunization period for chicken IFN-α to provide theoretical support for the optimal clinical application of IFN-α.
chicken interferon α, H9N2 influenza viruses, oral administration, short-term repeated
November 28, 2018;
March 19, 2019
National Key Research and Development Program of China (No. 2017YFD051105), Youth Innovation Promotion Association of CAS (No. 2019091).
Wenjun Liu. Tel: +86-10-64807497; Fax: +86-10-64807503; E-mail: liuwj@im.ac.cn
Jing Li. Tel/Fax: +86-10-64807503; E-mail: lj418@im.ac.cn
國家重點研發計劃 (No. 2017YFD051105),中國科學院青年促進人才項目 (No. 2019091) 資助。
10.13345/j.cjb.180490
王萌, 宋潔, 范文輝, 等. 短期重復口服雞α干擾素體內抑制H9N2亞型流感病毒復制. 生物工程學報, 2019, 35(6): 1029–1040.
Wang M, Song J, Fan WH, et al. Inhibition of the replication of H9N2 influenza virusby short-term repeated oral administration of chicken interferon α. Chin J Biotech, 2019, 35(6): 1029–1040.
(本文責編 郝麗芳)

