大腸桿菌FtsZ蛋白原核表達及多克隆抗體的制備與鑒定
陳云雨,牛夏憶,李淼,李霓,劉曉平
?
大腸桿菌FtsZ蛋白原核表達及多克隆抗體的制備與鑒定
陳云雨1,牛夏憶1,李淼1,李霓2,劉曉平1
1 皖南醫學院 藥物篩選與評價研究所,安徽 蕪湖 241002 2 中國醫學科學院-北京協和醫學院 藥物研究所 天然藥物活性物質與功能國家重點實驗室,北京 100050
為制備特異性抗大腸桿菌絲狀熱敏蛋白Z (filamentous thermosensitive protein Z,Ec-FtsZ)多克隆抗體,將基因進行化學合成后連接pET-22b(+) 表達載體,構建重組質粒Ec-FtsZ-pET-22b(+)。將重組質粒轉化到大腸桿菌.BL21(DE3) 中進行Ec-FtsZ原核表達與表達條件優化,以HisTrap層析柱進行Ec-FtsZ的分離純化,再以孔雀綠法進行Ec-FtsZ GTPase (Guanosine triphosphatase) 活性測定。使用純化的Ec-FtsZ為抗原免疫大鼠制備多克隆抗體,經酶聯免疫吸附測定實驗 (Enzyme-linked immunosorbent assay,ELISA)、Western blotting實驗和免疫熒光實驗鑒定,抗Ec-FtsZ多克隆抗體效價可達1∶256 000且具有良好的抗原特異性。抗Ec-FtsZ多克隆抗體的成功制備為Ec-FtsZ生物學功能研究和生化檢測奠定了實驗基礎。
大腸桿菌FtsZ蛋白,原核表達,孔雀綠法,免疫熒光,多克隆抗體
大腸桿菌細胞骨架蛋白FtsZ (filamentous thermosensitive protein Z,Ec-FtsZ) 是細菌細胞分裂所必需的調控蛋白,其生物學功能與微管蛋白極其相似,被認為是微管蛋白的同源蛋白[1-2]。Ec-FtsZ具有GTPase (Guanosine triphosphatase) 活性,在GTP存在條件下,Ec-FtsZ可在細菌內膜中心聚集形成多聚體,進而形成可收縮的Z環 (Z ring)。Z環形成后,其他分裂調控蛋白陸續結合到Z環骨架上形成分裂體。分裂體通過提供細菌細胞縊縮力和酶活力使Z環縮小以形成隔膜,完成細菌細胞的二分裂過程[3-7]。由于FtsZ在大多數致病菌細胞分裂過程中發揮高度保守的調控作用,細菌的FtsZ與真核生物微管蛋白結構差異較大且不易突變,其已成為抗感染藥物開發的理想靶標之一[4,7-8]。因此,深入研究Ec-FtsZ在大腸桿菌Z環形成和定位中的調控功能對新型抗耐藥菌藥物研發具有重要意義。
Ec-FtsZ雖是組成細菌分裂體的核心蛋白,但目前對Ec-FtsZ如何調控其他分裂調控蛋白募集到Z環形成細菌分裂體的調控機制研究還不甚深入,尤其是Z環在細菌內膜精準定位的分子機制尚未明確。為了進一步探討Ec-FtsZ上述生物學功能,本研究利用DNA重組技術原核表達和分離純化了高活性的Ec-FtsZ,并制備了高效價和特異性的大鼠抗Ec-FtsZ多克隆抗體 (Polyclonal antibody,PcAb),為Ec-FtsZ生物學功能研究和生化檢測奠定實驗基礎。
1 材料與方法
1.1 材料
pET-22b(+) 質粒由北京師范大學化學學院化學生物學系鄭積敏教授惠贈;大腸桿菌感受態細胞.Rosetta(DE3)、.BL21(DE3)、.BL21(DE3) pLysS、Ⅰ、Ⅰ、Trans 2K?DNA Marker和ProteinRuler?Ⅱ購自北京全式金生物技術有限公司;酵母粉、瓊脂粉、胰蛋白胨購自Oxoid公司;二辛可寧酸 (Bicinchoninic acid,BCA) 蛋白濃度測定試劑盒購自Thermo公司;異丙基硫代半乳糖苷 (Isopropyl β-D-thiogalactoside,IPTG)、GTP (Guanosine triphosphate)、氨芐西林、Freund完全佐劑和Freund不完全佐劑購自Sigma公司;小鼠抗組氨酸 (Histidine,His) 標簽單克隆抗體、辣根過氧化物酶 (Horseradish peroxidase,HRP) 標記的山羊抗小鼠IgG、HRP-山羊抗大鼠IgG、異硫氰酸熒光素 (Fluorescein isothiocyanate,FITC) 標記的山羊抗大鼠IgG購自Boster公司;TanonTM化學發光液購自上海天能科技有限公司;牛血清白蛋白 (Bovine serum albumin,BSA)、四甲基聯苯胺 (3,3?,5,5?-Tetramethylbenzidine,TMB) 溶液購自北京索萊寶科技有限公司;半底96孔透明板、96孔酶標板購自Corning公司;HisTrap層析柱購自GE公司;BIOMOL?GREEN購自Enzo Biochem公司;Wistar大鼠購自維通利華公司;其他生化試劑為國產分析純試劑。
1.2 方法
1.2.1 Ec-FtsZ原核表達質粒的構建與鑒定
在NCBI數據庫中檢索大腸桿菌全長基因序列 (GenBank登錄號:CP023258.1),在該基因序列兩端分別設計Ⅰ和Ⅰ酶切位點后進行全基因合成。將合成的基因片段插入pET-22b(+)表達載體,構建重組質粒Ec-FtsZ-pET-22b(+),以雙酶切法進行鑒定。基因片段合成和測序由General Biosystems公司完成。
1.2.2 Ec-FtsZ原核表達
將重組質粒Ec-FtsZ-pET-22b(+)轉化到.BL21(DE3)感受態細胞,涂布于LB固體培養基 (含100 μg/mL氨芐西林),37 ℃培養過夜。隨機挑取6個單菌落接種至含有100 μg/mL氨芐西林的LB液體培養基中,以1 mmol/L IPTG為誘導劑,30 ℃誘導10 h,誘導Ec-FtsZ表達。以10% SDS-PAGE檢測Ec-FtsZ原核表達情況。
1.2.3 Ec-FtsZ最適誘導時間的確定
將上述工程菌接種至含有100 μg/mL氨芐西林的LB液體培養基,37 ℃培養至菌體600=0.8時,加入1.0 mmol/L IPTG,誘導溫度分別設置為30 ℃、25 ℃和20 ℃誘導Ec-FtsZ表達,在2、4、6、8、10和12 h時間點等量收集菌體,以10% SDS-PAGE檢測Ec-FtsZ表達情況,利用Clinx Image Analysis軟件分析Ec-FtsZ表達量。
1.2.4 Ec-FtsZ最適誘導溫度的確定
等量收集20 ℃、25 ℃和30 ℃條件下誘導培養6 h的菌體,收集的菌體用TBS (50 mmmol/L Tris、150 mmol/L NaCl,pH8.0) 溶液重懸,以超聲波破碎菌體,離心收集裂解后的上清液和沉淀,以10% SDS-PAGE檢測Ec-FtsZ的可溶性表達情況。
1.2.5 Ec-FtsZ最適IPTG誘導濃度的確定
工程菌于37 ℃培養至600=0.8時,加入不同濃度的IPTG分別于25 ℃誘導6 h,IPTG濃度設置為0.2、0.4、0.6、0.8和1.0 mmol/L。等量收集菌體,以10% SDS-PAGE檢測不同IPTG誘導濃度對Ec-FtsZ表達的影響。
1.2.6 Ec-FtsZ分離純化與鑒定
誘導后的工程菌經超聲波破碎后取上清液,以25%飽和硫酸銨溶液沉淀制備粗提液。按照文獻所述方法進行Ec-FtsZ的分離純化[4]。純化的Ec-FtsZ以TBS溶液透析,再以BCA法測定蛋白濃度。
純化的Ec-FtsZ經10% SDS-PAGE后轉膜,一抗為小鼠抗His標簽單抗 (1∶2 000),二抗為HRP-羊抗小鼠IgG (1∶4 000),以TanonTM化學發光液成像。
1.2.7 Ec-FtsZ GTPase活性測定
參考相關文獻[4,9-10],首先將0.1 mol/L GTP溶液以反應液 (50 mmol/L Tris、5 mmol/L MgCl2,pH 8.0) 進行2倍倍比稀釋,共制備7個濃度梯度樣品 (2–0.031 mmol/L)。上述GTP稀釋液以25 μL/孔依次加入到含10 μmol/L Ec-FtsZ (25 μL/孔) 的半底96孔透明板中,每個濃度設置3組復孔,室溫孵育20 min。依次加入孔雀綠試劑 (50 μL/孔),室溫反應5 min,以多功能酶標儀檢測620值 (CytationTM5,BioTek)。將10 μmol/L BSA反應組設為陰性對照組。根據磷酸標準曲線計算酶促反應中自由磷酸 (Pi) 的釋放量和Ec-FtsZ GTPase活性 (nmol/(min·mg Ec-FtsZ))。
1.2.8 抗Ec-FtsZ多克隆抗體的制備
改進文獻所述方法免疫大鼠制備抗Ec-FtsZ多克隆抗體[11-12]。首次免疫時,將Ec-FtsZ (200 μg/(次·只)) 與等體積Freund完全佐劑混合,充分乳化后進行Wistar大鼠皮下多點注射。首次免疫3周后進行第2次免疫,用Freund不完全佐劑充分乳化后的Ec-FtsZ進行皮下注射。第2次免疫后的第7 天,從大鼠尾尖部少量采血后分離血清,以ELISA法進行效價測定。當抗血清效價達到1∶70 000,則從全血中分離抗血清備用。
1.2.9 抗Ec-FtsZ多克隆抗體效價測定
按照文獻所述方法進行抗Ec-FtsZ多克隆抗體效價測定[12]。首先將Ec-FtsZ (10 μg/mL) 以100 μL/孔包被至96孔酶標板,酶標板經10% BSA封閉后,依次加入以2倍倍比稀釋法稀釋的共11個濃度梯度的大鼠抗血清 (1∶1 000–1∶1 024 000;100 μL/孔),每組3個復孔,以相同稀釋倍數的大鼠免疫前血清作為陰性對照組,室溫孵育1 h。酶標板經HRP-羊抗大鼠IgG (1∶4 000) 孵育和TMB顯色后,以多功能酶標儀測定450值。S/N=稀釋抗血清/陰性對照組,判定S/N≥3.0的樣品為陽性樣品。
1.2.10 抗Ec-FtsZ多克隆抗體抗原特異性鑒定
純化的Ec-FtsZ (1、2、4 μg) 經10% SDS-PAGE后轉膜,一抗為大鼠抗Ec-FtsZ多克隆抗體 (1∶10 000),二抗為HRP-羊抗大鼠IgG (1∶4 000),以TanonTM化學發光液成像。
以煮沸法裂解大腸桿菌.BL21(DE3)、.BL21(DE3) pLysS和.Rosetta (DE3)細胞,同法檢測細胞裂解液中的內源Ec-FtsZ。
1.2.11 免疫熒光實驗分析Ec-FtsZ亞細胞定位
將大腸桿菌.BL21(DE3)細胞以2.5%多聚甲醛和0.04%戊二醛固定后,以含0.3% Tween-20的PBS (Phosphate buffered saline) 溶液 (PBST) 洗滌3次。經10% BSA封閉2 h后,依次加入大鼠抗Ec-FtsZ多克隆抗體 (1∶10 000) 和FITC-山羊抗大鼠IgG (1∶100),室溫孵育45 min,PBST洗滌3次,以熒光顯微鏡 (Life EVOS) 觀察Ec-FtsZ的亞細胞定位。
2 結果與分析
2.1 Ec-FtsZ原核表達質粒的鑒定
用Ⅰ和Ⅰ酶切構建的重組質粒Ec-FtsZ-pET-22b(+),得到了約1 152 bp的基因片段,其大小與基因片段理論值一致 (圖1),表明成功構建了重組質粒Ec-FtsZ-pET-22b(+)。
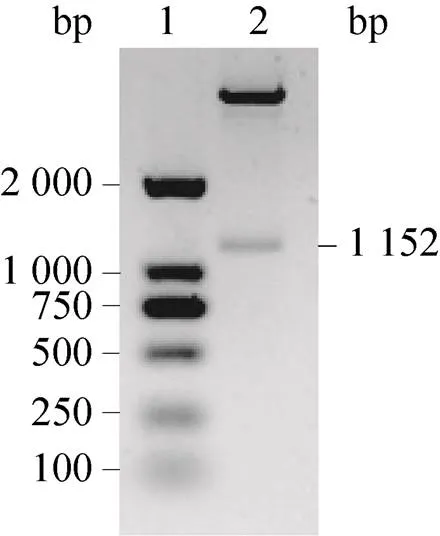
圖1 重組質粒Ec-FtsZ-pET-22b(+)的雙酶切鑒定
2.2 Ec-FtsZ的原核表達
6株工程菌經IPTG誘導培養后,收集的菌體經10% SDS-PAGE分析表明,在Ec-FtsZ理論分子量位置 (42 kDa) 可見明顯的蛋白表達條帶 (圖2),這說明成功進行了Ec-FtsZ原核表達。
2.3 Ec-FtsZ最適誘導時間的確定
工程菌以不同的誘導時間培養后,等量收集菌體,以10% SDS-PAGE鑒定Ec-FtsZ表達情況。在誘導溫度為30 ℃ (圖3A)、25 ℃ (圖3B) 和20 ℃ (圖3C) 時,Ec-FtsZ均明顯表達。以上述誘導溫度分別誘導工程菌6 h,Ec-FtsZ表達量均達30%,趨于蛋白表達量最高峰。因此確定Ec-FtsZ在30 ℃、25 ℃和20 ℃誘導時,其最適誘導時間為6 h。
2.4 Ec-FtsZ最適誘導溫度的確定
等量收集30 ℃、25 ℃、20 ℃誘導6 h的菌體,菌體裂解上清液和沉淀經10% SDS-PAGE分析表明,與30 ℃誘導6 h時相比,25 ℃和20 ℃誘導6 h時,Ec-FtsZ包涵體量明顯減少,目的蛋白大部分在上清中呈可溶表達 (圖4)。因此確定Ec-FtsZ最適誘導溫度為25 ℃。

圖2 Ec-FtsZ的原核表達
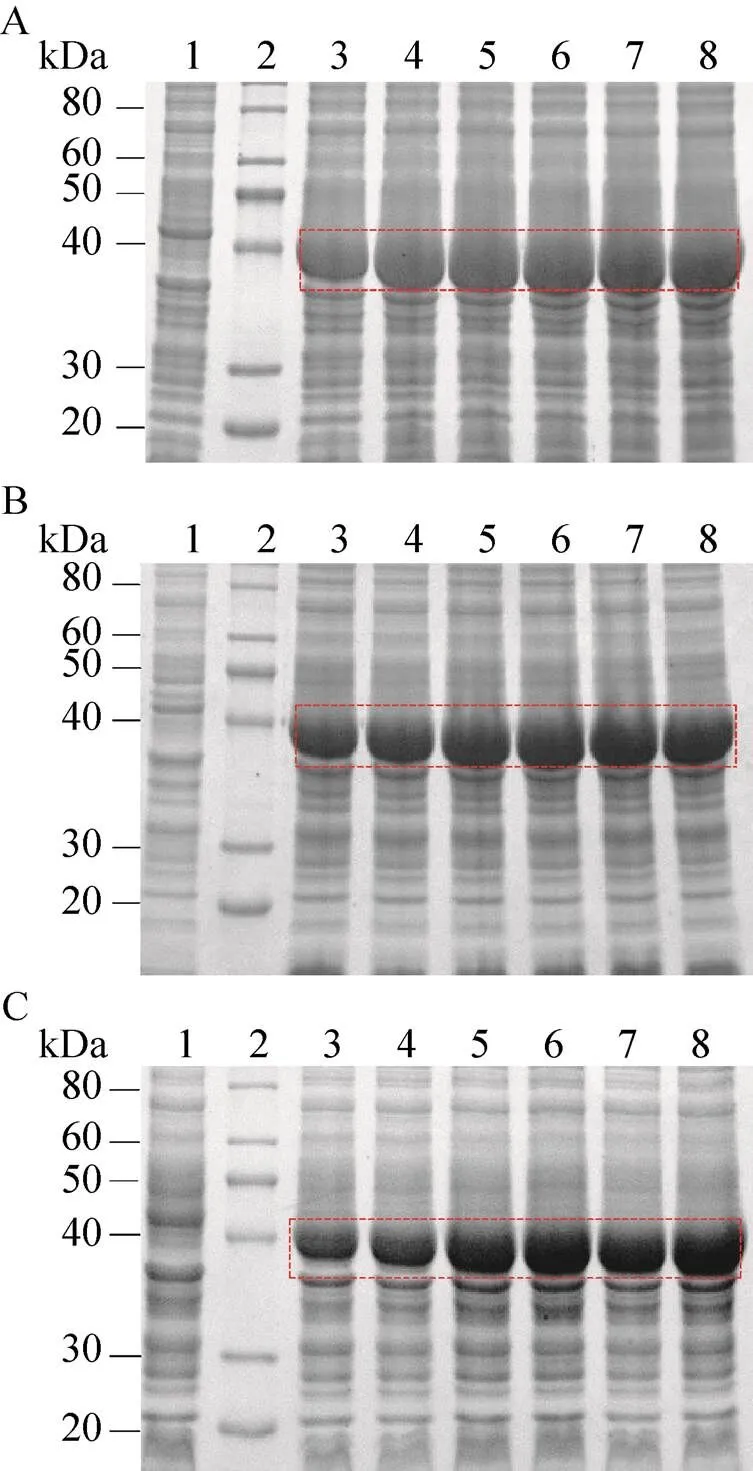
圖3 Ec-FtsZ最適誘導時間的確定
2.5 Ec-FtsZ最適IPTG誘導濃度的確定
SDS-PAGE結果表明,IPTG對Ec-FtsZ表達的誘導效率較高,0.2 mmol/L IPTG即可誘導Ec-FtsZ大量表達 (圖5)。
綜上所述,以0.2 mmol/L IPTG于25 ℃誘導6 h作為Ec-FtsZ最適表達條件。

圖4 Ec-FtsZ最適誘導溫度的確定

圖5 Ec-FtsZ最適IPTG誘導濃度的確定
2.6 Ec-FtsZ的分離純化與鑒定
工程菌菌體裂解上清液首先用25%飽和硫酸銨溶液沉淀后制備粗提液,粗提液經過濾后再以HisTrap層析柱進行分離純化。SDS-PAGE結果顯示,在相對分子量42 kDa左右呈單一蛋白條帶,說明獲得了具有較高純度的Ec-FtsZ (圖6A)。Western blotting實驗證實了Ec-FtsZ的正確表達 (圖6B)。BCA法測定純化的Ec-FtsZ濃度為1.3 mg/mL。
2.7 Ec-FtsZ GTPase活性測定
Ec-FtsZ具有GTPase活性,能夠水解GTP為GDP和自由磷酸 (Pi)。孔雀綠試劑能與Pi結合形成綠色復合物,且復合物量與620值呈正相關,故此可以用反應體系Pi釋放量反映Ec-FtsZ GTPase活性[4,9]。孔雀綠法酶活性測定實驗表明,與BSA對照組相比,隨著GTP濃度的不斷升高,Ec-FtsZ GTPase活性越來越強,最大酶活力可達6 nmol/ (min·mg Ec-FtsZ) (圖7)。
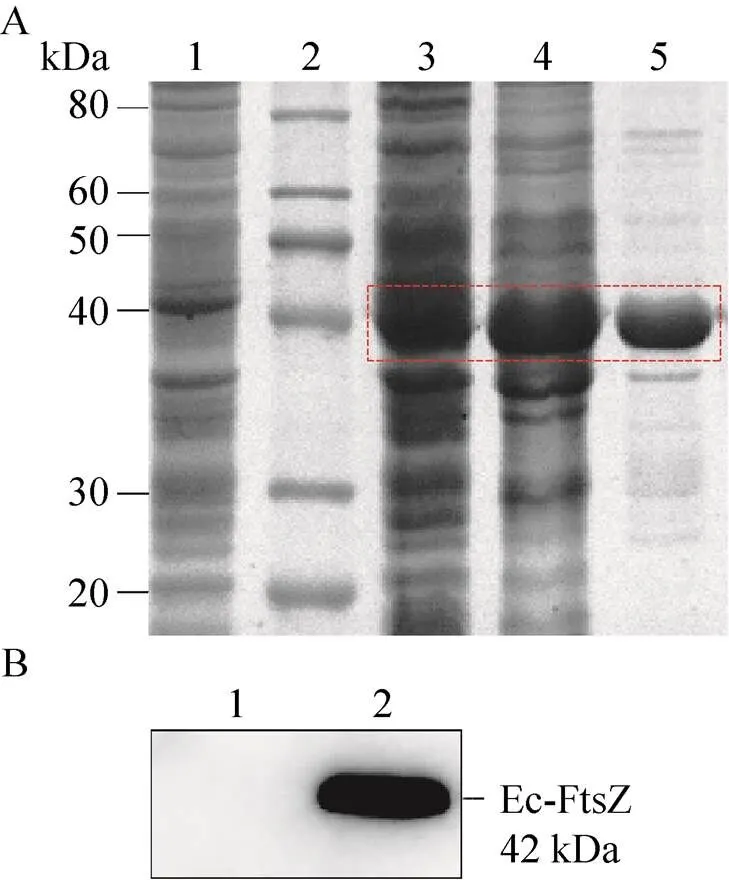
圖6 Ec-FtsZ的分離純化與鑒定
2.8 抗Ec-FtsZ多克隆抗體的制備與效價測定
以純化的Ec-FtsZ為抗原免疫大鼠,在第2次加強免疫后第7天抗體滴度基本達到峰值。當抗血清稀釋至256 000倍時,S/N值為3.15,抗Ec-FtsZ多克隆抗體效價可達1∶256 000 (圖8),這表明純化的Ec-FtsZ具有良好的免疫原性,制備的抗Ec-FtsZ多克隆抗體具有較高的滴度。
2.9 抗Ec-FtsZ多克隆抗體的抗原特異性鑒定
將抗Ec-FtsZ多克隆抗體 (1∶10 000) 作為一抗,分別與純化的Ec-FtsZ和大腸桿菌內源Ec-FtsZ反應,以Western blotting實驗檢測其抗原特異性。結果顯示,純化的Ec-FtsZ在相對分子量42 kDa左右顯現特異條帶,條帶亮度與Ec-FtsZ劑量呈正相關 (圖9A)。另外,在大腸桿菌BL21(DE3)、BL21(DE3) pLysS 和Rosetta (DE3)細胞裂解液中也同樣檢測到了相同分子量的特異條帶 (圖9B)。綜上所述,抗Ec-FtsZ多克隆抗體不僅可以識別純化的Ec-FtsZ,還可以特異性結合大腸桿菌內源Ec-FtsZ,其具有良好的抗原特異性。
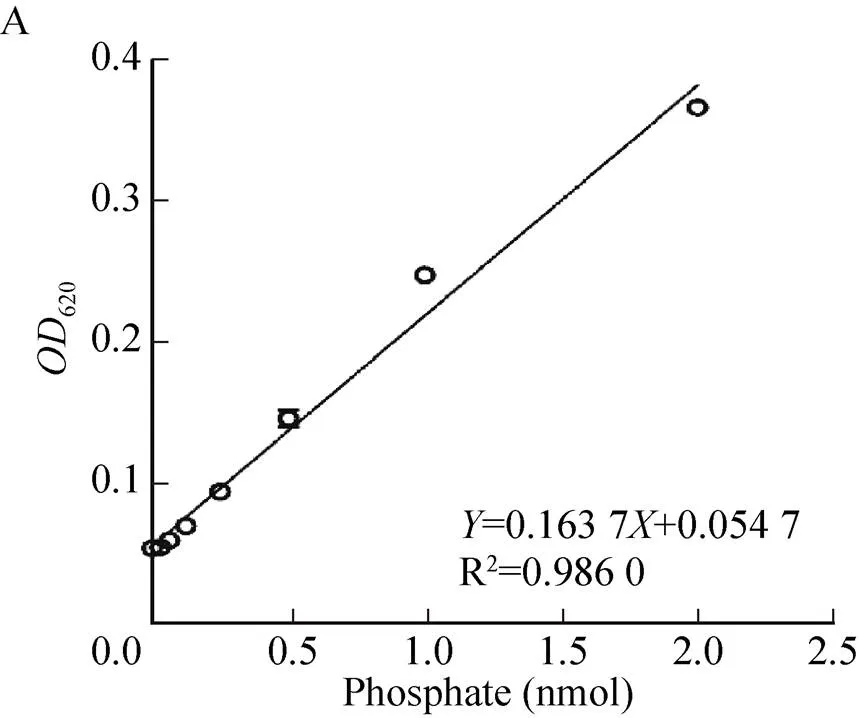

圖8 ELISA檢測抗Ec-FtsZ多克隆抗體效價
2.10 大腸桿菌Ec-FtsZ的亞細胞定位
通過熒光顯微鏡觀察,使用大鼠抗Ec-FtsZ多克隆抗體為一抗,以免疫熒光實驗分析大腸桿菌Ec-FtsZ亞細胞定位。結果表明,綠色熒光 (Ec-FtsZ) 主要分布于大腸桿菌細胞內膜的中心,這說明Ec-FtsZ主要定位于細菌細胞內膜中心即Z環位置,參與大腸桿菌細胞分裂的調控 (圖10)。
3 討論
大腸桿菌FtsZ是細菌分裂過程中重要的調控蛋白,其通過GTP依賴的自組裝形成多聚體,促進細菌分裂體和Z環結構形成以調控細菌細胞分裂、FtsZ相對保守的細菌分裂調控模式已成為新型抗感染藥物開發的理想靶標之一[4,7-10,13-16]。深入研究Ec-FtsZ在大腸桿菌分裂過程中的調控功能,尤其是調控細菌分裂體形成和Z環內膜定位的分子機制,對未來新型抗耐藥菌細胞分裂抑制劑研發具有重要意義。特異性抗體對研究蛋白質生物學功能和生化檢測具有重要作用,但目前還未有抗Ec-FtsZ抗體商品化銷售,因此制備特異性抗Ec-FtsZ抗體對Ec-FtsZ生物學功能深入研究和生化檢測具有重要意義。

圖9 Westernblotting鑒定抗Ec-FtsZ多克隆抗體的抗原特異性

圖10 免疫熒光實驗分析Ec-FtsZ的亞細胞定位(×60)
多克隆抗體雖特異性不如單克隆抗體,但其生產過程簡便、成本低廉且產量較大,因此是抗體制備的重要選擇之一。諸多研究者將大腸桿菌原核表達的重組蛋白作為抗原免疫實驗動物 (如大鼠、小鼠、新西蘭大白兔等),成功制備了多種特異性多克隆抗體用于實驗研究[11-12,17-20]。本研究將基因片段克隆至pET-22b(+) 表達載體中,構建了重組質粒Ec-FtsZ-pET-22b(+)。利用pET-22b(+) 的His標簽羧基端融合表達策略,成功進行了Ec-FtsZ原核表達與分離純化。由于誘導時間、誘導溫度與IPTG濃度是影響重組蛋白原核表達的重要因素[21-24],為了提高Ec-FtsZ表達量并節約實驗成本,筆者對其原核表達條件進行了系統優化。Ec-FtsZ原核表達優化實驗顯示,不同的誘導溫度對其原核表達的影響較大。30 ℃誘導時,Ec-FtsZ易于形成包涵體;25 ℃和20 ℃低溫誘導時,大部分Ec-FtsZ以可溶形式表達,這可能與低溫狀態下蛋白表達速度緩慢并促進其正確折疊有關[24-25]。25 ℃誘導6 h時,Ec-FtsZ表達量可達30%并趨于穩定,故此以25 ℃誘導 6 h作為Ec-FtsZ最適表達條件。IPTG作為原核表達的誘導劑,其對Ec-FtsZ表達的誘導效率很高,0.2 mmol/L IPTG即可誘導Ec-FtsZ大量表達。
高活性的Ec-FtsZ制備對于多克隆抗體制備和體外生物學功能研究具有重要意義。孔雀綠法是FtsZ GTPase活性檢測的經典方法[4,9-10],主要通過檢測反應體系中自由磷酸濃度以反映酶的活性。該方法具有一步反應、操作簡便、檢測靈敏和成本低廉等諸多優點,不僅可以用于酶活性檢測,還可以用于Ec-FtsZ GTPase抑制劑的高通量篩選。文中利用上述方法對Ec-FtsZ GTPase活性進行了測定,證實了純化的Ec-FtsZ具有良好的GTPase活性。
將純化的Ec-FtsZ作為抗原免疫大鼠制備多克隆抗體,以ELISA實驗、Western blotting實驗和免疫熒光實驗進行了抗Ec-FtsZ多克隆抗體效價和抗原特異性鑒定。ELISA實驗表明抗Ec-FtsZ多克隆抗體效價可達1∶256 000,其具有較高的滴度。Western blotting實驗證實了抗Ec-FtsZ多克隆抗體具有良好的抗原特異性,不僅可以識別純化的Ec-FtsZ,還可以特異性結合大腸桿菌內源Ec-FtsZ。免疫熒光實驗表明Ec-FtsZ主要分布于大腸桿菌細胞內膜中心并形成了Z環,其亞細胞定位與文獻報道基本一致[5,13,26],這也再次證實了抗Ec-FtsZ多克隆抗體具有良好的抗原特異性。
目前,筆者將制備的抗Ec-FtsZ多克隆抗體成功應用于以Ec-FtsZ/ZipA (FtsZ-interacting protein A,ZipA) 相互作用為靶標的ELISA高通量篩選模型中的Ec-FtsZ生化檢測。通過應用建立的ELISA篩選模型對本室天然產物化合物庫進行了高通量篩選,已初步獲得了若干新型苗頭化合物。
綜上所述,文中成功進行了Ec-FtsZ原核表達和抗Ec-FtsZ多克隆抗體的制備與鑒定,為進一步研究Ec-FtsZ生物學功能和生化檢測奠定了實驗基礎。
致謝:衷心感謝北京師范大學化學學院化學生物學系鄭積敏教授、中國醫學科學院藥物研究所天然藥物活性物質與功能國家重點實驗室林媛副研究員和軍事科學院軍事醫學研究院十一所基因工程全軍重點實驗室岳玉環研究員在Ec-FtsZ原核表達、活性測定和多抗制備技術方面給予的悉心指導和無私幫助!
[1] Zhang W, Yang ZJ, Chen DJ. The research progress of FtsZ inhibitor, a target for bacteria cell-division. Chin Bull Life Sci, 2012, 22(1): 94–101 (in Chinese). 張雯, 楊志鈞, 陳代杰. 靶向FtsZ的細胞分裂抑制劑的研究進展. 生命科學, 2012, 22(1): 94–101.
[2] Krupka M, Margolin W. Unite to divide: oligomerization of tubulin and actin homologs regulates initiation of bacterial cell division. F1000Res, 2018, 7: 235.
[3] Sang Y, Tao J, Yao YF. Regulation of the Z ring positioning in bacterial cell division-A review. Acta Microbiol Sin, 2013, 53(4): 321–327 (in Chinese). 桑昱, 陶晶, 姚玉峰. 細菌分裂Z環定位的調控方式. 微生物學報, 2013, 53(4): 321–327.
[4] Lin Y, Zhu NY, Jiang JD, et al. The establishment and application of a high-throughput screening (HTS) assay for inhibitors ofFtsZ. Chin J Antibiot, 2015, 40(3): 166–170, 212 (in Chinese). 林媛, 朱寧嶼, 蔣建東, 等. 以FtsZ為靶點的抗結核藥物篩選模型的建立及應用. 中國抗生素雜志, 2015, 40(3): 166–170, 212.
[5] Erickson HP, Anderson DE, Osawa M. FtsZ in bacterial cytokinesis: cytoskeleton and force generator all in one. Microbiol Mol Biol Rev, 2010, 74(4): 504–528.
[6] Ortiz C, Natale P, Cueto L, et al. The keepers of the ring: regulators of FtsZ assembly. FEMS Microbiol Rev, 2016, 40(1): 57–67.
[7] Yang SY, Zhu J, Wu Y, et al. Purification and crystallization of MinC/FtsZ complex in. Chemistry, 2017, 80(1): 89–93 (in Chinese). 楊少媛, 朱嘉, 吳彥, 等. 大腸桿菌MinC/FtsZ蛋白復合物的純化和結晶. 化學通報, 2017, 80(1): 89–93.
[8] Kapoor S, Panda D. Targeting FtsZ for antibacterial therapy: a promising avenue. Expert Opin Ther Targets, 2009, 13(9): 1037–1051.
[9] Lin Y, Zhu NY, Han YX, et al. Identification of anti-tuberculosis agents that target the cell-division protein FtsZ. J Antibiot (Tokyo), 2014, 67(9): 671–676.
[10] Lin Y, Zhang HJ, Zhu NY, et al. Identification of TB-E12 as a novel FtsZ inhibitor with anti-tuberculosis activity. Tuberculosis, 2018, 110: 79–85.
[11] Zhang QS, Yuan RL, Jing SR. Expression and purification of Norovirus capsid protein VP1 and preparation of the polyclonal antibodies. Chin J Microecol, 2017, 29(8): 896–899, 905 (in Chinese). 仉秋實, 苑榮亮, 井申榮. 諾如病毒NV衣殼蛋白VP1表達純化及多克隆抗體的制備. 中國微生態學雜志, 2017, 29(8): 896–899, 905.
[12] Chen YY, Niu XY, Lin Y, et al. Prokaryotic expression, purification and preparation of rat polyclonal antibody againstZipA. Chin J Cell Mol Immunol, 2018, 34(10): 942–948 (in Chinese).陳云雨, 牛夏憶, 林媛, 等. 大腸桿菌絲狀熱敏蛋白Z相互作用蛋白A (Ec-ZipA) 原核表達、純化與大鼠多克隆抗體的制備. 細胞與分子免疫學雜志, 2018, 34(10): 942–948.
[13] Ray S, Jindal B, Kunal K, et al. BT-benzo-29 inhibits bacterial cell proliferation by perturbing FtsZ assembly. FEBS J, 2015, 282(20): 4015–4033.
[14] Artola M, Ruiz-Avila LB, Vergo?ós A, et al. Effective GTP-replacing FtsZ inhibitors and antibacterial mechanism of action. ACS Chem Biol, 2015, 10(3): 834–843.
[15] Xiao J, Goley ED. Redefining the roles of the FtsZ-ring in bacterial cytokinesis. Curr Opin Microbiol, 2016, 34: 90–96.
[16] Panda D, Bhattacharya D, Gao QH, et al. Identification of agents targeting FtsZ assembly. Future Med Chem, 2016, 8(10): 1111–1132.
[17] Wu FF, Cao ZG, Wang Q, et al. Prokaryotic expression of Zaire Ebola virus GP and the preparation of polyclonal antibody. Chin J Vet Sci, 2018, 38(3): 496–501 (in Chinese). 吳芳芳, 曹增國, 王琪, 等. 扎伊爾型埃博拉病毒糖蛋白的原核表達及多克隆抗體的制備. 中國獸醫學報, 2018, 38(3): 496–501.
[18] Sun T, Yang GW, Zhang JY, et al. Prokaryotic expression of Hepatitis C Virus (HCV) NS3 protein and preparation of polyclonal antibody. Chin J Biotech, 2015, 31(5): 711–721 (in Chinese). 孫濤, 楊光文, 張金陽, 等. 丙型肝炎病毒NS3蛋白的原核表達及多克隆抗體制備. 生物工程學報, 2015, 31(5): 711–721.
[19] Wang H, Yang B, Zhao KS, et al. Preparation and identification of polyclonal antibodies againstUspA1. Chin J Biotech, 2018, 34(1): 102–109 (in Chinese). 王輝, 楊波, 趙可勝, 等. 卡他莫拉菌UspA1蛋白多克隆抗體的制備及鑒定. 生物工程學報, 2018, 34(1): 102–109.
[20] Qin YJ, Zhang TH, Ye X. Preparation and detection of anti-influenza A virus polymerase basic protein 1 polyclonal antibody. Chin J Biotech, 2016, 32(1): 105–113 (in Chinese). 秦玉潔, 張廷虹, 葉昕. 抗A型流感病毒聚合酶堿性蛋白1多克隆抗體的制備和鑒定. 生物工程學報, 2016, 32(1): 105–113.
[21] Hayat SMG, Farahani N, Golichenari B, et al. Recombinant protein expression in(.): What we need to know. Curr Pharm Des, 2018, 24(6): 718–725.
[22] Baeshen MN, Al-Hejin AM, Bora RS, et al. Production of biopharmaceuticals in.: Current scenario and future perspectives. J Microbiol Biotechnol, 2015, 25(7): 953–962.
[23] Papaneophytou CP, Kontopidis G. Statistical approaches to maximize recombinant protein expression in: A general review. Protein Expr Purif, 2014, 94: 22–32.
[24] Su P, Gong GL. Research progress on optimizing the expression of exogenous proteins in. Biotechnol Bull, 2017, 33(2): 16–23 (in Chinese). 蘇鵬, 龔國利. 優化大腸桿菌表達外源蛋白的研究進展. 生物技術通報, 2017, 33(2): 16–23.
[25] Overton TW. Recombinant protein production in bacterial hosts. Drug Discov Today, 2014, 19(5): 590–601.
[26] Haranahalli K, Tong S, Ojima I. Recent advances in the discovery and development of antibacterial agents targeting the cell-division protein FtsZ. Bioorg Med Chem, 2016, 24(24): 6354–6369.
Bacterial expression, preparation and identification of polyclonal antibody againstFtsZ
Yunyu Chen1, Xiayi Niu1, Miao Li1, Ni Li2, and Xiaoping Liu1
1 Research Institute for Pharmaceutical Screening & Evaluation, Wannan Medical College, Wuhu 241002, Anhui, China 2 State Key Laboratory of Bioactive Substances and Function of Natural Medicine, Institute of Materia Medica, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China
To prepare polyclonal antibody (PcAb) againstfilamentous thermosensitive protein Z (Ec-FtsZ), the artificially synthesized gene fragment coding Ec-FtsZ was subcloned into pET-22b(+) plasmid, and Ec-FtsZ protein was expressed in.BL21(DE3) cell under an optimal bacterial expression condition. Then Ec-FtsZ protein was purified by HisTrap affinity chromatography, and the GTPase (Guanosine triphosphatase) activity of purified Ec-FtsZ protein was further analyzed by malachite green assay. Subsequently, the purified Ec-FtsZ protein was used to immunize rat subcutaneously for preparation of anti-Ec-FtsZ PcAb. The results of enzyme-linked immunosorbent assay (ELISA), Western blotting analysis and immunofluorescence assay showed that the titer of PcAb was 1:256 000, and PcAb exhibited a perfect antigenic specificity against purified and endogenous Ec-FtsZ protein. All these data indicated that the anti-Ec-FtsZ PcAb is successfully prepared, which can be used for further cellular function study and biochemical analysis of Ec-FtsZ protein.
FtsZ protein, bacterial expression, malachite green assay, immunofluorescence assay, polyclonal antibody
January 6, 2019;
March 11, 2019
National Natural Science Foundation of China (Nos. 81503065, 81703546), Anhui Provincial Natural Science Foundation (No. 1808085QH265), Jilin Scientific and Technological Development Program (No. 20160520045JH), The Doctoral Starting-up Fund of Wannan Medical College (No. RCQD201617), College Student Innovation Fund of Wannan Medical College (No. WK2018S54).
Xiaoping Liu. Tel: +86-553-3932601; Fax: +86-553-3932622; E-mail: liuxiaoping@wnmc.edu.cn
Ni Li. Tel: +86-10-83162728; Fax: +86-10-63180604; E-mail: linineon@126.com
國家自然科學基金 (Nos. 81503065,81703546),安徽省自然科學基金 (No. 1808085QH265),吉林省科技發展計劃 (No. 20160520045JH),皖南醫學院博士科研啟動基金 (No. RCQD201617),皖南醫學院大學生科研資助金 (No. WK2018S54) 資助。
2019-03-19
http://kns.cnki.net/kcms/detail/11.1998.q.20190318.1733.004.html
10.13345/j.cjb.190011
陳云雨, 牛夏憶, 李淼, 等. 大腸桿菌FtsZ蛋白原核表達及多克隆抗體的制備與鑒定. 生物工程學報, 2019, 35(6): 1117–1125.
Chen YY, Niu XY, Li M, et al. Bacterial expression, preparation and identification of polyclonal antibody againstFtsZ. Chin J Biotech, 2019, 35(6): 1117–1125.
(本文責編 陳宏宇)

