甘蔗原生質體RNA提取條件和方法的優化
李素麗 劉芳君 李志剛 賴沛衡 龍安四


摘 ?要 ?為了獲得高產量和高純度的甘蔗原生質體RNA,本研究以新臺糖22號(ROC22)和桂糖28號(GT28)甘蔗原生質體為材料,探究了滲透壓和原生質體活力對甘蔗原生質體RNA提取效果的影響,并比較了Trizol法、改良Trizol法、改良CTAB法、試劑盒法4種RNA提取方法。結果表明:原生質體滲透壓與RNase活性呈顯著正相關,原生質體活力與RNase活性呈極顯著負相關;RNase活性越高,RNA提取效果越差;使用0.5 mol/L的甘露醇作為滲透壓調節劑可獲取活力最高的甘蔗原生質體;原生質體活力為70%和90%時所提的RNA完整性好且純度高,符合后續分子實驗的需求,原生質體活力為90%時,RNA產量最高。因此,需要提取甘蔗原生質RNA時,至少需要保證原生質體的活力在70%以上,且原生質體活力越高,RNA的產量越高;采用改良Trizol法,可以大量制備能滿足后續分子實驗的完整性好且純度高的RNA,利用該條件和方法,可以確保獲得大量高質量的甘蔗原生質體RNA。本研究結果為甘蔗體細胞融合育種過程中的分子生物學研究提供了方法和技術支撐。
關鍵詞 ?甘蔗;原生質體;RNA;活力;RNase
中圖分類號 ?S566.1 ?????文獻標識碼 ?A
Abstract ?In order to obtain high-yield and high-purity sugarcane protoplast RNA, this study investigated the osmotic pressure and protoplast viability on sugarcane protoplasts using the sugarcane protoplasts of ROC22 and GT28, and compared the Trizol method, improved Trizol method, improved CTAB method and kit method. The protoplast osmotic pressure was positively correlated with RNase activity, and the protoplast activity was significantly negatively correlated with RNase activity. Higher RNase activity resulted in a worse RNA extraction effect. Using 0.5 mol/L mannitol as an osmotic pressure regulator, the most active sugarcane protoplasts could be obtained. When the protoplast vigor was 70% and 90%, the RNA integrity was good and the purity was high, which met the requirements of subsequent molecular experiments. The RNA yield was the highest when the protoplast activity was 90%. Therefore, when extracting sugarcane protoplast RNA, the activity of protoplast should be at least above 70%. Using the improved Trizol method, a large number of high-quality RNA could be prepared for subsequent molecular experiments. Using this condition and method, it was ensured that a large amount of high quality sugarcane protoplast RNA was obtained. The results of the study provided methods and technical support for the molecular biology research in the somatic cell fusion breeding of sugarcane.
Keywords ?Saccharum officinarum; protoplast; RNA; viability; RNase
DOI ?10.3969/j.issn.1000-2561.2019.08.012
植物體細胞融合是指2種來自不同種或屬的異源原生質體,通過細胞膜的流動性使得2種原生質體發生融合(核融合、胞質融合),形成雜合體細胞的過程。體細胞雜交育種可以突破物種生殖隔離,且不受種屬的限制,可創造遠緣雜交[1]。迄今為止,已有很多禾本科植物通過原生質體融合技術獲得了雜合體植株[2-4]。甘蔗體細胞融合育種已有一些相關報道。2002年Aftab等[5]用甘蔗葉片葉肉細胞和細胞懸浮系分離得到的原生質體進行電融合,最終雜合體細胞分裂形成了小愈傷,但并未分化長成雜合體植株。宋亞妮[6]以甘蔗桂糖28號和新臺糖22號為材料,優化了PEG融合和電融合的條件、以及融合后雜合體細胞再生的培養條件,獲得了雜合體細胞的愈傷組織,但沒有進一步分化形成植株。甘蔗雜合體細胞再生植株仍是甘蔗體細胞融合育種的瓶頸。植物體細胞融合育種雜合體細胞再生植株要經歷原生質體分離、鈍化、融合和培養、再生植株等一系列過程[6],外部條件如滲透壓、激素、鈍化劑、融合劑等都可能影響到原生質體基因水平的調控,從而影響雜合體植株的形成。何若天等[7]研究發現,與新鮮葉片相比,酶解法獲取的新鮮甘蔗幼葉原生質體內的RNA、DNA及總核酸含量均降低,而核酸含量的降低則有可能導致某些關鍵基因表達缺失,從而影響原生質體再生植株的過程,但具體是哪些基因的表達量降低未見報道。我們前期研究也發現,通過不同的原生質體制備條件所得到的原生質體其再生能力有較大的差異[8],不同的制備條件是否會使原生質體的核酸發生變化,從而影響原生質體再生植株呢?甘蔗基因型的特異性很強,不同基因型甘蔗品種所分離得到的原生質體其再生能力也不一樣[9],不同的激素組合和濃度對雜合體細胞的再生具有顯著的調控作用,但這種再生能力差異的分子機理研究還十分滯后。所以優化甘蔗原生質體RNA提取條件和方法,保持原生質體核酸的穩定性,對深入研究原生質體融合過程中影響雜合體細胞再生植株的分子機制具有重要的意義。
1.2.7 ?RNA檢測 ?取2 μL RNA樣品在1%瓊脂糖凝膠進行電泳,在BioRad凝膠成像系統下拍照,觀察RNA條帶的完整性。取1 μL RNA樣品,用微量紫外分光光度計Nano Photometer TM P-Class測定RNA濃度,用于計算RNA產量,RNA產量(μg/106 cells)=RNA濃度(μg/mL)×RNA體積(mL)/原生質體個數(106),記錄D260 nm/ D280?nm、D260 nm/D230 nm用于分析RNA純度。
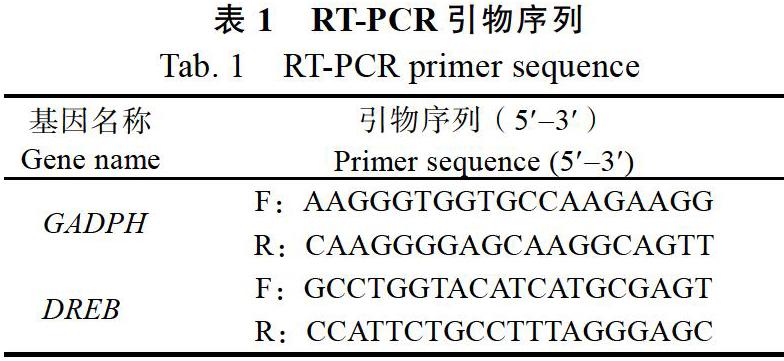
1.2.8 ?RT-PCR ?RNA反轉錄合成cDNA具體步驟按照PrimeScript TMⅡ1stStrand cDNA Synthesis Kit試劑盒進行。以合成cDNA為模板,對甘蔗內參基因GADPH(glyceraldehyde-3- pho sphate dehydrogenase)、甘蔗DREB(dehydrat ion responsive element binding protein)基因進行PCR擴增。RT-PCR按照TaKaRa公司的TB GreenTM Premix Ex TaqTMⅡ試劑盒進行。引物序列詳見表1。
1.3 ?數據處理
采用Excel 2010軟件進行數據計算,采用SPSS 19.0軟件對數據進行單因素方差分析和差異顯著性檢驗。
2 ?結果與分析
2.1 ?不同滲透壓對甘蔗原生質體活力和產量的影響
由圖2可知,ROC22和GT28的甘蔗原生質體活力在甘露醇濃度為0.5 mol/L時均達到最高,分別為92.79%和94.52%,而后隨著甘露醇濃度的增加而呈下降的趨勢,當甘露醇濃度為0.4??mol/L時,ROC22和GT28的活力比甘露醇濃度為0.5?mol/L時分別下降了38.18%和36.65%,且在該濃度下細胞碎片增多;當甘露醇濃度為0.6?mol/L時,ROC22和GT28的活力比活力最高時分別下降52.61%和61.26%,該濃度下部分細胞有皺縮的現象(圖1,圖2)。在甘露醇濃度為0.3~0.5?mol/L范圍內,隨著甘露醇濃度的提高,ROC22和GT28的原生質體產量明顯升高,當甘露醇濃度為0.5 mol/L時,ROC22和GT28的原生質體產量達到最高,分別為4.31×106、4.54×106個/g,當甘露醇濃度高于0.5 mol/L時,原生質體產量有所下降,GT28在甘露醇濃度為0.7?mol/L時產量最低,僅有甘露醇為0.5?mol/L時的12.78%。
A:正常形態的原生質體,細胞膜邊緣平整清晰,形態飽滿;B:細胞膜皺縮的原生質體,細胞膜邊緣呈波浪形,形態各異(箭頭所示);C:細胞碎片增多的原生質體,原生質體懸浮液中有許多原生質體破裂留下的碎片(箭頭所示)。Bar=20 μm。
2.2 ?不同原生質體活力對甘蔗原生質體核酸含量和RNase活性的影響
RNA含量隨原生質體的活力升高而逐漸升高(圖3),原生質體活力為0時,ROC22和GT28原生質體的RNA含量最低,分別為12.80、10.31?μg/g;當原生質體活力為90%時,ROC22和GT28原生質體的RNA含量最高,分別是RNA含量最低時的4.20、5.52倍(圖4)。由圖4可知,隨著原生質體活力升高,核酸酶活性呈逐漸降低的趨勢。原生質體活力為90%時,ROC22和GT28原生質體的核酸酶活性最低,分別為44.87、36.75 U/mg。原生質體活力為0時,ROC22和GT28原生質體的核酸酶活性達到最高,分別為活力90%的2.43、3.27倍。
2.3 ?不同滲透壓對甘蔗原生質體RNase活性和RNA含量的影響
圖5表明,原生質體的核酸酶活性隨甘露醇濃度不同而有所變化,剛分離的原生質體(活力為90%,密度為1×106個/mL)在含有不同甘露醇濃度的CPW中分別處理5 h后,甘蔗原生質體的RNase活性隨甘露醇濃度的增加而升高。在甘露醇濃度為0.7 mol/L時,ROC22和GT28原生質體的RNase活性均達到最高,ROC22和GT28的RNase活性分別為98.16、133.93 U/mg,分別是甘露醇濃度0.3 mol/L的3.01、3.24倍。剛分離的原生質體(活力為90%,密度為1×106個/mL)在
A:30%活力的原生質體;B:50%活力的原生質體;C:70%活力的原生質體;D:90%活力的原生質體。
Bar=20 μm,藍色的細胞為被臺盼藍染色的死細胞。
含有不同甘露醇濃度的CPW中分別處理5 h后。由圖5可知,ROC22和GT28原生質體的RNA含量在甘露醇為0.5 mol/L時均達到最高,分別為57.7、53.78 μg/g。而后原生質體的RNA含量隨甘露醇濃度的提高而顯著下降,當甘露醇濃度為0.7 mol/L時,ROC22和GT28原生質體的RNA含量最低,僅有當甘露醇為0.5 mol/L時RNA含量的45.75%和41.73%。
2.4 滲透壓與原生質體活力、RNase活性相關性分析
從表2中看出,甘露醇濃度與ROC22原生質體RNase活性呈顯著正相關,原生質體活力與RNase活性呈極顯著負相關。甘露醇濃度與GT28原生質體RNase活性呈極顯著正相關,原生質體活力與RNase活性呈極顯著負相關。
2.5 ?不同原生質體活力對甘蔗原生質體RNA提取效果的影響
由圖6可知,當原生質體活力為70%和90%時,28S、18S和5S rRNA 3條帶均符合RNA完整性的要求,條帶清晰完整。原生質體活力為50%時,28S、18S rRNA有嚴重的拖帶現象,且5S rRNA條帶亮度明顯高于28S、18S rRNA,原生
質體活力為30%時,電泳結果顯示只有5S rRNA條帶且非常明亮,表明RNA已全部降解。除30%活力外,50%、70%、90%的D260 nm/D280 nm值均在(1.98~2.00)合適范圍內,而D260 nm/D230 nm值只有70%和90%活力大于2.0(表3)。90%活力的原生質體提取的RNA產量最高,達37.23 μg,其次是70%活力,達20.97?μg,不同活力原生質體提取的RNA產量差異達到顯著水平。30%和50%活力原生質體提取RNA所提的RNA不僅純度達不到合格標準,產量也極低。
2.6 ?不同的RNA提取方法對甘蔗原生質體總RNA完整性的影響
如圖7所示,Trizol法其28S rRNA和18S rRNA均條帶模糊且有明顯的拖帶現象,5S rRNA條帶最亮,且28S rRNA條帶上方有1條很淺的條帶;改良CTAB法28S rRNA和18S rRNA條帶邊緣模糊,5S rRNA條帶亮度明顯高于其他2條帶;改良Trizol法和TaKaRa試劑盒法其3條帶均符合RNA完整性的要求,條帶清晰完整,且28S rRNA條帶亮度明顯高于18S rRNA,但TaKaRa試劑盒法其條帶亮度遠不及改良Trizol法。
2.7 ?不同的RNA提取方法對甘蔗原生質體總RNA純度與產量的影響
由表4可知,4種方法所提取的RNA其D260?nm/D280 nm均在合適的范圍內,其中改良Trizol法和TaKaRa試劑盒法的值最接近2.0。Trizol法和改良CTAB法的D260 nm/D230 nm值小于2.0,Trizol法和TaKaRa試劑盒法D260 nm/D230 nm值高于2.0,改良Trizol法和TaKaRa試劑盒法提取RNA純度達到要求。
不同方法的提取效率對RNA的產量有很大的影響。其中產量由高至低的順序為:改良Trizol法>Trizol法>TaKaRa試劑盒法>改良CTAB法。Trizol法產量雖僅次于改良Trizol法,但該方法得到的RNA純度不符合要求。改良Trizol法產量是TaKaRa試劑盒法的2.18倍,差異顯著,與瓊脂糖凝膠電泳檢測結果相符合,改良Trizol法的電泳條帶明顯更亮。
2.8 ?不同的RNA提取方法對甘蔗原生質體總RNA的RT-PCR結果的影響
由圖8所示,除了Trizol法以外,其余3種方法所提取的RNA均能擴增出大小一致的目的片段。其中改良CTAB法擴增出的條帶亮度最弱,而改良Trizol法所擴增的GADPH和DREB的目的條帶均最清晰明亮。4種不同方法提取的RNA其完整性、純度、RT-PCR的結果最佳的均是改良Trizol法和TaKaRa試劑盒法,產量最佳的是改良Trizol法。
3 ?討論
3.1 ?RNase活性和滲透壓是影響甘蔗原生質體RNA提取的重要條件
RNase是一類催化RNA降解為小片段的核酸酶,是導致RNA降解最主要的物質。本研究發現,原生質體的活力越高時,核酸酶活性就越低,對應的RNA含量就越高,RNA的提取效果越好。當原生質體活力低于70%時,電泳結果顯示RNA大量降解成小片段,RNA完整性差,不可用于后續的分子實驗。當原生質體活力高于70%時,提取的RNA純度較高且完整性好。原生質體活力與RNase活性呈負相關,可能是當原生質體死亡后,RNase使RNA降解引起的。
滲透壓會通過影響原生質體活力而間接影響RNase活性,滲透壓過低會使原生質體吸水脹破,滲透壓過高會使原生質體失水皺縮導致細胞死亡,所以,維持適宜的滲透壓是獲得高活力原生質體的前提條件[20]。滲透壓也能直接影響原生質體RNase活性,因為滲透壓可能是使原生質體RNase活性升高的主要原因[21]。酶解甘蔗幼葉獲得原生質體過程中,隨著甘露醇濃度增加,RNA酶活性不斷提高,且RNA含量也隨著RNase活性增高而下降[9]。本研究發現,原生質體的RNase活性與甘露醇濃度呈顯著正相關,原生質體的RNA含量隨甘露醇濃度的增加先升高后降低,當甘露醇濃度為0.5 mol/L時,原生質體的RNA含量達到最高,當甘露醇濃度低于0.5 mol/L時,原生質體可能由于懸浮液的滲透壓過低而吸水脹破,RNA從細胞中釋放出來,被RNase降解。當甘露醇濃度高于0.5 mol/L時,可能是由于原生質體的RNase活性升高而使得RNA含量降低,與前人研究結果一致。
3.2 ?選用合適的提取方法是甘蔗原生質體RNA提取成功的重要因素
此前也有文獻報道關于提取原生質體RNA的不同方法的研究,唐佳妮等[22]通過用Trizol法提取的杉木原生質體RNA純度和產量均最差;CTAB法、LiCl沉淀法、天根試劑盒法純度稍好,但產量低;用CTAB裂解細胞、異丙醇沉淀RNA且加入適量糖原后RNA的提取效果最好,產量也最高。徐小勇等[23]通過4種RNA提取方法的比較,得出改良Trizol法是柑橘原生質體RNA提取的最佳方法。本研究用4種不同的方法來提取甘蔗原生質體RNA,結果表明,不同方法的RNA提取效率有很大差異。其中產量由高至低的順序為:改良Trizol法>Trizol法>TaKaRa試劑盒法>改良CTAB法。Trizol法產量雖僅次于改良Trizol法,但該方法得到的RNA純度不符合要求。本研究采用的改良Trizol法加入了PVP和β-巰基乙醇;PVP能與酚類化合物作用,抑制酚類物質的氧化[24],β-巰基乙醇的強還原性能使多酚氧化酶的二硫鍵斷裂從而抑制多酚類被氧化成醌類物質[25],且避免了其他雜質和色素等對RNA提取的干擾,改良Trizol法提取的RNA產量是TaKaRa試劑盒法的2.18倍,因此改良Trizol法是比較適用于甘蔗原生質體RNA提取的方法。
參考文獻
Wang X, Zhou J, Yang Y, et al. Transcriptome analysis of a progeny of somatic hybrids of cultivated rice (Oryza sativa L.) and wild rice (Oryza meyeriana L.) with high resistance to bacterial blight[J]. Phytopathol, 2013, 161: 324-334.
Xia G M, Li Z Y, Wang S L, et al. Asymmetric somatic hybridization between haploid common wheat and UV-mediated Haynaldia villosa[J]. Plant Science, 1998, 137(2): 217-223.
Cai Y, Xiang F, Zhi D, et al. Genotyping of somatic hybrids between Festuca arundinacea Schreb. And Triticum aestivum L.[J]. Plant Cell Reports, 2007, 26(10): 1809-1819.
Xiang F, Xia G, Chen H. Asymmetric somatic hybridization between wheat (Triticum,aestivum) and Avcna sative L[J]. Science in China Series C: Life Sciences, 2003, 46(3): 243-252.
Aftab F, Zafar Y, Lqbal J. Optimization of conditions for electrofusion in sugarcane protoplasts[J]. Pakistan Journal of Botany, 2002, 34(3): 297-301.
宋亞妮. 甘蔗原生質體的融合及雜核細胞再生條件的優化[D]. 南寧: 廣西大學, 2018.
何若天, 覃 ?偉. 甘蔗和煙草幼葉原生質體的核酸含量與核酸酶活性及其影響因素[J]. 廣西植物, 1997(1): 90-94.
史曉朋. 甘蔗原生質體的分離與培養體系的建立和優化[D]. 南寧: 廣西大學, 2001.
何 ?明, 張子健, 鐘漢明, 等. 影響甘蔗胚懷愈傷組織原生質體培養的主要因素[J]. 西南農業學報, 1994, 7(4): 71-76.
于寒松, 彭 ?帥, 謝遠紅, 等. 一種RNA提取試劑盒-Trizol的使用方法初探[J]. 食品科學, 2005, 26(11): 39-42.
楊 昭,何春蘭,李芬芳,等. 改良熱硼酸法提取青香蕉果肉總RNA的條件優化[J]. 江蘇農業科學,2017,45(15): 49-53.
馮立國, 李婷琳, 陳 ?陳, 等. 玫瑰花組織總RNA提取方法研究[J]. 揚州大學學報(農業與生命科學版), 2013, 34(4): 104-107.
趙祥祥, 劉福霞, 唐 ?塘, 等. 成熟油菜次生休眠種子RNA的快速高效提取方法[J]. 揚州大學學報(農業與生命科學版), 2013, 34(1): 64-67.
侯 哲, 陸秀君,張曉林,等. 天女木蘭不同組織總RNA提取方法的篩選與優化[J]. 中南林業科技大學學報,2016,36(7):109-115.
李素麗, 宋亞妮, 李志剛, 等. 不同凍存條件對甘蔗原生質體活力和再生能力的影響[J]. 廣西植物, 2019, 39(04): 427-436.
曾博雅. 水稻懸浮細胞的包埋脫水法超低溫保存以及多酚誘導的細胞程序性死亡現象[D]. 南京: 南京農業大學, 2009.
朱治平. 植物組織中核酸含量的測定[A]. 上海植物生理學會. 植物生理學實驗手冊[M]. 上海: 上海科學技術出版社, 1985: 44-47.
Salzman R A, Fujita T, Hasegawa P M, et al. An improved RNA isolation method for plant tissues containing high levels of phenolic compounds or carbohydrates[J]. Plant Molecular Biology Reporter, 1999, 17: 11-17.
Liao Z H, Chen M, Guo L, et al. Rapid isolation of high-quality total RNA from taxus and ginkgo[J]. Reparative Biochemistry & Biotechnology, 2004, 34(3): 209-214.
顏秋生, 李向輝. 甘蔗原生質體的分離、培養與愈傷組織的形成[J]. 科學通報, 1983(12): 752-755.
Premecz G, Olah T, Gulyas A, et al. Is the increase in ribonuclease level in isolated tobacco protoplasts due to osmotic stress?[J] Plant Science Letters, 1977, 9: 195-200.
唐佳妮, 林二培, 黃華宏, 等. 杉木葉片原生質體分離及RNA提取體系的建立[J]. 林業科學, 2018(4): 38-48.
徐小 勇, 許曉玲, 張一卉, 等. 柑橘原生質體總RNA提取方法研究[J]. 揚州大學學報(農業與生命科學版), 2016, 37(2): 111-114.
Couch J A, Fritz P J. Isolation of DNA from plants high in polyphenolics[J]. Plant Molecular Biology Reporter, 1990, 8(1): 8-12.
Bahloul M, Burkard G. An improved method for the isolation of total RNA from spruce tissues[J]. Plant Molecular Biology Reporter, 1993, 11(3): 212-215.

