水稻花粉育性相關基因研究進展
馬龍 徐薇 竇玲玲 柯笑楠 劉明月 耿艷飛 黃霞 賈玉芳 劉慶坡
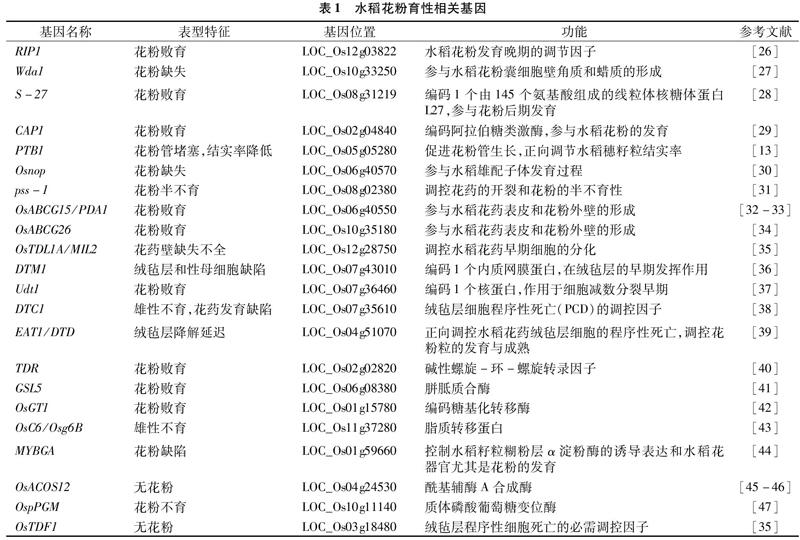
摘要:花粉發育為水稻生殖發育不可或缺的過程之一,其育性高低對水稻育種以及經濟產量具有重要意義。大量研究發現,水稻花粉發育是嚴格受基因表達調控的生物學過程。基于此,本文綜述與水稻花粉育性相關的蛋白編碼基因和調控性miRNA的研究現狀,總結有關基因在調控水稻花粉育性方面的生物學功能及作用機制,并對該領域未來的發展趨勢作出分析與展望,從而為水稻分子設計育種提供理論參考。
關鍵詞:水稻;花粉發育;生殖發育;相關基因;miRNA;育種利用
中圖分類號: S511.03? 文獻標志碼: A? 文章編號:1002-1302(2019)10-0042-05
水稻是世界性主要糧食作物之一,為全球50%以上人口提供食物,同時也是重要的單子葉模式植物之一[1],因此對水稻的不斷深入研究具有重要理論和現實意義。隨著人口數量的不斷增長、生態環境的惡化、耕地面積的持續減少以及人們對食品安全的重視,在可預見的將來,糧食短缺及由此引發的其他問題將日益突顯。因此,培育出優質、高產、抗逆性強的水稻新品種顯得尤為重要,這要求研究者在了解水稻宏觀表型變化的基礎上更深入理解其分子調控機制等。基因組學育種及分子育種能夠高效地對植物生理學、遺傳學、生物技術及基因表達調控等研究進行有機整合,因此已成為解決當前問題的有效途徑。鑒于基因組學育種主要通過轉基因技術和分子標記技術等充分挖掘并利用有利基因[2],近幾十年來大量調控不同農藝性狀的相關基因被相繼鑒定和克隆[3-4]。
水稻單產是受內在遺傳和外部環境影響的綜合性狀,與植株器官形態構建、光合效率、礦質元素的高效利用以及授粉和授精過程、抗逆性等密切相關[5]。穗數、穗粒數、結實率和粒質量等是構成水稻稻谷產量的主要因素[6],其中穗數、穗粒數[7]、粒質量[8-10]和株型等水稻產量性狀已被深入研究,且研究者已鑒定并克隆了許多相應的基因[11-12];而對水稻產量同樣具有決定作用的結實率相關功能基因鑒定及調控水稻單產形成內在機制等方面的研究,進展相對比較緩慢[13]。迄今,已克隆到幾個調控水稻結實率的重要基因,且其中多數基因參與了水稻花粉的發育進程[6,13-16]。例如通過促進花粉管生長正向調節水稻結實率的PTB1基因[13]以及通過促進花粉管伸長和調控胞內鈣離子平衡提高水稻穗籽粒結實率的OsCNGC13基因[16]等。盡管如此,對于通過調控水稻花粉發育進而影響結實率的內在機制認識仍十分有限。此外,雄性不育的發現和利用為主要農作物的雜種優勢利用提供了保障,其中雜交水稻的培育為世界糧食生產發揮了舉足輕重的作用[17]。然而,雜交后代的結實率往往低于親本,且已成為利用雜種優勢進行水稻產量性狀改良的一個主要瓶頸[13],因此對結實率相關基因的研究已成為水稻育種工作的主要熱點之一,其中花粉育性作為結實率的決定因素之一,其相關研究備受關注。
在高等植物中,花粉發育是一個非常復雜的生物學過程。在一系列相關基因的協同作用下,小孢子母細胞在花粉囊中進行減數分裂產生小孢子,并進一步發育成花粉粒;當花粉囊裂開時,成熟的花粉粒被釋放出來[18]。馮九煥等以秈稻品種IR36為材料,對水稻花粉發育過程及其藥壁組織進行了系統觀察,詳細地描繪了其超微結構特征,并依據不同時期特點將水稻花粉發育過程劃分為8個時期[19-20]。Itoh等也將該過程分成8個時期,其中前4個時期是花藥孢子體發育時期,后4個時期是花粉發育時期[1,21]。在此基礎上,后來的研究者進一步將水稻花藥發育過程由原來的8時期細分為14時期[22-23],這些時期不同生物過程的循序漸進最終保證了花粉的完整發育。目前,基因表達調控機制等研究最深入的主要涉及水稻絨氈層和花粉壁等發育過程。基于此,本文主要綜述當前與水稻花粉育性相關蛋白編碼基因和miRNA的研究進展并初步闡釋其在水稻花粉育性調控中的作用及機制,以期加深相關研究人員和育種工作者對花粉育性相關基因及生物學功能、調控途徑等方面的認識,從而為相關基因的進一步育種利用等提供參考。
1 水稻花粉育性相關蛋白編碼基因
水稻的成熟花粉是由2或3個細胞組成的雄配子體,廣義的花粉概念則包括從小孢子到成熟花粉的各個階段[24],每個階段都是在特定基因協作下完成的。任何參與花粉形成過程的基因發生突變,均可導致花藥花粉異常,最終導致雄性不育[25]。近年來,隨著研究的不斷深入,研究者已陸續鑒定并克隆了多個與水稻花粉敗育及花粉缺失等相關的功能基因(表1)。
1.1 花粉敗育相關基因
花粉敗育是指受內外環境因素影響導致花粉不能正常發育起到生殖作用的現象,其主要原因是花粉母細胞不能正常減數分裂以及絨氈層細胞作用失常。絨氈層細胞是花藥發育過程中短暫存在的并位于花藥最內層的細胞,它直接包裹著小孢子母細胞及分化后的小孢子[48]。絨氈層細胞的細胞質中富含線粒體、內質網、高爾基體等細胞器,代謝非常旺盛[49]。研究發現,絨氈層細胞的降解是一個細胞程序性死亡的過程,在此過程中會釋放大量在絨氈層細胞內合成的物質,用于小孢子及其外壁的發育[40,50]。因而,絨氈層和花粉的發育是受一系列基因調控的復雜生理進程,時序上嚴格匹配。
1.1.1 絨氈層發育和PCD相關調控基因 目前,研究者利用突變體克隆了一些絨氈層發育相關基因,包括Udt1和TDR等。UDT1為bHLH轉錄因子,主要作用于細胞減數分裂早期,其T-DNA或Tos17插入突變體表現為雄性不育[37]。突變體udt1的絨氈層不能分化和液泡化,并且性母細胞不能分化成小孢子,中間層細胞不退化,因而花粉囊內不能產生正常花粉[51]。TDR也是bHLH類轉錄因子。在水稻花藥發育過程中,TDR通過觸發絨氈層PCD而調控花粉壁發育[40]。突變體tdr的絨氈層和中層降解延遲,花粉粒皺縮,且TDR可直接與2個下游基因OsCP1和OsC6互作[40],其中OsCP1編碼一個半胱氨酸蛋白酶,在花藥發育中發揮重要作用[51];OsC6是一個脂質轉移蛋白基因,在水稻未成熟花藥的絨氈層細胞中特異表達[43],該基因可通過抑制水稻烏氏體和花粉外壁發育而使其發生缺陷,并且降低花粉育性。Zhang等發現,TDR突變后還可導致花藥表皮蠟質和花粉壁的形成異常[52-53]。進一步分析發現,TDR能結合OsADF基因啟動子的E-box基序并調控其表達,進而通過參與ADF(花藥發育相關的F-box蛋白)介導的蛋白水解途徑調節絨氈層細胞的發育和花粉形成[54]。
水稻花藥絨氈層細胞的程序性死亡是受一系列基因嚴格調控的過程。除正向調控因子TDR等外,Niu等克隆了1個在絨氈層細胞特異表達的bHLH類轉錄因子EAT1基因,該基因的突變體eat1表現為絨氈層降解延遲,不能形成正常的花粉粒,導致花藥干癟;深入研究發現,EAT1作用于TDR的下游,可通過直接調控天冬氨酸蛋白酶基因OsAP25和OsAP37的表達,促進植物絨氈層細胞的程序性死亡[39]。Yi等利用 T-DNA插入突變體鑒定到一個調控絨氈層PCD的基因DTC1,其突變體dtc1表現為雄性不育,花藥發育缺陷,絨氈層增大不退化,中層降解延遲;進一步分析發現,DTC1可通過抑制OsMT2b的活性氧清除活性,調控絨氈層的PCD進程[38]。
1.1.2 花粉壁發育相關調控基因 花粉壁是花粉不可缺少的重要部分,也是花粉育性重要的決定因子之一。Ueda等從水稻Tos17插入突變體庫中鑒定到一個花粉敗育的突變體cap1,該突變體的雜合體有1/2的花粉粒發生干癟畸變,且畸形花粉粒內所有的細胞質內充物、細胞核和內孢細胞壁幾乎全部缺失,因而不能萌發;利用原位雜交等技術研究發現,CAP1主要在發育的花粉粒、絨氈層和藥室內壁中表達;進一步分析發現,該突變體花粉粒畸變主要是由L-阿拉伯糖(L-arabinose)毒性積累所致或由UDP-L-arabinose(源于 L- 阿拉伯糖1-磷酸鹽轉變)缺乏而抑制細胞壁代謝造成[29]。此外,Moon等鑒定到一個主要在成熟花粉粒中表達的編碼糖基化轉移酶的基因OsGT1,其T-DNA插入突變體osgt1的花粉在減數分裂階段正常但在成熟期活力丟失;進一步觀察發現,該突變體的花粉內壁結構遭到破壞,且其淀粉、蛋白含量顯著下降[42]。因此,花粉壁發育缺陷將導致水稻花粉育性降低。
1.1.3 其他基因 除了絨氈層和花粉壁發育相關基因外,人們利用花粉突變體還克隆到一些其他調控基因,比如rip1和Osabcg15。rip1是Han等從水稻T-DNA插入突變體庫中篩選到的一個花粉特異突變體,其花粉中線粒體、高爾基體、脂肪體、質體和內質網的發育都表現為延遲;在體外培養條件下,該突變體的花粉不能萌發,而野生型對照的花粉萌發率>90%,表明RIP1基因是水稻花粉發育晚期的調節因子,是花粉成熟和萌發所必需的[26]。另外,Wu等利用秈稻恢復系縉恢一號獲得一個不能產生有活力花粉的突變體Osabcg15,該突變體的花藥短窄且白化,花藥表皮異常、中層增大、烏氏體發育異常、絨氈層不完全退化、沒有外壁,花粉粒收縮[32]。Niu等深入分析發現,OsABCG15可能在孢子花粉素合成或孢子花粉素從絨氈層細胞向花藥室轉移的過程中發揮關鍵作用[33]。
1.2 花粉缺失相關基因
除花粉敗育外,花粉缺失是另一個影響水稻正常生殖發育的主要因素。Jung等曾鑒定到一個蠟質缺陷的花藥突變體Wda1,該突變體所有細胞壁層的超長鏈脂肪酸合成受阻,花藥外層的角質臘層缺失,小孢子的發育嚴重遲緩,導致花粉外壁的形成發生缺陷,最終造成花粉缺失[27]。同樣地,Jiang等鑒定到一個無花粉突變體基因Osnop,該基因只在花粉發育和花粉管萌發時表達,因而控制水稻雄配子的發育[30],但是它在水稻花粉成熟時的具體調控機制尚不清楚。
此外,研究者還克隆了許多其他造成花粉缺失的相關基因。例如絨氈層PCD的必需調控因子基因OsTDF1[55]、絨氈層決定基因OsTDL1A[56]、控制水稻花器官尤其花粉發育及水稻籽粒糊粉層α淀粉酶活性的基因OsGAMYB[44]、調控水稻孢子花粉素合成并參與誘導絨氈層降解的酰基輔酶A合成酶基因OsACOS12[57-58]以及影響花粉發育過程中淀粉合成,進而影響花粉缺失的基因OsPGM[59]等,這些基因的發現與功能研究加深了人們對水稻花粉發育分子機制的了解。
2 水稻miRNA與花粉育性
miRNA是一類長20~24個核苷酸的內源單鏈非編碼小分子RNA,通過與靶基因互補結合來介導mRNA的降解或在翻譯水平上抑制其表達,進而調控植物的生長發育及環境適應性等[45]。例如,miRNA可參與調控水稻根系的生長發育[46]、水稻營養生長與生殖生長轉換[47]以及水稻衰老期葉片發育[60]等不同生物學過程。
近年來,隨著基因組學和生物信息學的迅猛發展,在不同物種中鑒定到越來越多的具有不同調控功能的miRNA。截至目前,在miRBase數據庫中已注冊有來自223個不同物種的28 645個前體miRNA(pre-miRNA),共表達35 828個成熟序列,其中從水稻基因組中鑒定到592個前體miRNA和713個成熟miRNA(http://www.mirbase.org,release 21)[61]。大量研究發現,同一miRNA在植物不同生長發育時期具有不同的表達模式,且在同一時期表達的miRNA也具有明顯的多樣性;miRNA與其作用靶基因組成調控網絡參與植物生長發育的調節過程,進而在植物生命周期中發揮重要作用[62-64]。
花粉發育是開花植物生命周期中最重要的時期之一。近年來,隨著高通量測序等技術的應用,有關miRNA參與調控水稻花粉發育的研究不斷展開并取得一定進展。Wei等系統探究了水稻花粉發育過程中miRNA的表達情況,共鑒定到292個已知miRNA和75個新miRNA,其中202個已知miRNA在花粉發育過程有所表達,且其中103個的表達明顯富集,而新鑒定的75個miRNA中半數以上在花粉發育中呈現出組織特異性或者在發育時期特異表達[65]。在比較同源四倍體和二倍體水稻花粉發育過程中miRNA的表達譜時,Li等發現,相對于二倍體,四倍體水稻有321個差異表達的miRNA,且同源四倍體水稻花粉和胚囊中miRNA的表達譜也截然不同,每個miRNA平均有3個與花粉發育有關的作用靶基因[66];此外,與轉座因子相關的siRNA在四倍體水稻胚囊中上調表達,而在花粉發育過程中發生下調[67]。由此可見,miRNA可能確實參與了水稻花粉發育的生物學調控過程,但其與靶基因互作進而調控水稻花粉育性的內在分子機制等仍需進一步深入闡明。
雜交水稻的育種及大范圍推廣應用,對世界糧食供給作出了巨大貢獻,因此對水稻雜交育種的研究始終是育種家的一個重要關注點。目前以細胞質雄性不育系(CMS)為基礎的三系雜交和以細胞核雄性不育系為基礎的兩系雜交是雜交水稻的主要2種育種方式,其中雄性不育系的研究是水稻雜交育種的重點所在。在水稻中,miR156通過作用于靶基因SPL來參與水稻雄配子體的形成過程[68]。以水稻光周期/溫敏性核雄不育系WuxiangS(WXS)為材料,Zhang等研究了其育性轉換時期miRNA的表達模式,共鑒定出497個已知miRNA和273個新miRNA,在可育和不育WXS材料間共發現26個表達量存在顯著差異的miRNA,其中11個表達量下調,15個表達量上調;進一步分析發現,水稻miR156a-j和miR164d等調控的靶基因多與花粉育性相關,表明miRNA確實參與了WXS花粉發育及育性轉換進程;此外,在水稻不育材料WXS的育性轉換期發現,miR5967與其靶基因(一種鈣離子結合蛋白基因)互作,通過參與調控鈣離子信號轉導途徑,在WXS育性轉換過程發揮一定的調控作用[69]。
盡管近年來,人們已陸續發掘到一些與水稻花粉育性相關的miRNA,但在深入揭示其生物學功能及調控機制等方面進展十分緩慢。Zhou等發掘到一個與調控水稻光溫敏雄性不育有關的miRNA——P/TMS12-1,在農墾58S和培矮64S中超量表達該miRNA可顯著恢復其花粉育性;生物信息學分析顯示,P/TMS12-1擁有10個潛在靶基因[70],但它到底與哪個(些)靶基因互作進而調控水稻花粉育性尚不清楚。總之,水稻育性是一個復雜的基因網絡調控過程,其間參與的基因遠遠不止目前所發掘的。因此,要想充分理解水稻花粉育性的分子機制,仍需要在原有基礎上進一步發掘新基因,并通過轉基因技術等探明其生物學功能。
3 總結與展望
水稻花粉發育是一個連續的、復雜的生物學過程,該過程受一系列基因精細調控,涉及此過程的任何基因發生突變都將影響花粉的正常發育。近年來,研究者已陸續克隆了許多相關基因,并且對其相應功能進行了研究,其中包括花粉發育調控基因Wda1[30]、花粉半不育基因pss1[31,71]、花粉缺失基因Osnop[55]、花粉管堵塞基因PTB1[13]以及絨氈層相關基因OsTDL1A[56]、絨氈層發育調控基因Udt1[72]和TDR[40]等。盡管如此,人們對于花粉發育分子機制的認識仍很有限。例如,Deveshwar等以水稻花粉發育的4個不同時期(包括減數分裂前期、減數分裂期、單核細胞期和三核細胞期)為研對象,利用基因芯片和測序技術對其轉錄組進行分析,結果發現,至少22 000個基因在花粉發育不同時期有所表達,其中減數分裂期最多(18 090個),三核細胞期最少(15 465個);此外,通過比較水稻營養生長期和生殖生長期的基因表達情況發現,在花粉發育期特異表達的基因約有1 000個,但在上述發現的基因中約1/2的生物學功能未知[73]。表明對于水稻花粉發育的網絡機制,仍有太多未知領域需進一步探索。此外,與水稻花粉發育相關miRNA的發掘及功能研究才起步不久,在花粉發育過程中miRNA自身的表達調控機制尚不清楚,其如何與靶基因互作以及如何影響其他miRNA和蛋白編碼基因的表達等是充分理解花粉育性迫切需要解決的問題。隨著高通量測序技術的發展以及基因編輯等技術的應用,越來越多的miRNA和蛋白編碼基因的生物學功能將被逐步闡明,這必將為人們充分理解水稻花粉育性的調控機制奠定堅實基礎。
參考文獻:
[1]Itoh J,Nonomura K,Ikeda K,et al. Rice plant development:from zygote to spikelet[J]. Plant & Cell Physiology,2005,46(1):23-47.
[2]Lombardo L,Coppola G,Zelasco S. New technologies for insect-resistant and herbicice-tolerant plants[J]. Trends in Biotechnology,2016,34(1):49-57.
[3]Takeda S,Matsuoka M. Genetic approaches to crop improvement:responding to environmental and population changes[J]. Nature Reviews Genetics,2008,9(6):444-457.
[4]Varshney R K,Hoisington D A,Tyagi A K. Advances in cereal genomics and applications in crop breeding[J]. Trends in Biotechnology,2006,24(11):490-499.
[5]Zhang Q F. Strategies for developing green super rice[J]. Proceedings of the National Academy of Sciences of the United States of America,2007,104(42):16402-16409.
[6]Zhang K,Song Q,Wei Q,et al. Down-regulation of OsSPX1 caused semi-male sterility,resulting in reduction of grain yield in rice[J]. Plant Biotechnology Journal,2016,14(8):1661-1672.
[7]Ashikari M,Sakakibara H,Lin S,et al. Cytokinin oxidase regulates rice grain production[J]. Science,2005,309(5735):741-745.
[8]Wang Y X,Xiong G S,Hu J,et al. Copy number variation at the GL7 locus contributes to grain size diversity in rice[J]. Nature Genetics,2015,47(8):944-948.
[9]Si L Z,Chen J Y,Huang X E,et al. OsSPL13 controls grain size in cultivated rice[J]. Nature Genetics,2016,48(4):447-456.
[10]Wang S K,Li S,Liu Q,et al. The OsSPL16-GW7 regulatory module determines grain shape and simultaneously improves rice yield and grain quality[J]. Nature Genetics,2015,47(3):949-954.
[11]Huang X Z,Qian Q,Liu Z B,et al. Natural variation at the DEP1 locus enhances grain yield in rice[J]. Nature Genetics,2009,41(4):494-497.
[12]Jiao Y Q,Wang Y H,Xue D W,et al. Regulation of OsSPL14 by OsmiR156 defines ideal plant architecture in rice[J]. Nature Genetics,2010,42(6):541-544.
[13]Li S C,Li W B,Huang B,et al. Natural variation in PTB1 regulates rice seed setting rate by controlling pollen tube growth[J]. Nature Communications,2013,4:2793.
[14]Kwon C T,Kim S H,Kim D,et al. The rice floral repressor Early Flowering 1 affects spikelet fertility by modulating gibberellin signaling[J]. Rice,2015,8(1):58.
[15]Lu G W,Coneva V,Casaretto J A,et al. OsPIN5b modulates rice (Oryza sativa) plant architecture and yield by changing auxin homeostasis,transport and distribution[J]. Plant Journal,2015,83(5):913-925.
[16]Xu Y,Yang J,Wang Y H,et al. OsCNGC13 promotes seed-setting rate by facilitating pollen tube growth in stylar tissues[J]. PLoS Genetics,2017,13(7):e1006906.
[17]胡 駿,黃文超,朱仁山,等. 水稻雄性不育與雜種優勢的利用[J]. 武漢大學學報(理學版),2013,59(1):1-9.
[18]Ma H. Molecular genetic analyses of microsporogenesis and microgametogenesis in flowering plants[J]. Annual Review of Plant Biology,2005,56:393-434.
[19]馮九煥,盧永根,劉向東,等. 水稻花粉發育過程及其分期[J]. 中國水稻科學,2001,15(1):21-28.
[20]盧永根,馮九煥,劉向東,等. 水稻(Oryza sativa L.)花粉及花藥壁發育的超微結構研究[J]. 中國水稻科學,2002,16(1):30-38.
[21]譚何新,文鐵橋,張大兵. 水稻花粉發育的分子機理[J]. 植物學通報,2007,24(3):330-339.
[22]Zhang D B,Luo X E,Zhu L. Cytological analysis and genetic control of rice anther development[J]. Journal of Genetics and Genomics,2011,38(9):379-390.
[23]Zhang D B,Wilson Z A. Stamen specification and anther development in rice[J]. Chinese Science Bulletin,2009,54(14):2342-2353.
[24]王 洋. 水稻育性突變體的篩選和育性相關基因OsMSH4及PSS1的克隆與功能研究[D]. 南京:南京農業大學,2013.
[25]Glover J,Grelon M,Craig S,et al. Cloning and characterization of MS5 from Arabidopsis:a gene critical in male meiosis[J]. Plant Journal,1998,15(3):345-356.
[26]Han M J,Jung K H,Yi G,et al. Rice immature pollen 1 (RIP1) is a regulator of late pollen development[J]. Plant & Cell Physiology,2006,47(11):1457-1472.
[27]Jung K H,Han M J,Lee D Y,et al. Wax-deficient anther1 is involved in cuticle and wax production in rice anther walls and is required for pollen development[J]. The Plant Cell,2006,18(11):3015-3032.
[28]Yamagata Y,Yamamoto E,Aya K,et al. Mitochondrial gene in the nuclear genome induces reproductive barrier in rice[J]. Proceedings of the National Academy of Sciences of the United States of America,2010,107(4):1494-1499.
[29]Ueda K,Yoshimura F,Miyao A,et al. COLLAPSED ABNORMAL POLLEN1 gene encoding the arabinokinase-like protein is involved in pollen development in rice[J]. Plant Physiology,2013,162(2):858-871.
[30]Jiang S Y,Cai M N,Ramachandran S. The Oryza sativa no pollen (Osnop) gene plays a role in male gametophyte development and most likely encodes a C2-GRAM domain-containing protein[J]. Plant Molecular Biology,2005,57(6):835-853.
[31]Zhou S R,Wang Y,Li W C,et al. Pollen semi-sterility1 encodes a kinesin-1-like protein important for male meiosis,anther dehiscence,and fertility in rice[J]. The Plant Cell,2011,23(1):111-129.
[32]Wu L A,Guan Y S,Wu Z G,et al. OsABCG15 encodes a membrane protein that plays an important role in anther cuticle and pollen exine formation in rice[J]. Plant Cell Reports,2014,33(11):1881-1899.
[33]Niu B X,,Fu F R,He M,et al. The ATP-binding cassette transporter OsABCG15 is required for anther development and pollen fertility in rice[J]. Journal of Integrative Plant Biology,2013,55(8):710-720.
[34]Zhao G C,Shi J X,Liang W Q,et al. Two ATP binding cassette G transporters,rice ATP binding cassette G26 and ATP binding cassette G15,collaboratively regulate rice male reproduction[J]. Plant Physiology,2015,169(3):2064-2079.
[35]Hong L L,Tang D,Shen Y,et al. MIL2(MICROSPORELESS2) regulates early cell differentiation in the rice anther[J]. New Phytologist,2012,196(2):402-413.
[36]Yi J,Kim S R,Lee D Y,et al. The rice gene DEFECTIVE TAPETUM AND MEIOCYTES 1 (DTM1) is required for early tapetum development and meiosis[J]. Plant Journal,2012,70(2):256-270.
[37]Jung K H,Han M J,Lee Y S,et al. Rice undeveloped tapetum1 is a major regulator of early tapetum development[J]. The Plant Cell,2005,17(10):2705-2722.
[38]Yi J,Moon S,Lee Y S,et al. Defective tapetum cell death 1 (DTC1) regulates ROS levels by binding to metallothionein during tapetum degeneration[J]. Plant Physiology,2016,170(3):1611-1623.
[39]Niu N N,Liang W Q,Yang X J,et al. EAT1 promotes tapetal cell death by regulating aspartic proteases during male reproductive development in rice[J]. Nature Communications,2013,4:1445.
[40]Li N,Zhang D S,Liu H S,et al. The rice tapetum degeneration retardation gene is required for tapetum degradation and anther development[J]. The Plant Cell,2006,18(11):2999-3014.
[41]Shi X,Sun X H,Zhang Z G,et al. GLUCAN SYNTHASE-LIKE 5 (GSL5) plays an essential role in male fertility by regulating callose metabolism during microsporogenesis in rice[J]. Plant and Cell Physiology,2015,56(3):497-509.
[42]Moon S,Kim S R,Zhao G C,et al. Rice GLYCOSYLTRANSFERASE1 encodes a glycosyltransferase essential for pollen wall formation[J]. Plant Physiology,2013,161(2):663-675.
[43]Tsuchiya T,Toriyama K,Ejiri S,et al. Molecular characterization of rice genes specifically expressed in the anther tapetum[J]. Plant Molecular Biology,1994,26(6):1737-1746.
[44]Kaneko M,Inukai Y,Ueguchi-Tanaka M,et al. Loss-of-function mutations of the rice GAMYB gene impair α-amylase expression in aleurone and flower development[J]. The Plant Cell,2004,16(1):33-44.
[45]Tang J Y,Chu C C. MicroRNAs in crop improvement:fine-tuners for complex traits[J]. Nature Plants,2017,3(7):17077.
[46]Ma X X,Shao C G,Wang H Z,et al. Construction of small RNA-mediated gene regulatory networks in the Roots of rice(Oryza sativa)[J]. BMC Genomics,2013,14:510.
[47]Meng Y J,Shao C G,Wang H Z,et al. Construction of gene regulatory networks mediated by vegetative and reproductive stage-specific small RNAs in rice (Oryza sativa)[J]. New Phytologist,2013,197(2):441-453.
[48]李興旺. 水稻絨氈層細胞程序性死亡調控育性的分子機理研究[D]. 武漢:華中農業大學,2011.
[49]Bedinger P. The remarkable biology of pollen[J]. The Plant Cell,1992,4:879-887.
[50]Aya K,Ueguchi-Tanaka M,Kondo M,et al. Gibberellin modulates anther development in rice via the transcriptional regulation of GAMYB[J]. The Plant Cell,2009,21(5):1453-1472.
[51]Lee S,Jung K H,An G H,et al. Isolation and characterization of a rice cysteine protease gene,OSCP1,using T-DNA gene-trap system[J]. Plant Molecular Biology,2004,54(5):755-765.
[52]Zhang D S,Liang W Q,Yin C S,et al. OsC6,encoding a lipid transfer protein,is required for postmeiotic anther development in rice[J]. Plant Physiology,2010,154(1):149-162.
[53]Zhang D S,Liang W Q,Yuan Z,et al. Tapetum degeneration retardation is critical for aliphatic metabolism and gene regulation during rice pollen development[J]. Molecular Plant,2008,1(4):599-610.
[54]Li L,Li Y,Song S,et al. An anther development F-box (ADF) protein regulated by tapetum degeneration retardation (TDR) controls rice anther development[J]. Planta,2015,241(1):157-166.
[55]Cai C F,Zhu J,Lou Y,et al. The functional analysis of OsTDF1 reveals a conserved genetic pathway for tapetal development between rice and Arabidopsis[J]. Science Bulletin,2015,60(12):1073-1082.
[56]Zhao X A,de Palma J,Oane R,et al. OsTDL1A binds to the LRR domain of rice receptor kinase MSP1,and is required to limit sporocyte numbers[J]. Plant Journal,2008,54(3):375-387.
[57]Yang X J,Liang W Q,Chen M J,et al. Rice fatty acyl-CoA synthetase OsACOS12 is required for tapetum programmed cell death and male fertility[J]. Planta,2017,246(1):105-122.
[58]Li Y L,Li D D,Guo Z L,et al. OsACOS12,an orthologue of Arabidopsis acyl-CoA synthetase5,plays an important role in pollen exine formation and anther development in rice[J]. BMC Plant Biology,2016,16(1):256.
[59]Lee S K,Eom J S,Hwang S K,et al. Plastidic phosphoglucomutase and ADP-glucose pyrophosphorylase mutants impair starch synthesis in rice pollen grains and cause male sterility[J]. Journal of Experimental Botany,2016,67(18):5557-5569.
[60]Xu X B,Bai H Q,Liu C P,et al. Genome-Wide analysis of MicroRNAs and their target genes related to leaf senescence of rice[J]. PLoS One,2014,9(12):e114313.
[61]Kozomara A,Griffiths-Jones S. miRBase:annotating high confidence microRNAs using deep sequencing data[J]. Nucleic Acids Research,2014,42:D68-D73.
[62]Singh S,Parihar P,Singh R,et al. Heavy metal tolerance in plants:role of transcriptomics,proteomics,metabolomics and ionomics[J]. Frontiers in Plant Science,2015,6:1143.
[63]Li S X,Liu J X,Liu Z Y,et al. HEAT-INDUCED TAS1 TARGET1 mediates thermotolerance via heat stress transcription factor a1a-directed pathways in Arabidopsis[J]. The Plant Cell,2014,26(4):1764-1780.
[64]Shriram V,Kumar V,Devarumath R M,et al. MicroRNAs as potential targets for abiotic stress tolerance in plants[J]. Frontiers in Plant Science,2016,7:817.
[65]Wei L Q,Yan L F,Wang T. Deep sequencing on genome-wide scale reveals the unique composition and expression patterns of microRNAs in developing pollen of Oryza sativa[J]. Genome Biology,2011,12(6):R53.
[66]Li X,Shahid M Q,Wu J W,et al. Comparative small RNA analysis of pollen development in autotetraploid and diploid rice[J]. International Journal of Molecular Sciences,2016,17(4):499.
[67]Li X,Shahid M Q,Xia J,et al. Analysis of small RNAs revealed differential expressions during pollen and embryo sac development in autotetraploid rice[J]. BMC Genomics,2017,18:129.
[68]Yamaguchi A,Wu M F,Yang L,et al. The MicroRNA-Regulated SBP-Box transcription factor SPL3 is a direct upstream activator of LEAFY,FRUITFULL,and APETALA1[J]. Developmental Cell,2009,17(2):268-278.
[69]Zhang H Y,Hu J H,Qian Q,et al. Small RNA profiles of the rice PTGMS line wuxiang S reveal miRNAs involved in fertility transition[J]. Frontiers in Plant Science,2016,7:514.
[70]Zhou H,Liu Q J,Li J,et al. Photoperiod- and thermo-sensitive genic male sterility in rice are caused by a point mutation in a novel noncoding RNA that produces a small RNA[J]. Cell Research,2012,22(4):649-660.
[71]Li W,Jiang L,Zhou S,et al. Fine mapping of pss1,a pollen semi-sterile gene in rice(Oryza sativa L.)[J]. Theoretical and Applied Genetics,2007,114(5):939-946.
[72]Liu Z H,Bao W J,Liang W Q,et al. Identification of gamyb-4 and analysis of the regulatory role of GAMYB in rice anther development[J]. Journal of Integrative Plant Biology,2010,52(7):670-678.
[73]Deveshwar P,Bovill W D,Sharma R,et al. Analysis of anther transcriptomes to identify genes contributing to meiosis and male gametophyte development in rice[J]. BMC Plant Biology,2011,11:78.

