蔬菜土傳病原菌三重PCR檢測體系的建立與應用
劉芮池,程有普,柴阿麗,石延霞,謝學文,帕提古麗,李寶聚
(1中國農業科學院蔬菜花卉研究所,北京 100081;2天津農學院園藝園林學院,天津300384;3新疆農業科學院園藝作物研究所,烏魯木齊 830091)
0 引言
【研究意義】瓜果腐霉(Pythium aphanidermatum)隸屬卵菌門,是一種重要的土傳病原菌,通常侵染幼苗的根和種子,造成大量死苗[1]。尖鐮孢(Fusarium oxysporum)是一種世界性分布的土傳病原菌,引起維管束病害,近幾年來蔬菜枯萎病發生面積逐年擴大[2-3]。大麗輪枝菌(Verticillium dahliae)可侵染大豆、番茄、茄子、馬鈴薯等,引發黃萎病、根腐病、莖基腐病等,目前尚無有效防治手段[4]。由于這 3種病原菌引起的病害癥狀與其他植物病害相似度高,尤其病害初期癥狀不明顯,僅靠肉眼不能準確判斷病害種類。而防治不同病原菌所用藥劑不同,錯誤的診斷導致用藥及防治失敗,所以在病害潛伏期或發病初期作出準確診斷,有利于及時采取針對性防治措施,減少損失[5-7]。因此,對于上述3種侵染蔬菜的土傳病原菌,亟需建立科學、準確、快速、高通量的檢測方法。【前人研究進展】傳統的病害診斷依賴于病害癥狀的觀察和病原菌的分離與鑒定,但病害的癥狀觀察需要典型癥狀出現才可準確判斷,病原菌的分離培養易受環境、培養條件等影響,操作復雜,耗時長,不能滿足高通量、快速的檢測要求,不利于大規模樣品的分析鑒定[8-12]。隨著分子生物學的飛速發展,已有許多成熟的技術可用于植物病原菌的檢測。THOMAS等[13]利用腐霉菌的18S rRNA基因保守區域,設計特異性引物 Pyth712Fwd/Pyth1758Rev對腐霉菌屬進行了普通PCR檢測;加拿大地區的大豆生產受腐霉菌影響嚴重,MARCHAND等[14]于 2010—2012年采集土壤樣本,對分離出的腐霉菌進行PCR擴增和測序以鑒定不同的腐霉菌物種;GEISER等[15]采用引物EF1/EF2擴增TEF基因區域以鑒定鐮孢菌;RAHJOO等[16]于2004—2005年在伊朗11個地區分離出191株鐮孢菌,通過TEF區域特異性引物VER1/2和PRO1/2進行PCR擴增,鑒定結果顯示分別為尖鐮孢、層出鐮孢(F. proliferatum)和黃色鐮孢(F. culmorum);LI等[17]設計了引物NMS1/NMS2用于輪枝菌屬的鑒定;BRESSAN等[18]通過ITS區域建立了一種快速、特異的PCR檢測方法用于土壤中大麗輪枝菌的檢測,檢測靈敏度為4 fg。【本研究切入點】針對多種土傳病原菌的多重PCR檢測技術的研究鮮有報道。針對田間多種病原菌復合侵染問題,建立3種土傳病原菌的多重PCR體系,同時檢測多種病原菌,提高檢測效率,為病害防治贏得時間。【擬解決的關鍵問題】篩選適宜的檢測引物,優化多重PCR檢測體系,建立能夠同時檢測蔬菜瓜果腐霉、尖鐮孢和大麗輪枝菌的多重PCR檢測方法,提高病原菌檢測效率,為病害的診斷提供技術支持。
1 材料與方法
試驗于2017年12月至2018年12月在中國農業科學院蔬菜花卉研究所完成。
1.1 試驗材料
供試菌株由中國農業科學院蔬菜花卉研究所蔬菜病害綜合防治課題組提供,其中瓜果腐霉、尖鐮孢、大麗輪枝菌為檢測病菌(表1)。
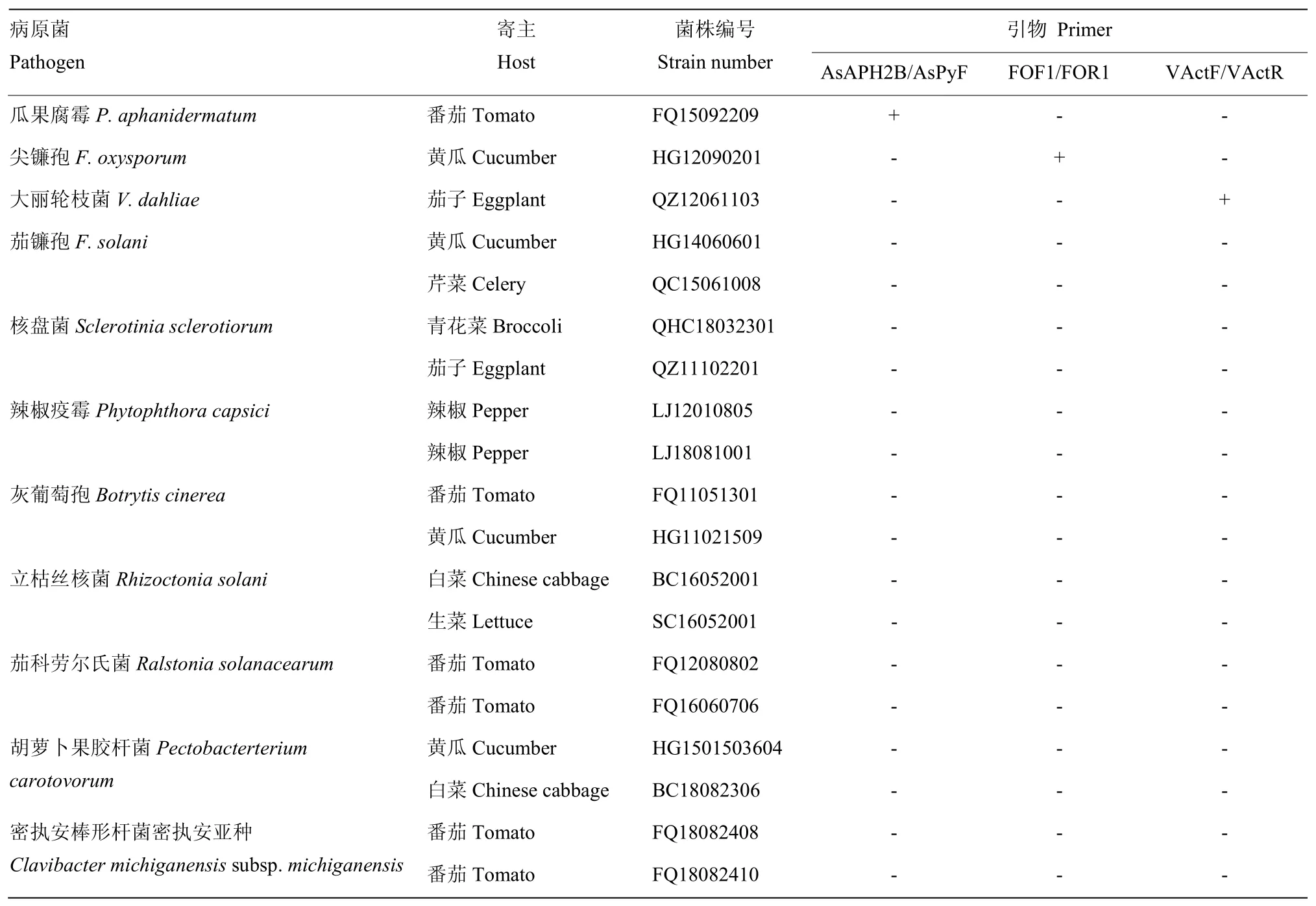
表1 供試菌株Table 1 The strains used in the test
1.2 基因組DNA的提取
取適量凍干菌絲樣品,采用CTAB法提取病原菌基因組DNA,-20℃保存備用。
1.3 多重PCR引物組合
檢索國內外關于瓜果腐霉、尖鐮孢、大麗輪枝菌的分子檢測報道,選取可能組合的引物。瓜果腐霉采用 ASANO等[19]設計的特異引物 AsAPH2B/AsPyF;尖鐮孢引物采用FOF1/FOR1[20];大麗輪枝菌采用引物VActF/VActR[21]。
通過NCBI網站對引物組進行BLAST比對,檢測這3對引物之間相似度是否符合組成多重PCR的條件,設計試驗進一步驗證。引物由北京博邁德生物技術有限公司合成(表2)。
1.4 多重PCR體系的建立
對影響三重 PCR體系的重要因素進行優化。58—65℃之間設計梯度PCR反應程序,共58、58.7、59.6、60.8、62.4、63.7、64.5、65℃ 8個梯度;引物AsAPH2B/AsPyF 濃度設定 0.12、0.16 和 0.20 μmol·L-13個梯度,引物 FOF1/FOR1濃度設定 0.16、0.20和0.24 μmol·L-13個梯度,引物VActF/VActR濃度設定0.24、0.28和 0.32 μmol·L-13個梯度;3個延伸時間分別設為30 s、45 s、1 min;3個循環次數分別設為30、35、40次。
PCR儀進行擴增,反應結束后取5 μL擴增產物進行瓊脂糖凝膠電泳,使用 Bio-rad凝膠成像系統照相。結果按照病原菌擴增的特異性和敏感性,即條帶的強弱、雜帶的有無等進行綜合評價。
1.5 陽性樣品擴增產物的測序及分析
對陽性樣品的擴增產物進行雙向測序,并在GenBank中進行BLAST分析,以驗證PCR的特異性。
1.6 三重PCR反應特異性檢測
選取瓜果腐霉、尖鐮孢、大麗輪枝菌基因組DNA等量混合均勻,分別以辣椒疫霉、立枯絲核菌、核盤菌等16株蔬菜土傳病原菌基因組DNA為對照,利用優化好的三重PCR反應條件進行三重PCR檢測,檢驗該體系的特異性。

表2 供試引物Table 2 The primers used in the test
1.7 三重PCR反應靈敏度檢測
將瓜果腐霉、尖鐮孢、大麗輪枝菌基因組 DNA模板濃度設置為 10、1、10-1、10-2、10-3、10-4和 10-5ng·μL-1,使用優化后的三重 PCR反應條件進行 PCR擴增,取5 μL擴增產物進行瓊脂糖凝膠電泳,凝膠成像系統照相。分別檢測單一病原菌及混合病原菌的反應靈敏度。
1.8 三重PCR檢測體系的穩定性
為檢驗體系的穩定性和可重復性,分別使用北京博邁德生物技術有限公司的2×Taq Master PCR Mix和大連寶生物工程有限公司的TaKaRa Taq酶進行三重 PCR 反應。其中 TaKaRa Taq(5 units/μL)0.125 μL,10×PCR Buffer 2.5 μL,dNTP Mixture(各 2.5 mmol·L-1)2 μL,其他條件相同。兩種反應體系均分別使用 AerisTM型(新加坡藝思高科技有限公司)和C1000 TouchTM型(賽默飛世爾科技有限公司)的熱循環儀進行擴增[22]。
1.9 人工模擬接種基質中病原菌的檢測
1.9.1 人工模擬帶菌基質制備 將瓜果腐霉、尖鐮孢、大麗輪枝菌菌株分別接種于OA和PDA平板,25℃恒溫培養10 d,收集瓜果腐霉菌絲,稱重,制成終濃度為10 mg·mL-1的菌絲懸液,10倍梯度稀釋,將100 mL菌懸液加入到100 g無菌基質中,分別制備成濃度為 10、1、10-1、10-2、10-3、10-4、10-5mg·g-1的模擬帶菌基質[23]。用滅菌刷刷下尖鐮孢和大麗輪枝菌平板上的孢子,分別配成濃度為106個孢子/mL懸浮液,10倍梯度稀釋。將 100 mL菌懸液加入到100 g無菌基質中,分別制備成濃度為108、107、106、105、104、103、102個孢子/mL的模擬帶菌基質。將分別帶有 3種病原菌的基質等比混合制成混合帶菌基質。在每100 g模擬帶菌土中隨機抽取1 g土樣,冷凍干燥備用[24]。
1.9.2 帶菌基質中 DNA的提取 采用 Fast DNA SPIN Kit for Soil(美國MP Biomedicals土壤基因組DNA提取試劑盒)對基質進行基因組DNA的提取,-20℃保存。
1.9.3 三重 PCR檢測人工模擬帶菌基質 以不同濃度模擬帶菌基質總DNA為模板,使用優化的三重PCR方法檢測模擬的帶菌基質,確定該引物對基質中病原菌分生孢子的檢測靈敏度。
1.10 三重PCR體系的應用
田間采集根腐病、枯萎病及黃萎病病害根莖樣本35份,土壤樣本149份,其中根圍土壤取自距發病植株根圍2 mm,深5—10 cm的土壤,過篩去除雜物,取0.5 g根圍土壤提取基因組DNA,提取病組織和根圍土壤基因組DNA,并采用優化后的多重PCR反應體系進行檢測,同時進行病原菌分離培養,以驗證該三重PCR檢測體系。
2 結果
2.1 三重PCR反應體系的建立
通過對退火溫度、引物濃度組合、延伸時間和循環次數的優化,最終確定三重PCR反應體系(總體積為 25 μL):2×Taq Master PCR Mix 12.5 μL,10 μmol·L-1的引 物 AsAPH2B/AsPyF、FOF1/FOR1、VActF/VActR 分別為 0.3、0.4、0.6 μL,模板各 1 μL,補加ddH2O至25 μL。反應程序:94℃預變性5 min;94℃變性30 s,60.8℃退火30 s,72℃延伸30 s,35個循環;72℃延伸10 min(圖1)。
2.2 陽性樣品擴增產物的測序及分析
采用優化后的三重PCR檢測體系對瓜果腐霉、尖鐮孢和大麗輪枝菌進行擴增,擴增產物經克隆測序后,通過GenBank上BLAST比對,同源性均達到99%,因此確定擴增產物均為目標菌株(表3)。
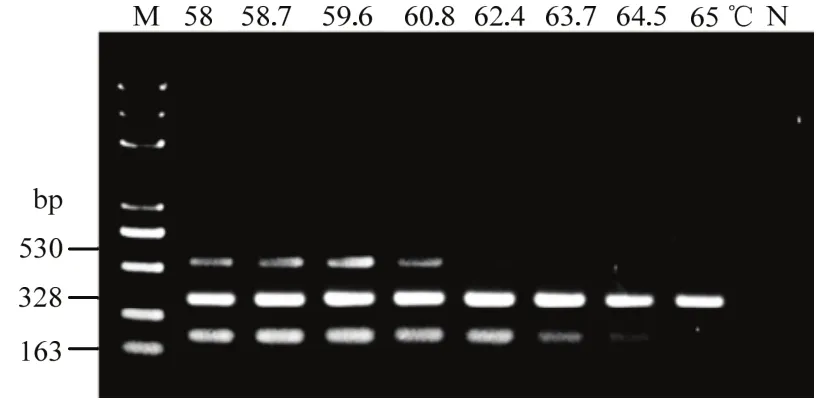
圖1 三重PCR退火溫度優化Fig. 1 Optimization of the annealing temperature for triplex PCR

表3 擴增產物比對結果Table 3 The results of PCR products
2.3 三重PCR反應特異性檢測
按照優化后的反應條件,引物AsAPH2B/AsPyF、FOF1/FOR1和VActF/VActR同時擴增出瓜果腐霉、尖鐮孢和大麗輪枝菌的基因組 DNA,獲得 163、328和530 bp的特異條帶,而其他蔬菜病原菌都沒有特異條帶(圖2)。

圖2 三重PCR特異性檢測Fig. 2 The specific detection of triplex PCR
2.4 三重PCR檢測體系的靈敏度
三重PCR體系中,3對引物擴增單個模板能夠檢測到 10-2ng·μL-1的瓜果腐霉、尖鐮孢和 10-1ng·μL-1大麗輪枝菌基因組DNA,同時擴增3個模板的靈敏度為 10-1ng·μL-1(圖 3、圖 4)。
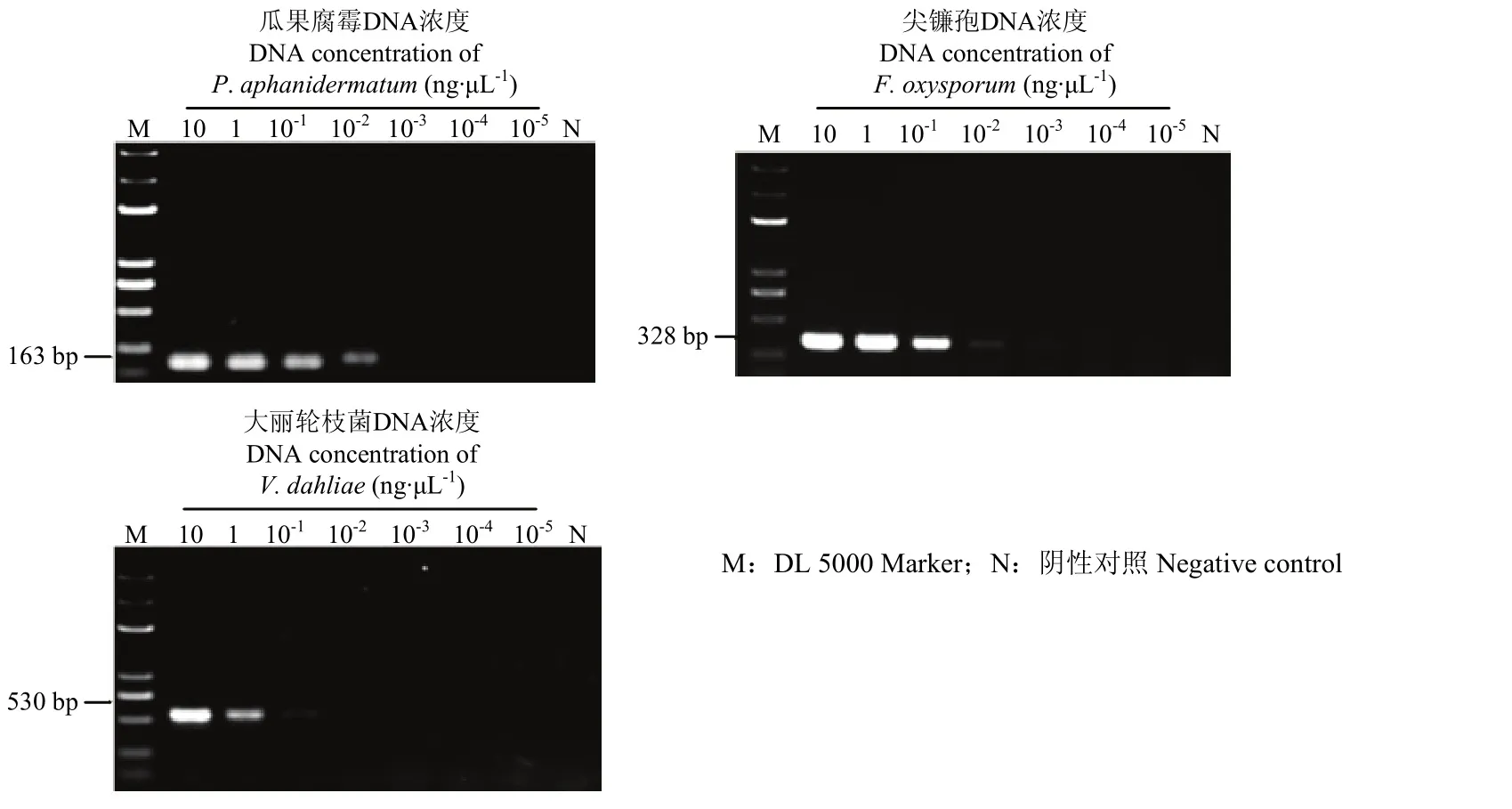
圖3 三重PCR檢測單一病原菌的靈敏度Fig. 3 The sensitivity of triplex PCR for detection of DNA from a single pathogen
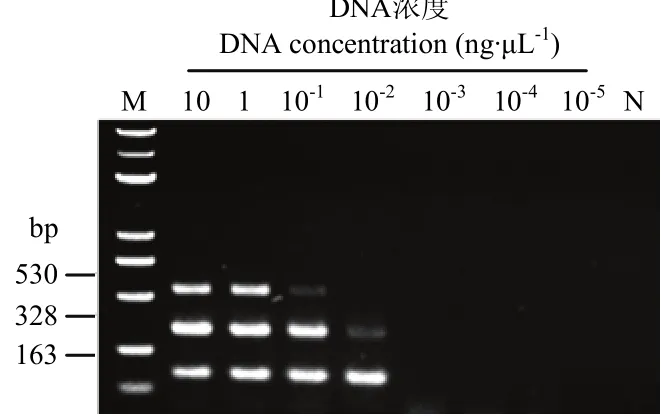
圖4 三重PCR檢測靈敏度Fig. 4 The sensitivity of triplex PCR detection
2.5 三重PCR檢測體系的穩定性
采用大連寶生物工程有限公司和北京博邁德生物技術有限公司生產的Taq酶,PCR儀采用賽默飛世爾科技有限公司的C1000 TouchTM和新加坡藝思高科技有限公司的AerisTM熱循環儀,以3種病原菌的基因組DNA為模板,進行三重PCR檢測。結果顯示,均可以擴增出3種病原菌的特異性目的片段(圖5)。因此,所建立的三重PCR反應體系穩定,可用于瓜果腐霉、尖鐮孢和大麗輪枝菌的快速診斷。

圖5 三重PCR體系穩定性檢測Fig. 5 The stability detection of triplex PCR system
2.6 人工模擬接種基質檢測
利用三重PCR方法對瓜果腐霉模擬帶菌基質、尖鐮孢模擬帶菌基質、大麗輪枝菌模擬帶菌基質、混合帶菌基質和未加菌基質進行定量檢測,結果顯示對瓜果腐霉的檢測靈敏度為10-2mg菌絲/g,尖鐮孢檢測靈敏度為106個孢子/g,大麗輪枝菌的檢測靈敏度為105個孢子/g;混合體系下對于尖鐮孢和大麗輪枝菌的檢測靈敏度為106個孢子/g,對瓜果腐霉的靈敏度是10-2mg菌絲/g;而未加菌的基質DNA中未檢測到(圖6)。因此,所建立的三重PCR反應體系可應用于基質中瓜果腐霉、尖鐮孢和大麗輪枝菌的檢測。
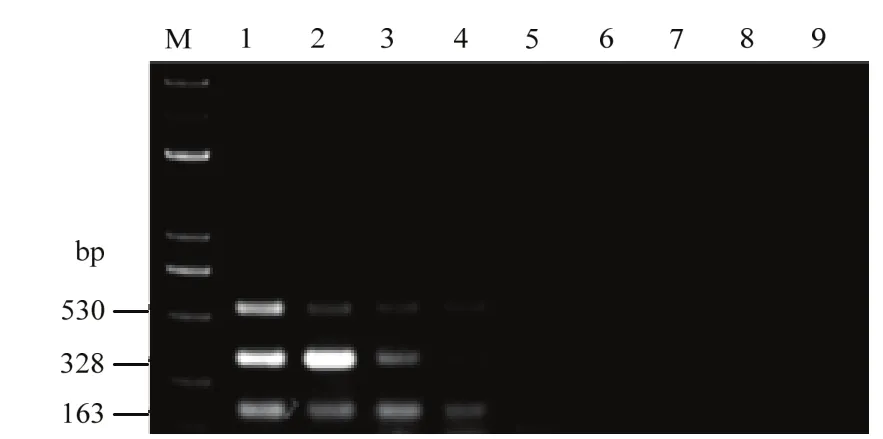
圖6 模擬帶菌基質三重PCR檢測靈敏度Fig. 6 Sensitivity of triplex PCR detection in artificially inoculated substrate
2.7 三重PCR體系的應用
分別從35份病組織和149份土壤中提取基因組DNA,進行三重PCR檢測。結果顯示4份病組織中檢測到大麗輪枝菌,3份病組織中檢測到瓜果腐霉,18份病組織中檢測到尖鐮孢,10份病組織中未檢測到目標菌,病菌檢出率為71.43%,檢測結果與病害癥狀及分離培養結果吻合;在土壤檢測中19份土壤檢測到大麗輪枝菌,22份土壤檢測到尖鐮孢,30份土壤檢測到瓜果腐霉,78份土壤中未檢測到目標菌,檢測結果與分離培養結果吻合(表 4)。由此可見,通過對蔬菜病組織及其根圍土壤進行三重PCR檢測,可進行田間蔬菜瓜果腐霉、尖鐮孢和大麗輪枝菌的快速診斷。

表4 不同地區病害樣本三重PCR檢測Table 4 Identification of diseases samples in different areas by triplex PCR
3 討論
我國蔬菜生產種苗需求量超過6 800億株/年,育苗基質需求量大[25],由于育苗基質原料來源復雜,基質生產未能實現標準化,由基質帶菌引起的蔬菜土傳病害大面積發生問題時有發生,造成嚴重的經濟損失。2015年渭南市大荔、臨渭等西瓜產區種植戶使用育苗基質培育西瓜苗后造成80%以上秧苗葉片發黃、根莖 部 腐 爛 ( http://bbs.hsw.cn/read-htm-tid-7334210-displayMode-1.html);2017年8月,河南省崇召村菜農購買的育苗基質帶菌,造成白菜、西蘭花等蔬菜葉片大面積發黃、枯萎(http://www.cfvin.com/n/2017/08/24/164307287466.shtml)。因此,為防止基質帶菌引起土傳病害發生和傳播,基質出廠前的帶菌檢測非常重要。目前國內對蔬菜土傳病原菌的多重PCR體系報道較少,大多為在植株發病后根據病情對相應的病原菌進行普通PCR檢測,但此種方法不能提前發現基質中的病原菌,具有滯后性,且每次只能檢測一種病原菌,而病原菌復合侵染情況在田間普遍存在,因此能夠同時檢測多種病原菌的多重 PCR技術具有較大的應用價值。
多重PCR是在同一PCR體系里加入多對特異性引物,體系復雜,因素影響多,所以多重PCR反應體系建立較難。其中引物的選擇直接影響PCR擴增的特異性與靈敏度,同時要防止引物相互配對,又要能夠區分擴增片段大小。因此,需要選擇適合長度的引物序列,從而獲得最優的檢測靈敏度和特異性以及各目標片段擴增均一性[26-27]。目前國際上關于瓜果腐霉、尖鐮孢和大麗輪枝菌的分子檢測研究較多[12-17],但同時檢測這3種病原菌的多重PCR尚未見報道。根據多重PCR引物設計原則,本研究在參考大量文獻引物的基礎上,通過NCBI網站進行引物組BLAST比對,篩選出適用于多重PCR的引物組合,成功建立了對瓜果腐霉、尖鐮孢和大麗輪枝菌進行檢測的三重PCR檢測體系。該體系降低了檢測過程的復雜性和成本,節省時間并提高了檢測的準確性,在混合 DNA下檢測靈敏度為10-1ng·μL-1,與何宛芹等[28]根據EF-1α基因設計引物建立的鐮孢菌四重 PCR檢測體系靈敏度一致。孫娟等[29]建立了能夠同步檢測棉花黃萎病菌、枯萎病菌和炭疽病菌的三重 PCR檢測體系,靈敏度為1.06 ng·μL-1,其靈敏度低于本研究所建立的三重PCR檢測體系。
另外,本研究建立的三重PCR檢測體系可用于基質中病原菌的檢測,做到了預防病害發生,滿足當前生產需要。同時,克服了土壤檢測中病原菌含量少、雜質多等弊端,每克土壤中含有 106個孢子即可被檢測到。土壤微生物總 DNA的富集和提取是該檢測手段實際應用中的關鍵問題,仍需進一步深入研究。本研究建立的三重 PCR體系可以在早期準確地檢測出田間蔬菜病株根圍土壤中的瓜果腐霉、尖鐮孢和大麗輪枝菌,在病害潛伏期和發病初期就能對3種病害進行快速診斷,從而有效預防和控制蔬菜病害,具有較高的應用價值。
4 結論
通過引物篩選組合和條件優化,建立了可同時檢測瓜果腐霉、尖鐮孢和大麗輪枝菌3種蔬菜重要病原菌的三重PCR體系。該體系具有靈敏度高、穩定性和重復性好的特點,能夠快速、準確地檢測田間病株及其根圍土壤中的瓜果腐霉、尖鐮孢、大麗輪枝菌,為蔬菜土傳病害的早期預防和流行監測提供了有效的技術手段。

