局部應用不同劑型氨甲環酸對初次全髖關節置換術圍手術期失血量的影響*
袁明武 李理 李兵
圍手術期失血量對外科手術患者術后快速康復有著極其重要的意義,有效地減少圍手術期失血量能促進患者術后康復,氨甲環酸(tranexamic acid,TXA)已廣泛應用于現代外科手術中減少圍手術期出血量[1-2]。近年來大量研究報道指出,不同的給藥途徑對失血量有不同的作用效果,單側初次全髖關節置換術(total hip arthroplasty,THA)中TXA 靜脈聯合局部關節腔注射較單純靜脈使用而言,有效地減少了關節置換后引流管引流量、總失血量及輸血率[3]。目前,還沒有報道研究不同劑型的TXA 局部作用對圍手術期失血量的影響。本次研究采用前瞻性研究方法,選取2016 年10 月至2018 年10 月行初次單側THA 治療的180 例患者,探討不同劑型TXA 對降低THA 失血量的有效性和安全性,以期為臨床圍手術期TXA 用藥提供新的方法及理論依據。
1 資料與方法
1.1 一般資料
選取2016 年10 月至2018 年10 月初次單側THA 治療的180 例患者。納入標準:股骨頸骨折、髖關節骨關節炎晚期而保守治療無效、股骨頭壞死晚期、強直性脊柱炎累及髖關節晚期、髖臼發育不良等,以上具備全髖關節置換手術指征患者;對治療知情同意,依從性好。排除標準:并發凝血功能異常者;口服抗凝藥物或其他影響凝血功能藥物者;雙側髖關節一期同時置換者。將患者按隨機數表法分為3 組:A 組(對照組,60 例)單純靜脈使用TXA,手術開始前10 min 將TXA 按20 mg/kg 稀釋于250 mL 等滲鹽水中靜脈滴注;B 組(水TXA 組,60 例)靜脈聯合局部使用TXA(水劑),術前按A 組方法靜脈滴注TXA,于假體安放完畢沖洗后,將2 g TXA 溶于20 mL 生理鹽水,局部浸泡手術部位后進行縫合;C 組(粉TXA 組,60 例)靜脈聯合局部使用TXA(粉劑),術前按A 組方法靜脈滴注TXA,關閉關節腔前將2 g TXA 粉劑直接倒入腔內后縫合傷口。本實驗患者男女人數、年齡、身高、體重、術前血紅蛋白及紅細胞比容等數據見表1,所有患者均無嚴重內/外科基礎疾病,各項數據比較差異無統計學意義(>0.05)。三組患者THA 由同一組醫師完成,手術方式一致,手術時間均控制在35 ~45 min,平均40 min。麻醉方式全部采用靜脈復合麻醉。假體全部采用美國強生公司非骨水泥固定型人工髖關節,術后24 h 內拔除引流管。
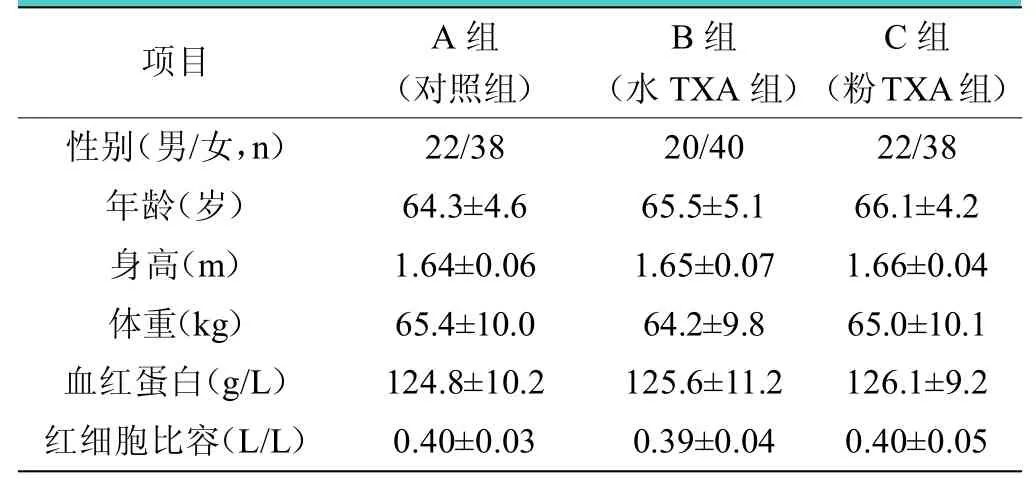
表1 各組患者術前一般資料比較
1.2 觀察指標
1.2.1 臨床檢查項目
記錄術中失血量、術后24 h 內引流量。
1.2.2 實驗室檢查項目
術前及術后1、3 d 檢查患者血常規,術后5 d 檢查雙下肢深靜脈彩超,同時計算出絕對失血量。
1.3 失血量的計算方法
術前和術后1、3 d 分別檢測患者血紅蛋白量、紅細胞比容(hematocrit volue,Hct)等指標。術中失血量:根據負壓吸引器里的液體、紗布的重量計算。術后失血量:根據引流液總量計算。術后絕對失血量=70×體重×Hct 減少值/平均Hct[Hct 減少值=術前Hct-術后最低Hct;平均Hct=(術前Hct+術后最低Hct)/2]。
1.4 統計學方法
計量資料以均數±標準差表示,采用SPSS 21.0 統計學軟件進行方差分析,組間行兩獨立樣本 檢驗;計數資料以率表示,組間采用檢驗兩兩比較。<0.05 為差異有統計學意義。
2 結果
2.1 失血結果
A、B、C 組術中失血量無明顯差異,但術后引流量分別為(520.43±105.85)mL、(304.83±85.45)mL、(110.43±75.85)mL,組間比較差異均有統計學意義(<0.05),其中C 組血液丟失量最少。通過計算得出絕對失血量分別為(1160.62±245.25)mL、(886.14±205.45)mL、(606.67±105.89)mL,各組間比較差異均有統計學意義(<0.05,見表2)。
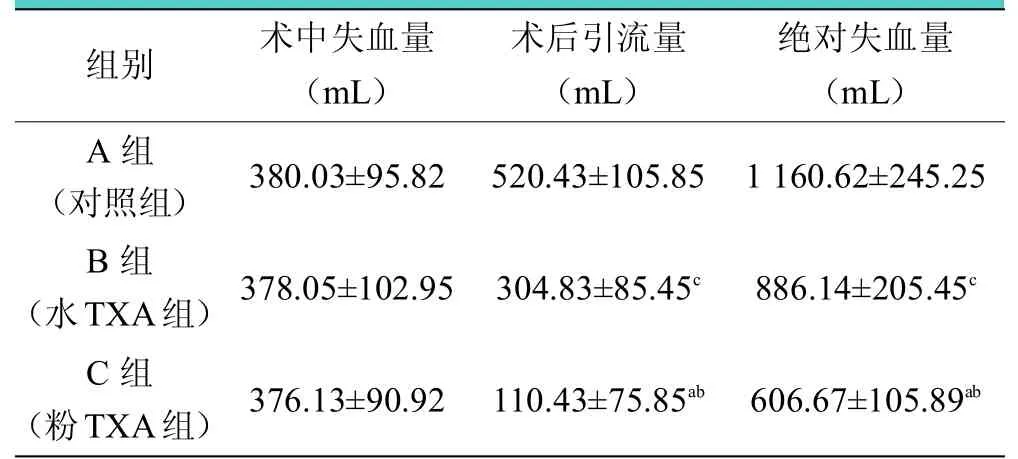
表2 各組患者失血量比較
2.2 術后血紅蛋白含量及深靜脈血栓形成率
術后1、3d 血紅蛋白量比較,各組間差異均有統計學意義(均<0.05),C 組血紅蛋白量最高,輸血率最低(見表3)。A、B 組深靜脈血栓(deep vein thrombosis,DVT)發生率為0%;C 組有1 例患者出現下肢深靜脈血栓,經抗凝、溶栓等保守治療而治愈,所有患者均無肺動脈栓塞發生,三組間DVT 發生率比較差異無統計學意義(>0.05)(見表4)。
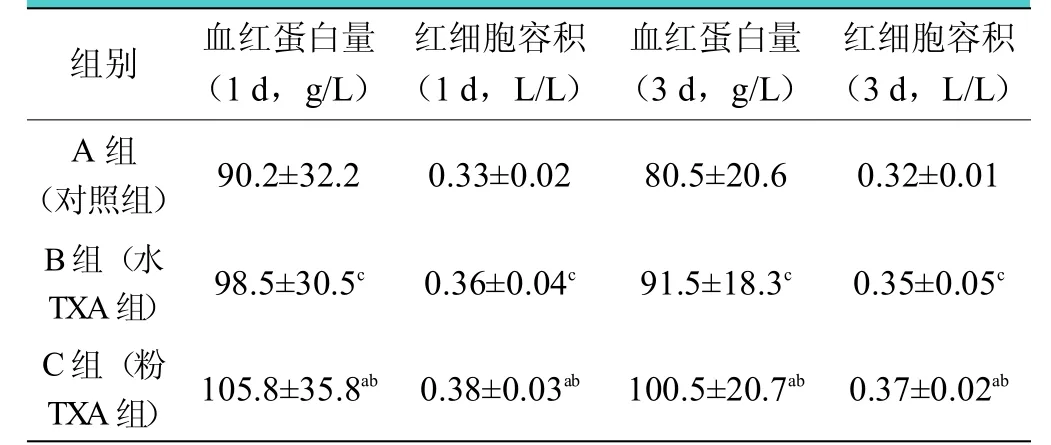
表3 各組患者術后血紅蛋白量、紅細胞容積的比較

表4 各組患者術后輸血率及深靜脈血栓發生率的比較
3 討論
股骨頭壞死(osteonecrosis of femoral head,ONFH)是股骨頭血供中斷或受損,引起骨細胞及骨髓成分死亡及隨后的修復,繼而導致股骨頭結構改變、股骨頭塌陷、關節功能障礙的疾病。按照致病因素分為創傷性ONFH 和非創傷性ONFH,前者主要是由股骨頸骨折、髖關節脫位等髖部外傷引起的,后者在我國的主要原因為皮質類固醇的應用及酗酒[4]。創傷性或非創傷性ONFH 都不同程度引起血流動力學改變:骨折作為最常見的外科疾病之一,當其發生后,患者的血液處于易凝、高粘狀態,此時易誘發深靜脈血栓[5];研究發現,激素引起的股骨頭壞死患者血液中的一些抑制纖溶酶原激活的相關因子顯著高于正常人,容易引起血液凝血機制的異常,最終導致股骨頭壞死[6]。目前創傷性或非創傷性ONFH 的患者最普遍的治療方式是THA,手術過程中麻醉、術中失血、臨床輸血、心輸血量急劇減少以及軟組織的滲出等均會增加血液的黏稠度,使血液處于高凝狀態[7]。所以不管是從疾病的發病機制還是手術本身產生的影響等方面考慮,THA 中適當使用藥物加強血液系統的管理是必要的。這樣不僅可以減少出血量,還可以預防術中及術后血栓形成。
THA 大量失血不僅來自于術中出血和術后引流,更與纖溶亢進所致隱性失血密切相關[8-9]。TXA 是抗纖維蛋白溶解藥的代表藥,為人工合成的賴氨酸衍生物,能競爭性阻斷纖溶酶原和纖溶酶上的賴氨酸結合位點,通過抑制纖溶酶原激活物的產生或者直接抑制纖溶酶活性,從而拮抗纖維蛋白在纖溶酶作用下的溶解,分解由亢進的纖溶酶引起的血小板凝聚抑制劑凝固因子,而發揮良好的止血作用[10]。目前,TXA 給藥方式主要包括肌內注射、靜脈使用、口服及關節腔內注射[11-13]。
早期大量研究表明,靜脈應用TXA 的優勢是可于全身范圍抑制因手術激活的纖溶亢進,不僅有效減少顯性失血,更減少隱性失血[13-14];后期研究又發現局部應用TXA 較單純靜脈用藥防止血液丟失效果更佳,優勢在于局部的靶向性更強,能于手術出血部位充分發揮作用,且全身吸收少,減少全身副作用。例如,Chang 等[15]采用1/3 5%TXA 10 mL注入關節囊和關節周圍肌肉內,2/3 縫皮后注入關節筋膜內取得良好效果。Konig 等[16]將3 g TXA 用100 mL 生理鹽水稀釋,注入關節腔內,輸血率降低至14%。目前局部使用水劑TXA 注入關節腔可以更加有效控制術后失血,臨床上已被廣泛接受,但筆者認為其做法增加的配藥環節有污染的風險,直接放入粉劑可以保證絕對局部高濃度的同時減少其弊端。
至今,關于局部應用的不同劑型TXA 的研究報道罕見,本研究使用粉劑TXA 直接均勻撒入關節腔軟組織。留置TXA 后,常規鉗夾引流管2 h,能維持關節內藥物濃度,允許足夠的時間發揮抗纖維蛋白溶解作用,從而達到良好的止血效果,術后引流量及絕對失血量均低于局部水劑應用TXA組,可能是由于粉劑形成局部TXA 濃度較高,且不容易滲透丟失,故作用效果更強,有效地減少術后輸血率。但該方法尚未形成標準化用法,具體濃度也受多方面因素影響,存在由于過度使用藥物而產生一定的副作用的可能,有一定爭議性。就本次研究而言,粉劑TXA 關節腔應用并不增加并發癥發生率,術后DVT 發生率無明顯差異,均未發現肺栓塞、腦梗等嚴重并發癥。粉劑TXA 在THA 中使用不會增加深靜脈血栓的發生風險及相應并發癥導致患者死亡,尚屬安全。基于粉劑TXA 能有效減少THA 中血液的丟失,筆者目前還對少數患者嘗試此方法于THA術后不留置引流管,均未發現血腫、感染等并發癥,所以筆者認為粉劑TXA 可以免除放置引流管環節,降低感染風險,增加患者舒適度,促進早期功能鍛煉。本次研究也存在一些不足之處,例如深靜脈血栓、感染等術后并發癥只局限于圍手術期的觀察,隨訪時間較短,應加強術后隨訪收集相關并發癥數據以更有力地證實粉劑TXA 的臨床實用價值。此外,由于樣本量較少,在今后的研究中需增加樣本的數量來進一步證實關節腔局部應用粉劑TXA 的作用效果及安全性。

