輝鉬精礦提取冶金技術研究進展
徐 雙,余春榮
(江鎢世泰科鎢品有限公司,江西 贛州 341000)
0 引 言
鉬是一種稀有高熔點金屬,具有導電導熱性強、膨脹系數小、高溫強度高、加工性能穩定、受壓較易加工等優良性能,是不銹鋼、合金鋼等材料的重要添加劑,成為國民經濟發展中重要的工業原材料和不可替代的戰略性物資,廣泛應用于鋼鐵、化工、電子、航空航天、生物醫藥、農業及國防建設等領域[1]。鑒于鉬對于國民經濟和國防建設發揮著至關重要的作用,許多發達國家已將其作為一種重要的戰略物資進行儲備,我國于2016年將鉬列入戰略性礦產[2]。
輝鉬礦是自然界中的主要含鉬礦物,也是提煉鉬的最主要原料,目前世界鉬產量的99%來源于輝鉬礦,輝鉬礦中的鉬以MoS2的形式存在,我國鉬資源豐富,分布相對集中,但品位不高[3],達到坑采品位的資源儲量不足總量的一半[4],而且相當一部分與銅、鎢、鐵等元素相結合[5],須通過較復雜的磨礦-浮選工藝才能獲得輝鉬精礦[6]。工業上以輝鉬礦為原料的鉬冶煉過程,目前主要采用氧化焙燒-氨浸-酸沉工藝生產鉬酸銨,近年來經鉬從業者及科研人員的不懈努力,涌現出多種輝鉬礦分解新工藝,筆者著重對輝鉬精礦分解提取技術研發成果予以綜述和歸納。
1 輝鉬精礦提取工藝
輝鉬礦冶煉的主要目的就是將鉬和硫分離,一般都采用氧化的方法,主要包括兩類:一類是氧化焙燒-濕法浸出,另一類是全濕法氧化分解工藝。
1.1 氧化焙燒-濕法浸出工藝
氧化焙燒-氨浸工藝是目前生產鉬酸銨的主要工藝[7-8],輝鉬礦在高溫下與氧氣發生反應,生成SO2和MoO3[9-10],從而實現鉬和硫的分離,焙砂可采用氨水浸出生產鉬酸銨產品。氧化焙燒發生的主要反應有:
(1) MoS2的氧化反應
MoS2+O2=MoO2+2SO2↑
2MoO2+O2=2MoO3
MoS2+6MoO3=7MoO2+2SO2↑
(2)伴生金屬硫化物的氧化反應
2MeS+3O2=2MeO+2SO2↑
2MeO+2SO2+O2=2MeSO4
(3)鉬酸鹽生成反應
MeO+MoO3=MeMoO4
MeSO4+MoO3=MeMoO4+SO3↑
MeCO3+MoO3=MeMoO4+CO2↑
鉬酸鈣和鉬酸鉛在氨水中溶解度小,當焙砂中存在這兩種鉬酸鹽時會顯著地降低鉬浸出率。氧化焙燒-氨浸工藝具有工藝成熟、容易掌握、設備要求不高等優點,然而該工藝的缺點同樣明顯:氧化焙燒產生大量低濃度含硫煙氣,處理難度較大,環境污染較重;焙燒溫度高,生成的MoO3易揮發,含銅[11]、鉛、鉍等低熔點金屬元素多的輝鉬礦焙燒時易結塊,內部物料難以氧化充分,導致焙砂中含硫量升高,金屬回收率低,價值較高的稀有金屬Re在焙燒過程中幾乎全部進入煙氣中,回收率低,造成資源極大浪費[12];此外,生產過程產生大量含重金屬和氨氮的工藝廢水,主要依賴末端治理,難以做到穩定達標。
1.2 改進的焙燒工藝
為解決傳統氧化焙燒工藝中含硫煙氣污染和Re回收率低的問題,有學者提出添加劑輔助焙燒工藝,添加劑主要有石灰、碳酸鈉、氯化鈉等。
1.2.1 鈉/鈣化焙燒-浸出工藝
鈉/鈣化焙燒-浸出工藝多用于處理低品位硫化鉬礦,MoS2在焙燒劑Na2CO3/NaNO3/Ca(OH)2存在的條件下,被氧化為 Na2MoO4或 CaMoO4,經過水/酸浸后,鉬富集在液相或固相中,再通過H2SO4和氨水的交互作用除去雜質制備鉬酸銨產品,涉及的主要反應有:
鈉化焙燒:MoS2+3Na2CO3+4.5O2=Na2MoO4+2Na2SO4+3CO2↑
鈣化焙燒:MoS2+3Ca(OH)2+4.5O2=CaMoO4+2CaSO4+3H2O
鄒振球[13]等采用石灰焙燒鉬精礦-稀H2SO4浸出,萃取回收Mo和Re,全流程鉬回收率大于95%,Re回收率大于87%。添加Na2CO3焙燒[14],Na2MoO4和Na2SO4為最終反應產物,較優的焙燒條件為溫度850 ℃,碳酸鹽過量5%。鈉/鈣化焙燒-浸出工藝可用于處理低品位復雜礦,焙燒過程不產生SO2氣體,同時對于伴生的金屬Re有較高的回收率[15]。不足之處在于能耗高,反應需要添加較多的焙燒劑,導致焙燒量和浸出渣量增加。
與Ca(OH)2相比,CaCO3作為固硫劑在工業中應用更為頻繁,并具有貯存方便、穩定性好、經濟性好等優點。Zhou[16]等通過熱力學計算及焙燒試驗對輝鉬礦碳酸鈣氧化焙燒過程進行詳細研究,并提出“CaCO3氧化焙燒-(NH4)2CO3浸出”鉬酸銨生產工藝,流程圖如圖1所示。研究表明,在CaCO3氧化焙燒過程中,MoS2轉化為CaSO4和CaMoO4,(NH4)2CO3浸出時,生成(NH4)2MoO4和CaCO3。反應方程式如下:
氧化焙燒:6CaCO3+2MoS2+9O2=4CaSO4+2CaMoO4+6CO2↑
銨鹽浸出:CaMoO4+(NH4)2CO3=(NH4)2MoO4+CaCO3
CaSO4+(NH4)2CO3=(NH4)2SO4+CaCO3
氧化焙燒可在較低溫度(300~500 ℃)下進行,反應速率主要受傳質和傳熱的影響,提高溫度、延長時間、添加礦化劑有利于提高轉化率,焙燒固硫率隨CaCO3用量的增加而增大,當CaCO3與MoS2摩爾比為3.6時,鉬精礦中的MoS2分解率達到99%,固硫率達95%;控制(NH4)2CO3濃度600 g/L、液固比為10 mL/g,在85 ℃下浸出7h,Mo浸出率達98.2%,CaCO3和SiO2是浸出殘渣中的主要相,可返回配料重復使用,浸出液的主要成分為(NH4)2MoO4和(NH4)2SO4,經凈化和酸沉得到鉬酸銨產品和主要成分為(NH4)2SO4的母液。母液中添加CaCO3(浸出渣), (NH4)2SO4轉化為(NH4)2CO3,可返回浸出循環使用,反應式如下:
CaCO3+(NH4)2SO4=CaSO4+(NH4)2CO3
“CaCO3焙燒-(NH4)2CO3浸出”工藝[17-18]不僅氧化過程快、揮發少,而且還可有效固硫,浸出渣在配料時重復使用,可消除鉬的隨渣損失,母液用于制備浸出劑可實現溶液循環和廢水零排放。相比于現行鉬酸銨生產工藝,該工藝符合新形勢下產業發展方向,在實現鉬酸銨清潔生產的同時,有望取得顯著的經濟效益,具有很好的推廣應用前景。
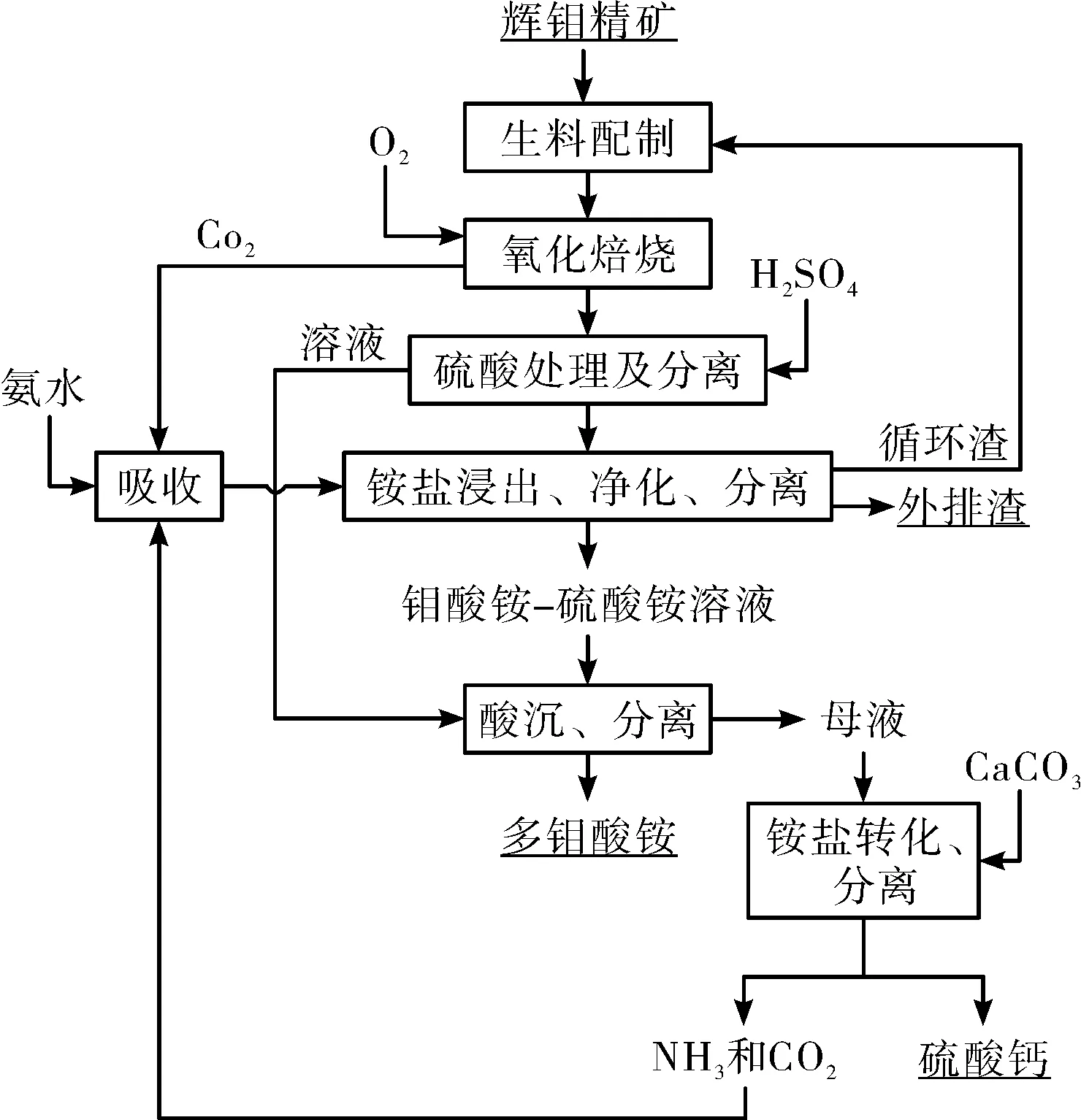
圖1 輝鉬精礦制備鉬酸銨原則工藝流程圖
1.2.2 氯化焙燒工藝
Medvedev[19]等提出在輝鉬精礦中配入NaCl焙燒,高溫下MoS2先與O2反應生成MoO3和SO2,在NaCl存在時,SO2被氧化生成Na2SO4,MoO3則與NaCl反應生成Na2MoO4和MoO2Cl2:
2MoS2+7O2=2MoO3+4SO2↑
2NaCl+SO2+O2=Na2SO4+Cl2↑
2MoO3+2NaCl=Na2MoO4+MoO2Cl2
總反應式為:
2MoS2+11O2+10NaCl=4Na2SO4+4Cl2↑+Na2MoO4+MoO2Cl2
在溫度為450 ℃,焙燒時間90 min和150%過量的NaCl的條件下焙燒,產物采用水、堿兩段浸出,鉬回收率不低于98%。配入NaCl焙燒可減少SO2的釋放,降低焙燒溫度,這可能由于MoO3和SO2不斷被消耗從MoS2-MoO3體系中去除,導致反應平衡向右移動,從而導致MoS2在450 ℃以較高速率被氧化。
1.2.3 還原焙燒
Mehdi Afsahi[20-21]等研究在有CaO的條件下,MoS2粉末與氫的反應。在溫度為973~1 173 K,氫濃度為30%~100%的條件下,應用“收縮未反應核模型”對實驗數據進行分析,表明還原反應相對于氣態反應物是一級反應,反應速率常數和活化能分別為3.91×103cm/min和139.0 kJ/mol。王多剛[22]對3種無SO2污染的輝鉬礦氫還原生產金屬鉬路線進行了熱力學分析:不用固硫劑,輝鉬礦直接氫還原反應是很難進行的;用CaO做固硫劑,輝鉬礦氫還原反應可以進行,隨著溫度的升高氫氣利用率逐漸增加;用Na2CO3做固硫劑,輝鉬礦氫還原反應的產物通過水洗可以得到純金屬鉬粉,氫氣利用率隨著溫度的升高與壓力的下降而增加。該方法可處理較低品位的輝鉬礦,是一種有潛力提取Mo的方法。
1.2.4 直接熱解工藝
Donald[23]發明了直接熱解工藝,高溫下MoS2會發生分解反應,熱解一段時間后往爐內通入氫氣,產物在還原氣氛中冷卻可以得到金屬鉬。
4MoS2=2Mo2S3+S2
2Mo2S3=4Mo+3S2
王磊[24-25]等研究了輝鉬礦的真空熱分解并進行了熱力學計算,同時開展了驗證性試驗,獲得了分解過程的微觀反應動力學方程的關鍵性參數并得到含鉬93.69%的金屬鉬和含硫98.6%的硫磺。周岳珍[26]等提出真空熱分解-酸堿聯合浸出法制備鉬粉及硫磺工藝,并在實驗條件下獲得鉬含量為98.29%的鉬粉。
此外,符劍剛[27]等人考慮到軟錳礦具有強氧化性,在硫酸錳工業生產中,需先將其還原。在輝鉬礦焙燒過程中加入軟錳礦,正好可相互利用兩者的氧化性和還原性。輝鉬礦在450~550 ℃配入MnO2焙燒,MoS2的分解率接近100%,產物以MnMoO4為主,當n(Mn): n(Mo)= 9時,固硫率接近98%。
1.3 全濕法氧化分解工藝
全濕法氧化分解工藝不經過焙燒, 利用氧化劑在溶液中將輝鉬礦中的鉬氧化為+6價,硫氧化成SO42-,再通過離子交換或萃取回收鉬。
1.3.1 常壓氧化浸出
1.3.1.1 HNO3常壓氧化分解
該工藝利用HNO3的酸性和強氧化性,MoS2氧化后,鉬產物以鉬氧化物和鉬離子兩種形式分配在浸出渣和浸出液中,可通過調控液固比、酸度來改變鉬在兩相中的分配量,具體氧化過程可表述為:
MoS2+18HNO3=MoO42-+2SO42-+18NO2↑+6H++6H2O
MoS2+6HNO3=MoO3·nH2O+2H2SO4+6NO↑+(1-n)H2O
Kholmogorov[28]等考察了HNO2和NO2對MoS2的氧化作用,得出HNO3氧化分解輝鉬礦過程中產生的氮氧化物可以促進MoS2的氧化過程的結論,并認為溶解在溶液中鉬離子以MoO22+和[MoO2(SO4)2]2-形式存在。吳保林[29]等研究了HNO3- H2SO4體系中機械活化對輝鉬礦浸出動力學的影響,認為輝鉬礦呈層狀結構,層與層之間由微弱的范德華力維系,受外力作用時,很容易發生層間滑移,因此機械活化對浸出過程影響不大。Medvedev[30]等在90 ℃使用一段濃度為100 g/L,二段濃度為30%的HNO3進行兩段浸出取得較好的效果,氧化后的鉬全部以離子形態溶解在溶液中。由于鉬離子在溶液中容易水解和聚合而形成同多酸或雜多酸,存在形式較為復雜,因此,對于鉬在HNO3浸出液中的存在形式多為推斷和分析,這給從酸性浸出液中回收鉬帶來了困擾。
1.3.1.2 NaClO分解法
NaClO是一種有效的輝鉬精礦浸出劑[31-32],其分解MoS2的反應式如下:
MoS2+9NaClO+6NaOH=Na2MoO4+2Na2SO4+9NaCl+3H2O
同時,過程中還有一系列副反應發生,如下:
2NaClO=2NaCl+O2↑
MeS+4NaClO+2NaOH=Me(OH)2+Na2SO4+4NaCl
3NaClO=NaClO3+2NaCl
副反應的發生會影響浸出反應進行,降低浸出劑的利用率,同時金屬雜質離子可能和MoO42-反應生成鉬酸鹽沉淀,降低鉬的回收率。鄒平[33]等用堆浸的方式對該方法進行了研究,實驗過程中先將礦石破碎磨細,然后在室溫下用NaClO溶液淋洗,浸出過程控制pH值在3~13,淋洗49 d后,鉬回收率達到65%。Liu[34]等報道使用NaClO分解法可以有效分離銅精礦中的MoS2,在較優浸出條件下,MoS2分解率高達99%以上,銅浸出率<0.01%。此外,該工藝也可用于浸出鎳鉬礦[35]。和其他方法相比,該工藝具有反應溫度較低,選擇性較強等優點,但由于NaClO在高溫和酸性條件下穩定性差、處理效率低等原因致使浸出劑用量大,成本較高,應用條件受到很大的限制。
1.3.1.3 常壓堿浸
常壓堿浸可用于分離提取銅精礦或黑色頁巖中的鉬。Liu[36]等對Mo-S-H2O和 Cu-Fe-S-H2O系的熱力學研究表明,銅精礦堿浸提取鉬是可行的,并探討了硫化礦在銅精礦中的氧化機理,并得到最佳浸出條件,在最佳浸出條件下,鉬浸出率為97.5%,銅的浸出率只有1.84%。Zhao[37]等研究了常壓堿浸法從含Mo5.95%的黑色頁巖中浸出鉬的動力學,在溫度>65 ℃時反應受擴散控制,活化能為15 kJ/mol,在溫度<65 ℃時過程受化學反應速率控制,活化能為57 kJ/ mol,鉬的浸出率在30 min時可達90%左右。
1.3.2 加壓氧化浸出
1.3.2.1 HNO3加壓氧化酸浸法
輝鉬精礦加壓酸浸反應如下:
MoS2+9HNO3+3H2O=H2MoO4+2H2SO4+9HNO2
產出的HNO2快速分解為NO2和NO,NO2與水結合形成HNO3,在氧氣存在下,NO氧化為NO2,然后又生成HNO3:
2HNO2=NO2+NO+H2O
2NO+O2=2NO2
3NO2+H2O=NO+2HNO3
HNO3的再生可減少其用量,實際添加量只有理論量的20%。動力學研究表明[38],MoS2在浸出液中溶解,被氧化為H2MoO4,過程受化學反應速率控制,活化能68.8 kJ/mol;王玉芳[39]等在酸性條件下,控制溫度160 ℃、氧分壓350 kPa, MoS2分解率大于99%;王海北[40]等用加壓浸出-溶劑萃取工藝對某輝鉬精礦開展了提鉬半工業試驗,浸出過程中鉬的轉化率達到98%以上,有15%~20%的鉬進入溶液;蔣麗娟[41]以等外品鉬精礦為原料在溫度200 ℃、氧分壓700 kPa的條件下反應2~3 h,鉬精礦的氧化率大于99%。
加壓酸浸工藝因其反應速度快、鉬轉化率高,一直是研究的熱點,但該工藝也存在一些問題,例如鉬分散進入液固兩相、HNO3- H2SO4混合體系對設備的腐蝕較為嚴重、初期反應過于劇烈難以精確控制,以及過程中產出的氮氧化物易造成環境污染等[42]。
1.3.2.2 氧壓堿浸法
在高壓氧堿性介質中,MoS2與O2反應生成Na2MoO4和Na2SO4:
2MoS2+12NaOH+9O2=2Na2MoO4+4Na2SO4+6H2O
浸出時Mo和Re以離子的形式進入浸出液中[43],而一些金屬雜質元素溶解后生成氫氧化物沉淀,較優的浸出條件為溫度130~200 ℃、壓力2.0~2.5 MPa、NaOH用量為理論量的1.0~1.2倍、L/S為4∶1~8∶1[44-45]。在浸出時間進行到總浸出時間的1/3時,MoS2的浸出率已接近80%,由此索波里[8]提出用浸出-浮選工藝改進加壓堿浸工藝,當浸出率達到80%時結束浸出,浸出渣經浮選富集后返回再浸,棄渣鉬品位小于0.85%,鉬回收率大于99%,反應時間明顯縮短。唐忠陽[46]采用氧壓堿浸處理高銅低鉬礦,Mo、Cu的回收率分別為95.6%和99.0%;此法浸出鎳鉬礦[47],鉬浸出率可達98%,用新沉淀的Fe(OH)3和NaHCO3凈化浸出液,離子交換富集鉬,Mo/W分離系數可達100。
和高壓氧酸浸相比,高壓氧堿浸溫度和壓力都較低、鉬全部進入溶液、浸出液雜質含量少、回收率更高、體系腐蝕性更小。然而該工藝也存堿耗大、反應時間長、輝鉬礦中的硫全部轉化為Na2SO4、經濟價值不高等不足。
1.3.2.3 氧壓水浸法
在MoS2-H2O-O2體系中,輝鉬礦發生如下反應:
2MoS2+9O2(g)+6H2O=2H2MoO4+2H2SO4
付云楓[48-49]以輝鉬礦在H2O-O2體系下的氧化分解和離子交換法分離浸出液中的鉬為主線,研究了輝鉬礦在H2O-O2體系中氧化分解的熱力學和動力學,在優化工藝條件下反應2 h,鉬氧化率達到99%以上,在180~220 ℃的條件下,輝鉬礦的氧壓分解過程符合未反應收縮核模型,受化學反應速率控制,工藝流程如圖2所示。
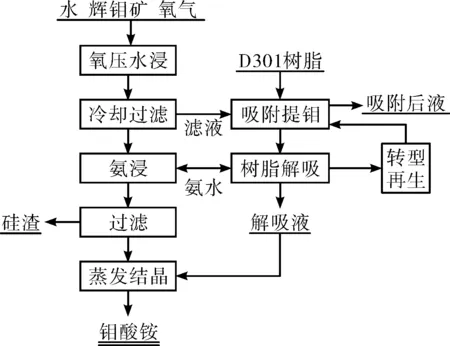
圖2 氧壓水浸處理輝鉬礦生產鉬酸銨工藝原則流程圖
氧壓水浸法分解MoS2解決了氧化劑昂貴、浸出介質大量被消耗和浸出液中鉬難以高效經濟回收等制約濕法處理輝鉬礦工藝應用的難題,有望解決現存全濕法工藝處理輝鉬礦的弊端,從而實現輝鉬礦的全濕法高效經濟清潔生產,為全濕法處理輝鉬礦提供新思路。
1.3.3 電氧化分解法
電氧化法由NaClO法改進而來,即在電解槽中集NaClO的生成和MoS2的氧化為一體,將漿化的輝鉬礦物料加入到裝有NaCl溶液的電解槽中,通入直流電后,陽極產生的氯氣與水反應生成HClO,之后發生的氧化反應和NaClO浸出工藝基本相同。浸出過程受固膜擴散控制,為提高電流效率,可在過程中引入超聲波強化浸出[50],在優化工藝條件下,Mo浸出率達99.6%。電氧化法操作簡單、金屬浸出率較高、反應溫和無污染,目前主要由于成本和能耗較高限制了其推廣和應用。
1.3.4 生物氧化浸出工藝
輝鉬礦生物氧化浸出工藝是利用一些好氧、嗜酸的細菌和硫化礦發生氧化還原反應[51],將輝鉬礦中的鉬和硫分別氧化:
MoS2+6Fe3++4H2O=MoO42-+2S+6Fe2++8H+
菌體能直接吸附在礦石顆粒表面并通過生物酶促進礦物氧化,也能通過氧化Fe2+為Fe3+而為礦物化學氧化提供氧化劑,L.Bryner等首次提出細菌可用于浸出鉬礦,目前已有采用生物氧化浸出含鉬24.41%的鉬礦,40 d鉬浸出率超過93%的報道[52]。生物氧化浸出具有能耗低、選擇性強、浸出過程安全、污染小等優點,但由于鉬礦的酸難溶性,菌種對鉬離子耐受性差,浸出體系氧化還原電位值低和金屬離子容易發生沉淀導致鉬浸出率不高等原因限制了其推廣應用,今后可在菌種基因改良、多級生物反應器浸出和溶液電位調控技術上深入研究,以提高浸出效率。
2 結論與建議
(1)輝鉬精礦氧化焙燒-氨浸工藝仍是目前處理輝鉬礦的主要工藝,該工藝成熟、設備要求不高、容易掌握,缺點在于焙燒能耗高,生成MoO3易揮發,Re回收率低,不適合處理鈣、鉛、銅等元素含量高的礦等,此外該工藝產生大量難以治理的含氨氮和重金屬的生產廢水以及低濃度SO2煙氣,環境污染較重,主要依賴末端治理,難以實現穩定達標,在大力推進生態文明建設和全面促進資源節約的大背景下,亟需尋找資源高效利用的清潔生產工藝。
(2)在鉬精礦中配入石灰焙燒可解決SO2污染問題,同時導致焙燒量和能耗增加,同時浸出的渣量也大大增加,需對焙燒和浸出過程繼續優化。
(3)碳酸鈣焙燒-銨鹽浸出工藝可實現溶液循環和浸出渣循環,配入CaCO3強化氧化焙燒與固硫相結合,反應劑再生與溶液循環相結合,通過物料循環大幅降低輔材消耗,無工藝廢水排放,物料循環與環境友好有機統一,有望成為新一代鉬冶煉清潔生產工藝。
(4)高壓氧酸浸工藝反應速度快,鉬轉化率高,但該工藝也存在鉬分散進入液固兩相、混酸體系腐蝕嚴重以及產生氮氧化物污染等問題;高壓氧堿浸反應條件較溫和、浸出液雜質含量少,回收率更高,后續仍需在降低減耗、縮短反應時間以及解決Na2SO4的應用等方面進行深入研究。
(5)氧壓水浸法分解輝鉬礦解決了氧化劑昂貴、浸出介質大量消耗和浸出液中鉬難以高效經濟回收等制約濕法處理輝鉬礦工藝應用的難題,有望解決現存全濕法工藝處理輝鉬礦的弊端,為全濕法處理輝鉬礦提供新思路。
(6)電氧化分解法操作簡單、浸出率較高、反應溫和無污染,但是能耗較高,限制了其推廣和應用;生物氧化浸出工藝能耗低、選擇性強、浸出過程安全、污染小,但菌種對鉬離子耐受性差,后續可在菌種基因改良、多級生物反應器浸出和溶液電位調控技術上深入研究,以提高浸出效率。

