DCE-MRI定量參數對前列腺癌早期診斷的臨床應用價值分析
趙 云,陳 龍,郭學建,陳廣富
(江蘇省南京市高淳人民醫院放射科 江蘇 南京 211300)
前列腺癌是癌癥相關死亡的第二大主要原因,也是最常見的男性惡性疾病[1]。DCE-MRI是一種相對新穎的成像模式,可以測量腫瘤血管生成導致的組織微血管系統的特性,并改進腫瘤檢測和反應評估[2]。最常用的反映血管通透性的DCE-MRI參數是定量參數容量轉移常數(Ktrans)[3],Ktrans表示造影劑從血液轉移到間質的速率,其表示腫瘤微循環和表面浸潤區域;速率常數(Kep)反映了造影劑從血管外細胞外間隙轉移回血液的速率;血管外細胞外間隙容積比(Ve=Ktrans/Kep)主要反映血管外細胞間隙中造影劑的百分比[3];半定量參數初始曲線下面積(iAUC)與腫瘤血液流入、灌注和間質空間相關,并代表一般腫瘤血流量、總灌注和腫瘤間質空間指數[3]。本研究是將來自DCE-MRI的腫瘤灌注參數與臨床預后因素相關聯,并進一步探討是否可以用DCE-MRI參數將早期的腫瘤與相對晚期的腫瘤分開,以便在前列腺癌早期做出判斷。
1 資料與方法
1.1 一般資料
本研究經醫院倫理委員會批準,所有患者均簽署知情同意書。選取2015年1月—2019年1月在我院接受MRI檢查的前列腺癌患者。納入標準:①MRI檢查前未經穿刺活檢;②未經藥物治療;③DCE-MRI檢查的圖像質量符合要求,并發現可疑病灶;④經前列腺穿刺活檢證實為前列腺癌;⑤進行Gleason評分及免疫組化檢查;⑥臨床資料完善。排除標準:DCE-MRI檢查的圖像質量差不符合要求。在71例經活檢證實的前列腺癌患者中,7例未發現可疑病變,2例由于對造影劑過敏而沒有DCE-MRI圖像。在剩余的62名患者的前列腺中檢測到69個病灶,患者年齡60~79歲,平均年齡(705)歲。根據前列腺癌的TNM分類,10例患者腫瘤臨床分期T1c,52例T2(T2a 16例,T2b 8例,T2c 28例)。血清PSA值3.4~19.1ng/mL,平均(9.53.7)ng/mL。Gleason評分3+3的患者19例,Gleason評分3+4的患者41例,Gleason評分4+3的腫瘤患者2例。所有測量參數,包括患者的年齡、血清PSA、DWI和DCE-MRI參數在Gleason評分3+3和3+4腫瘤組之間均不相同(P<0.05)。52個腫瘤位于外周區,17個腫瘤位于過渡區。外周區和過渡區腫瘤組患者的年齡、血清PSA、腫瘤ADC、Ktrans和iAUC值無顯著差異(P>0.05)。I外周區腫瘤(n=52)的大小小于過渡區腫瘤(n=17)(0.680.41cm2比0.930.59cm2;P<0.05);II外周區腫瘤(n=52)的Kep值大于過渡區腫瘤(n=17)(0.590.21min-1比 0.490.24 min-1;P<0.05);III外周區腫瘤(n=52)的Ve值小于過渡區腫瘤(n=17)(0.270.08 比 0.320.07;P<0.05)。
1.2 方法
1.2.1 MRI掃描方法:使用Siemens Skyra 3.0T MR成像儀獲得多參數MR成像,采用體部相控陣線圈和脊柱相控陣線圈組合定位在骨盆周圍以覆蓋前列腺。采集從前列腺頂部下方到精囊上方的軸位、冠狀位、矢狀位的T2WI快速自旋回波(TSE)圖像,采用三個b值50、400和800s/mm2在軸位平面上使用單次回波平面序列采集DWI,并且使用相同的位置來獲取軸位T2WI圖像。DCE-MRI使用軸位T1WI 3D容積內插體部檢查序列(VIBE)進行,該序列覆蓋整個前列腺。為了確定造影劑到達之前組織中的T1弛豫時間,DCE-MRI包括兩個具有不同翻轉角FA 2和FA 13的預對比3D VIBE成像序列。在釓噴酸葡胺(Gd-DTPA 0.2mL/kg)注射后,這些序列在軸位上跟隨DCE系列,時間分辨率為8秒,采集時間為4分40秒。使用高壓注射器經肘輸注造影劑,然后以2.5ml/s的流速注射20ml生理鹽水。
1.2.2 MRI圖像分析 在西門子后處理工作站分析所有MRI圖像,使用Tissue 4D軟件根據藥代動力學模型擬合體素MRI信號增強時間曲線。首先進行運動校正,其將所有時間序列的體積記錄 到用戶選擇的參考體積,以減少在DCE圖像采集期間患者和生理運動的影響。在形態學圖像和預對比圖像的配準之后,在前列腺癌病灶上繪制橢圓形或不規則形狀的感興趣區域(ROI)。在DCE-MRI的早期增強區域中繪制ROI,并且使用DWI b800、ADC圖和TWI圖像作為參考。預先對比的T1圖計算是藥代動力學建模的先決條件。T1擬合限于具有高于噪聲水平值>20的像素,并且系統根據輸入的造影劑自動計算各個值。對于Tofts建模[3]、Tissue 4D提供動脈輸入功能(AIF),使用具有三種不同模式即快速、中速和慢速的雙指數函數建模。根據快速采樣方法選擇AIF來計算動力學參數[4],計算參數圖并通過軟件自動估計所選ROI的Ktrans、Kep、Ve和iAUC值。在參數ADC圖上直接測量每個腫瘤病變的ADC值,使用相應的高b值DWI圖像、T2WI圖像和預對比T1WI圖像同時檢查ADC圖。選擇包含最大腫瘤范圍的ADC圖用于分析,并且在除腫瘤邊緣之外的腫瘤中心繪制ROI,在工作站上生成平均ADC值和所選腫瘤區域的大小并記錄用于分析。在每個MRI圖像上定義前列腺癌如下:相對于T2WI圖像上的相鄰實質的低信號區域;相對于ADC圖上相鄰實質的ADC值較低的區域;在DCE-MRI上相對于相鄰實質早期輸注造影劑的區域。
1.3 統計學分析
用SPSS21.0版本進行統計學分析,使用雙側非參數Mann-Whitney U檢驗來比較患者年齡、PSA、腫瘤大小、ADC、Ktrans、Kep、Ve值或外周區和過渡區腫瘤組之間的iAUC值、Gleason評分3+3和3+4組以及不同臨床分期。Spearman相關系數用于評估腫瘤大小、ADC、Ktrans、Kep、Ve、iAUC、Gleason評分和血清PSA之間的相關性,P值小于0.05被認為具有顯著統計學意義。
2 結果
2.1 DCE-MRI參數
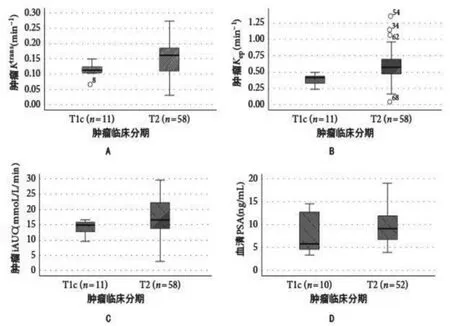
在Ktrans(0.110.02min-1比0.160.06min-1;P<0.05);Kep(0.380.08min-1比 0.600.23min-1;P<0.01);iAUC(14.332.66mmoL/L/min比17.405.97mmoL/L/min;P<0.05)方面,T1c期腫瘤(n=11)均低于T2期腫瘤(n=58),見圖1(A~C)。
2.2 血清PSA值
T1c期患者(n=10)和T2期患者(n=52)之間血清PSA水平無顯著差異,(8.24.5ng/mL比9.83.6ng/mL;P=0.151),見圖1(D)。
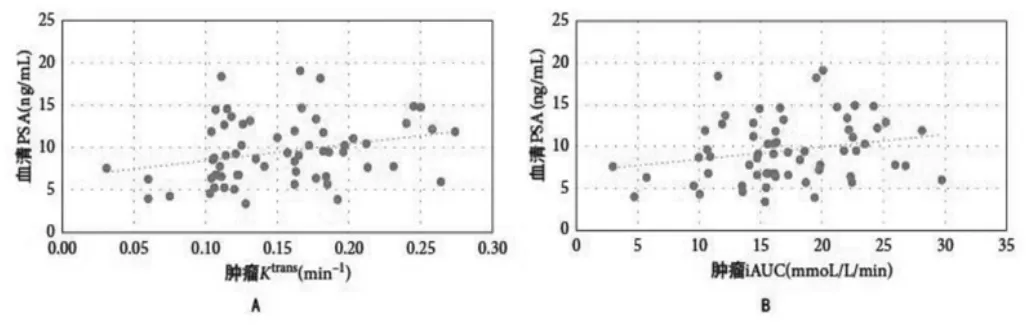
2.3 血清PSA與MRI參數的相關性
血清PSA與腫瘤Ktrans(r=0.317,P=0.012)(圖2A)以及腫瘤iAUC(r=0.258,P=0.043)相關(圖2B),血清PSA和腫瘤ADC值之間未發現相關性。
3 討論
本研究顯示了早期前列腺癌患者中腫瘤Ktrans與血清PSA之間的相關性,此外本研究還檢測到腫瘤iAUC和血清PSA之間的相關性,這可以解釋為腫瘤微血管和淋巴系統的血管通透性改變[5]。DCE-MRI可用于無創評估組織微循環的功能,DCE-MRI基于造影劑通過毛細血管床,在快速進入血管外細胞間隙之前,會暫時限制在血管空間內,其速率由微血管的滲透性、表面面積和血流決定[6,7]。在DCE-MRI中重復測量造影劑的分布,從而可以對體內腫瘤微循環進行評估,進而定量區分腫瘤的惡性或良性[8]。新血管生成在前列腺癌的生長、進展和轉移過程中起著至關重要的作用[9,10],前列腺癌中的微血管密度也被證明是病理分期的獨立預測因子[11]。本研究發現活檢證實的前列腺癌中,較小腫瘤(T1c)的腫瘤Ktrans、Kep和iAUC均低于較大的局部腫瘤(T2)。由于在前列腺疾病和損傷的情況下前列腺結構的破壞,血清PSA升高,在較低的臨床階段和Gleason評分PSA篩查有助于早期診斷前列腺癌[12]。本研究沒有發現臨床分期T1c中的腫瘤與具有相對程度疾病的腫瘤之間的血清PSA水平的顯著差異,例如臨床分期T2。血清PSA不是前列腺癌的特異性標志物,因為良性組織對PSA的影響不同以及分級與PSA之間的非線性關系,導致不同臨床分期之間PSA水平重疊,如先前的研究所示[13],所以血清PSA水平不能單獨用于準確預測任何個體患者的疾病程度。DCE-MRI應該聯合PSA一起用于定位可疑病變以進行活檢,提高特異性并識別那些如果不進行治療則更容易導致死亡的腫瘤。Gleason評分反映了腫瘤的侵襲性,是前列腺癌患者預后的重要預測指標[14]。Gleason評分與DCE-MRI參數之間的相關性可能已經得到了預期,因為Gleason評分已被證明與微血管密度測量相關[11]。然而本研究沒有發現Gleason評分為3+3和3+4的患者之間DCE衍生參數的任何顯著差異,缺乏差異可能是由于腫瘤組織的異質性和活檢抽樣誤差所致[15]。
綜上所述,本研究證實DCE-MRI可以反映前列腺癌的微循環,DCE-MRI定量參數結合臨床預后因素可為早期前列腺癌特別是陰性活檢患者提供有效的預處理診斷方式。

