Sox9和amh基因在雌、雄虹鱒和偽雄魚各組織中的表達模式分析
谷偉,黃天晴,徐革鋒,王炳謙
(中國水產科學研究院黑龍江水產研究所,黑龍江 哈爾濱 150070)
虹鱒Oncorhynchus mykiss的性別決定機制為XX/XY[1],雌性虹鱒染色體為XX型,雄性為XY型。通過體外激素誘導全雌性虹鱒,可產生性反轉功能性雄魚,即染色體核型為XX,但可產生功能性精液的“偽雄魚”。偽雄魚與全雌性虹鱒雜交,通過靜水壓方法處理受精卵,阻止其第二極體排放,即可獲得全雌三倍體虹鱒[2]。因此,偽雄魚是大批量生產全雌三倍體虹鱒必不可少的條件。研究偽雄魚性別特異基因表達模式,與普通雌性和雄性虹鱒的表達模式進行比較,對于全雌三倍體虹鱒制種技術具有重要的理論意義。
Sox9(SRY-related HMG box 9)基因是一種重要的轉錄因子,對哺乳動物精子發生以及維持精巢發育具有重要的作用[3]。硬骨魚的sox9基因在性腺發育過程中顯著表達,對生殖細胞與支持細胞的分化有重要的影響[4]。研究表明,sox9基因在雌雄虹鱒性腺中表達顯著不同[5]。Amh(anti-Mullerian hormone)為抗繆勒氏管激素,是魚類性腺向雄性分化的重要影響因子[6]。Amh在比目魚和虹鱒精巢組織中的表達顯著高于卵巢組織[7,8]。在受精后30d的斑馬魚Barchydanio rerio var中,amh為驅使其性腺雄性化發育的關鍵基因[9]。在天然性逆轉雄性以及正常雄性的半滑舌鰨Cynoglossus semilaevis Gunther性腺中,amh基因的表達均顯著高于正常雌性[10]。因此,sox9與amh為典型的硬骨魚類雄性特異基因。
本研究以正常雌、雄性以及激素處理的偽雄虹鱒為實驗對象,通過驗證三者不同組織中雄性特異基因sox9和amh的表達情況,為挖掘sox9與amh基因的潛在功能和了解偽雄虹鱒的性腺發育提供依據,為虹鱒全雌三倍體制種技術研究奠定重要理論基礎。
1 材料與方法
1.1 材料
實驗用雄性(XY)、雌性(XX)和偽雄(XX)虹鱒均為3齡魚,采集于中國水產科學研究院黑龍江水產研究所渤海冷水性魚類試驗站。通過人工誘導雌核發育技術建立全雌虹鱒基礎群體,在此基礎上采用17-α甲基睪丸酮誘導批量制備性反轉功能性雄魚,即為“偽雄魚”。3齡雄性、雌性和偽雄虹鱒各選取5尾,麻醉后分別取性腺、背肌、腹肌、肝臟、后腸、中腸、前腸、腦、腦垂體、脾、腎臟、心臟以及幽門盲囊組織,將新鮮組織加入RNA保護液,于-80℃冰箱保存備用。
總RNA提取試劑盒和反轉錄試劑盒均購自博日公司,RNA later購于Takara公司,用于保存組織樣本,防止RNA降解。熒光定量試劑盒購于Roche公司。
1.2 總RNA提取
按照BioFlux Simply P總RNA提取試劑盒方法,先將雄、雌和偽雄虹鱒各組織在液氮中研磨。取不大于30mg組織粉末放入1.5mL離心管中,加入600 μL裂解液,室溫靜置 3~5min,取上清吸入純化柱,12 000r/min離心30s,之后加入洗滌液,洗滌兩遍,空離之后用50μL DEPC處理水洗脫,獲得總RNA。提取的各組織總RNA經檢測,OD260/OD280比值均處于 1.8~2.1 之間,濃度均大于 1 μg/μL。
1.3 cDNA合成
cDNA合成按照BioRT高靈敏cDNA第一鏈合成試劑盒操作,反應體系為 10 μL:Hybrid mix 5μL,Enzyme mix0.5μL,RNA2μg,補充 Nuclease-free水至 10 μL;反應程序為:37℃ 20min,98℃ 5min。反應結束后將cDNA放入-20℃保存,備用。實驗全程戴一次性手套和口罩,防止污染,使用RNase-free移液槍頭和離心管。
1.4 Real-time PCR
利用Real-time PCR檢測雄、雌和偽雄虹鱒各組織中sox9和amh基因的表達。反應體系為10μL:SYBR Mix5μL,上、下游引物各 0.2μL,cDNA0.5μL,dH2O 4.1μL。反應程序為:95℃30s,95℃5s,60℃34s,40 個循環;95℃15s,60℃1min,95℃15s。用于熒光定量PCR檢測虹鱒sox9和amh基因的引物信息見表1。
1.5 數據統計分析
實時定量PCR結果利用2-△△CT方法分析sox9和amh基因的相對表達量,基因相對表達量用(Mean±SD)表示,兩組數據間的差異比較利用One-way ANOVA方法,利用軟件SPSS 12.0來分析不同組之間的顯著性差異,P<0.05為顯著性差異,P<0.01為極顯著性差異。
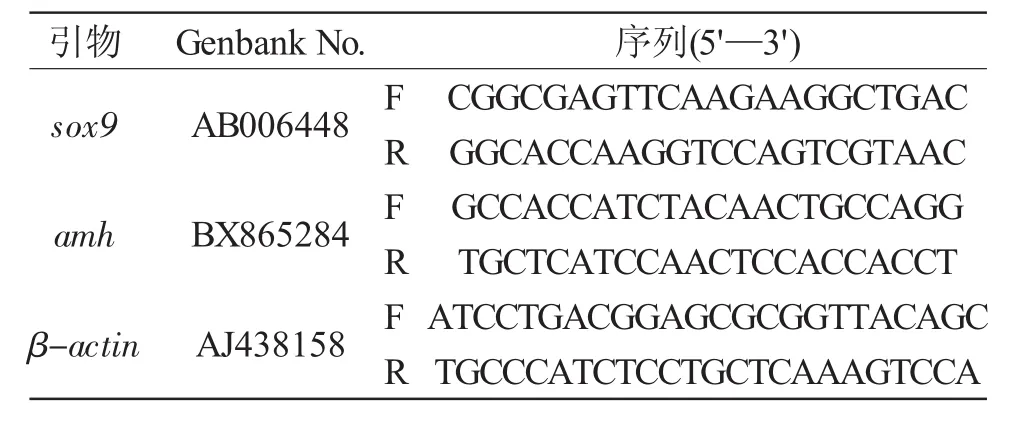
表1 實時定量PCR引物信息Tab.1 The primer sequences for Real-time PCR
2 結果與分析
由圖1可知,sox9基因在偽雄、雄性以及雌性虹鱒的13種組織中均有表達,但在性腺中表達量最高,腦組織次之,在脾、肝以及腦垂體中表達量也分別達到了顯著水平(P<0.05)。Sox9基因在偽雄、雄性以及雌性虹鱒性腺組織中的表達量分別為背肌組織的 20.8、24.2以及 17.7倍(P<0.01)。Sox9基因在這三種魚性腺中的表達量為:雄魚>偽雄魚>雌魚(P<0.01)。而在腦組織中,該基因的表達量為:雌魚>雄魚>偽雄魚(P<0.05)。在肝和脾組織中,sox9在偽雄魚中的表達量顯著高于普通雌、雄魚(P<0.05)。Sox9基因在腦垂體中的表達量顯著高于其他組織(P<0.05),而在這三種魚之間沒有顯著差異。
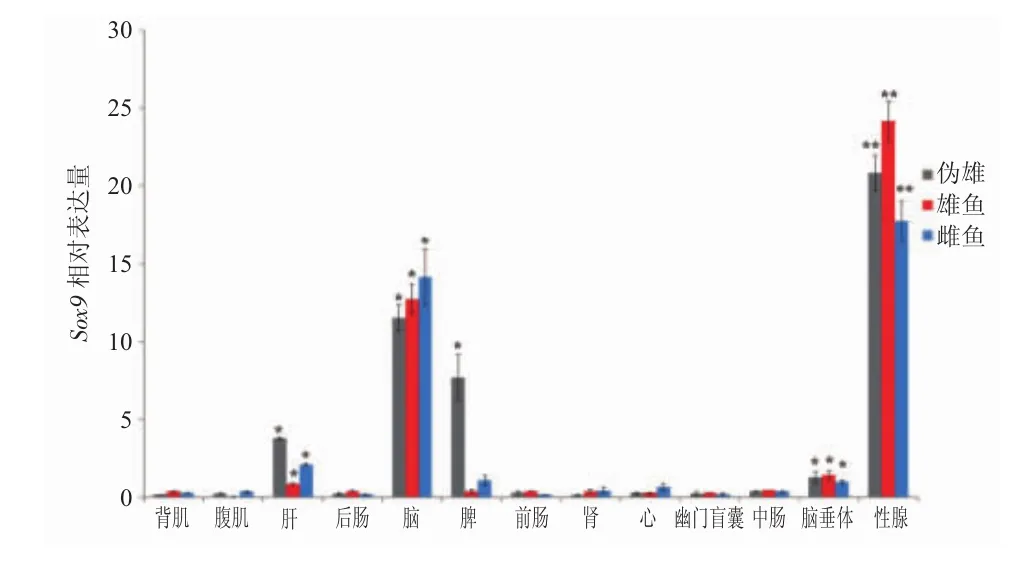
圖1 Sox9基因在偽雄、雄性和雌性虹鱒不同組織中的表達模式Fig.1 Expression profiles of sox9 gene in different tissues of pseudo-male,male and female rainbow trout
Amh基因的表達模式見圖2。該基因在偽雄、雄性以及雌性虹鱒性腺以及腦組織中的表達顯著高于其他組織(P<0.01或 P<0.05)。Amh基因在三種魚性腺中的表達分別為背肌的12.7、11.0以及5.4倍(P<0.01)。Amh基因在偽雄魚性腺中的表達顯著高于雄、雌魚的性腺(P<0.01)。Amh基因在偽雄魚腦組織中的表達顯著高于雄魚和雌魚(P<0.05)。該基因在本研究的其他11種組織中的表達差異不顯著。
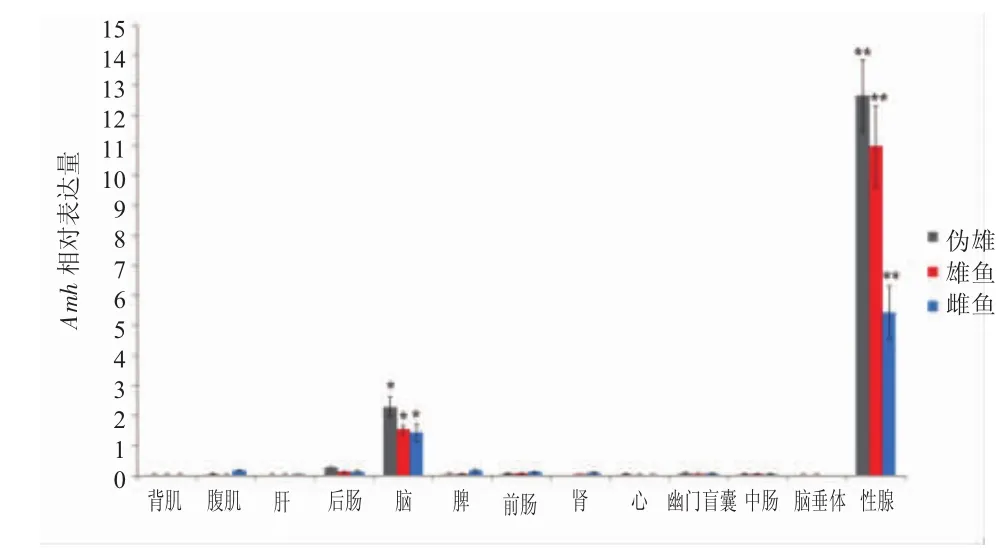
圖2 Amh基因在偽雄、雄性和雌性虹鱒不同組織中的表達模式Fig.2 Expression profiles of amh gene in different tissues of pseudo-male,male and female rainbow trout
3 討論
本研究利用實時定量PCR方法,檢測了偽雄魚和正常雌、雄虹鱒背肌、腹肌、肝臟、前腸、中腸、后腸、腦、脾臟、腎臟、心、腦垂體以及性腺中sox9和amh基因的表達模式,驗證了激素誘導對關鍵性別特異基因表達的影響。利用雄激素處理得到的能產生正常精液的偽雄魚,在生產全雌虹鱒過程中起到重要作用,因此,開展偽雄虹鱒性別特異基因的表達研究具有重要的理論意義。
Sox9基因在雌、雄和偽雄虹鱒的13種組織中的表達表明,該基因在性腺和腦中的表達顯著高于其它組織,這與黃顙魚和鱘魚中的結果一致[11,12],表明sox9基因在許多組織中廣泛表達。研究表明:sox9基因負調控芳香化酶基因的表達[13],而芳香化酶為雌激素合成過程中的限速酶[14],因此,sox9基因的表達抑制了雌性激素的合成。本實驗中,偽雄虹鱒性腺中sox9的表達顯著高于雌性卵巢中,表明甲基睪丸酮處理的虹鱒,促進了性腺中sox9基因的表達,抑制了芳香化酶的表達,導致其性腺向雄性發育。雖然,虹鱒為XY型的性別決定[1],但其性腺的發育可受到激素的影響[15]。本研究以雄激素處理的虹鱒偽雄魚為研究對象,驗證了sox9基因高水平表達可能為其性腺雄性化的關鍵原因之一。然而,偽雄性腺中sox9基因的表達仍然顯著低于雄性精巢,推測基因型對性別決定的作用大于外源激素的誘導。本實驗還表明,sox9基因在雌性腦組織中的表達顯著高于雄魚和偽雄魚,表明性腺細胞中分泌的雌激素會抑制腦組織中激素的分泌,從而導致sox9基因的表達升高。值得注意的是,sox9基因在肝臟和脾臟中呈顯著的高表達,偽雄魚這兩種組織中的表達顯著高于其他兩種性別,而肝臟和脾臟均為魚類重要的免疫器官[16,17],因此sox9基因是否具有免疫作用值得深入研究,同時,探索偽雄魚的非特異性免疫與特異性免疫能力也具有重要的作用。
Amh基因在雌、雄性與偽雄虹鱒的性腺和腦中呈現顯著的高表達,而在其他組織中的表達卻微乎其微,這與在羅非魚和半滑舌鰨中得到的結果相似[18,19]。Amh基因可抑制繆勒氏管的分化[20],硬骨魚類一般不存在繆勒氏管結構,但其對硬骨魚類精巢的發育起到重要的作用。本實驗結果顯示,amh基因在偽雄魚性腺中的表達顯著高于雌性,甚至顯著高于雄性,暗示amh在虹鱒性反轉的過程中扮演重要的角色,促進其向雄性發育。偽雄虹鱒受到雄性激素的處理,amh在腦組織中的表達也顯著高于雌性與雄性虹鱒。可以推測,雄激素的處理誘導了腦中amh基因表達的上調,抑制了其雌性激素的分泌,最終導致個體雄性化逆轉。
總之,偽雄虹鱒各組織中雄性特異基因sox9和amh的表達模式可為深入了解偽雄魚的性腺發育模式奠定理論基礎,對于實現全雌性虹鱒規模化制種技術提供了參考。

