成紅細胞樣Ter細胞在膠原誘導性關節炎發病中的作用
王 平,宋 婧,方翔宇,李 鑫,劉 栩,賈 園,栗占國,2,胡凡磊,2△
(1. 北京大學人民醫院風濕免疫科,風濕病機制及免疫診斷北京市重點實驗室, 北京 100044; 2. 北京大學藥學院天然藥物及仿生藥物國家重點實驗室, 北京 100191)
類風濕關節炎(rheumatoid arthritis,RA)是一種慢性炎癥性自身免疫性疾病,主要累及關節部位,是臨床常見的主要致殘性疾病之一[1]。RA的發病機制復雜,遺傳、環境、微生物等多種因素均參與RA的發生,多種免疫細胞參與并介導了RA的發生和發展[2]:CD4+T細胞亞群的失衡參與RA炎癥的發生和持續過程[3];B細胞過度分化為漿細胞產生大量自身抗體,參與炎癥的發生[4];調節性B細胞功能失調參與RA發病[5];骨髓來源的抑制性細胞(myeloid-derived suppressor cells,MDSCs)促進炎癥反應及骨破壞,加重RA病情[6]。
2018年Han等[7]在荷瘤小鼠中發現了一個新細胞亞群——成紅細胞樣Ter-119+細胞(Ter細胞), 研究表明該群細胞來源于巨核-紅系,主要存在于脾臟中,在肝癌狀態下數量明顯增加,并且可通過分泌artemin促進肝癌的進展。但關于Ter細胞在自身免疫病尤其是RA中的作用尚未見報道。
鑒于Ter細胞主要存在于脾臟中,RA患者的臨床樣本難以獲得,因此,本研究選擇在膠原誘導性關節炎(collagen-induced arthritis,CIA)小鼠模型[8]中進行研究,旨在通過研究Ter細胞在不同發病階段CIA小鼠中的數量變化及其與關節評分和T、B細胞亞群比例的相關性,探索Ter細胞在CIA發生和發展中的作用,從而進一步深入理解RA的發病機制。
1 資料與方法
1.1 實驗動物
無特定病原體(specific pathogen free,SPF)級6~8 周DBA/1雄性小鼠和Balb/c雄性小鼠購于北京華阜康生物科技股份有限公司,SPF級6~8周C57BL/6雄性小鼠購于北京維通利華實驗動物技術有限公司,均寄養于北京大學人民醫院動物實驗室SPF級環境,適應性飼養1周后進行實驗。
1.2 主要試劑和儀器
流式細胞儀FACSAriaⅡ由美國BD公司制造,流式細胞儀CytoFLEX LX由美國Beckman Coulter公司制造;熒光標記的抗鼠CD45(FITC標記)、抗鼠Ter-119(APC標記)、抗鼠CD4(APC-Cy7標記)、抗鼠干擾素γ(interferon,IFN-γ,PerCP-Cy5.5標記)、抗鼠CD19(PerCP-Cy5.5標記)、抗鼠GL-7(Pacific Blue標記)、抗鼠CD138(APC標記)抗體均購自美國Biolegend公司;熒光標記的抗鼠白細胞介素(interleukin-17,IL-17,PE標記)、抗鼠FoxP3(PE標記)、抗鼠CD5(APC標記)、抗鼠CD1d(PE標記)、抗鼠CD95(Alexa Fluor 488標記)購自美國eBioscience公司;牛Ⅱ型膠原(bovine type Ⅱ Collagen,CⅡ)、完全弗氏佐劑(complete Freund’s adjuvant,CFA)、不完全弗氏佐劑(incomplete Freund’s adjuvant,IFA)購自美國Chondrex公司;FACS Permeabilizing Solution購自美國BD公司;FoxP3/Transcriptn Factor Staining Buffer Set購自Thermo Fisher Scienti-fic 公司;FCM Lysing solution、4%(質量分數)多聚甲醛(paraformaldehyde,PFA)、佛波酯(phorbol-12-myristate-13-acetate,PMA)、離子霉素(ionomycin)和布雷非德菌素A(brefeldin A,BFA)均購自杭州聯科生物技術股份有限公司。
1.3 CIA造模、分組及評分
1.3.1造模 CⅡ用100 mmol/L冰醋酸溶解4 ℃過夜,與CFA按照1 ∶1的體積比混合,充分乳化。在小鼠尾根部分兩點進行皮下注射,各注射含100 μg CⅡ的乳化液;初次免疫后第21天,CⅡ和IFA按照1 ∶1的體積比充分乳化,在小鼠尾根部皮下注射含100 μg CⅡ的乳化液,完成CIA模型的誘導。
1.3.2分組 本次實驗共構建40只CIA模型小鼠,在二次免疫后5 d發病率約為50%,挑選評分相近的小鼠,隨機分入發病早期、高峰期和晚期3組,共挑選出18只小鼠,每組6只。發病高峰期小鼠根據最終關節評分以8分為界再細分為高評分組和低評分組。
1.3.3評分 分別對小鼠的四只爪子進行評分,每只爪子的評分標準如下: 0分,無關節紅腫;1分,1~2個腳趾/手指腫脹或掌心腫脹或腕/踝部腫脹;2分,超過2個腳趾/手指腫脹或達到任意2個1分的條件;3分,達到3個1分的條件或超過2個腳趾/手指腫脹且有掌心或腕/踝部腫脹;4分,超過2個腳趾/手指腫脹且有掌心和腕/踝部腫脹。每只爪子最高為4分,整體評分最高16分。
1.4 流式細胞術檢測小鼠脾臟Ter細胞、生發中心(germinal centers,GC)-B細胞和B10細胞
小鼠異氟烷吸入麻醉后以頸椎脫臼的方式安樂死,取脾臟,研磨、裂紅、洗滌,制備單細胞懸液。檢測Ter細胞加入抗鼠CD45-FITC和Ter-119-APC流式抗體,檢測GC-B、B10細胞加入抗鼠CD19-PerCP-Cy5.5、CD5-APC、CD1d-PE、CD95-Alexa Fluor 488、GL-7-Pacific Blue流式抗體,檢測漿細胞加入抗鼠CD19-PerCP-Cy5.5、CD138-APC流式抗體。振蕩混勻后室溫避光孵育30 min,洗滌后重懸,上機檢測。
1.5 流式細胞術檢測小鼠脾臟Th1、Th17和Treg細胞
1.5.1檢測Th1、Th17細胞 制備小鼠脾臟單細胞懸液,離心后完全1640培養基重懸細胞,加入PMA、離子霉素和BFA,混勻,37 ℃細胞培養箱孵育5 h。5 h后加入抗鼠CD4-APC-Cy7抗體,振蕩混勻后室溫避光孵育30 min,固定、破胞膜,加入抗鼠IL-17-PE和IFN-γ-PerCP-Cy5.5抗體,振蕩混勻后室溫避光孵育30 min,洗滌后重懸,上機檢測。
1.5.2檢測Treg細胞 制備小鼠脾臟單細胞懸液,加入抗鼠CD4-APC-Cy7抗體,振蕩混勻后室溫避光孵育30 min,FoxP3 Staining Buffer set破核膜,然后加入抗鼠FoxP3-PE抗體,振蕩混勻后室溫避光孵育30 min,洗滌后重懸,上機檢測。
1.6 統計學分析
所有實驗數據均采用Prism 7軟件進行處理、分析。各個階段CIA小鼠之間及其與na?ve小鼠Ter細胞比例差異采用One-way ANOVA分析,然后采用Tukey’s多重比較檢驗進行兩兩比較;高峰期兩組CIA小鼠Ter、Th1、Th17、GC-B細胞比例差異采用Welch’st檢驗分析;Ter細胞比例與各T、B細胞亞群比例的相關性采用Pearson分析(雙側檢驗),P<0.05為差異有統計學意義。
2 結果
2.1 Ter細胞在不同品系小鼠脾臟中的分布
流式細胞儀檢測Ter細胞的圈門策略如圖1所示,DBA/1、Balb/c、C57BL/6三種品系na?ve小鼠脾臟中均存在Ter細胞,但在DBA/1小鼠脾臟中比例最高。
2.2 Ter細胞在發病高峰期CIA小鼠中明顯擴增
鑒于DBA/1小鼠是公認的構建CIA模型的小鼠品系,并且上述實驗結果顯示DBA/1小鼠脾臟中Ter細胞的比例最高,因此我們選擇DBA/1小鼠進行了CIA模型的構建。流式細胞儀檢測6只na?ve和6只發病高峰期CIA小鼠脾臟Ter細胞,結果顯示發病高峰期CIA小鼠脾臟Ter細胞比例較na?ve小鼠明顯升高(8.522%±2.645%vs. 1.937%±0.725%,P<0.01,圖2)。
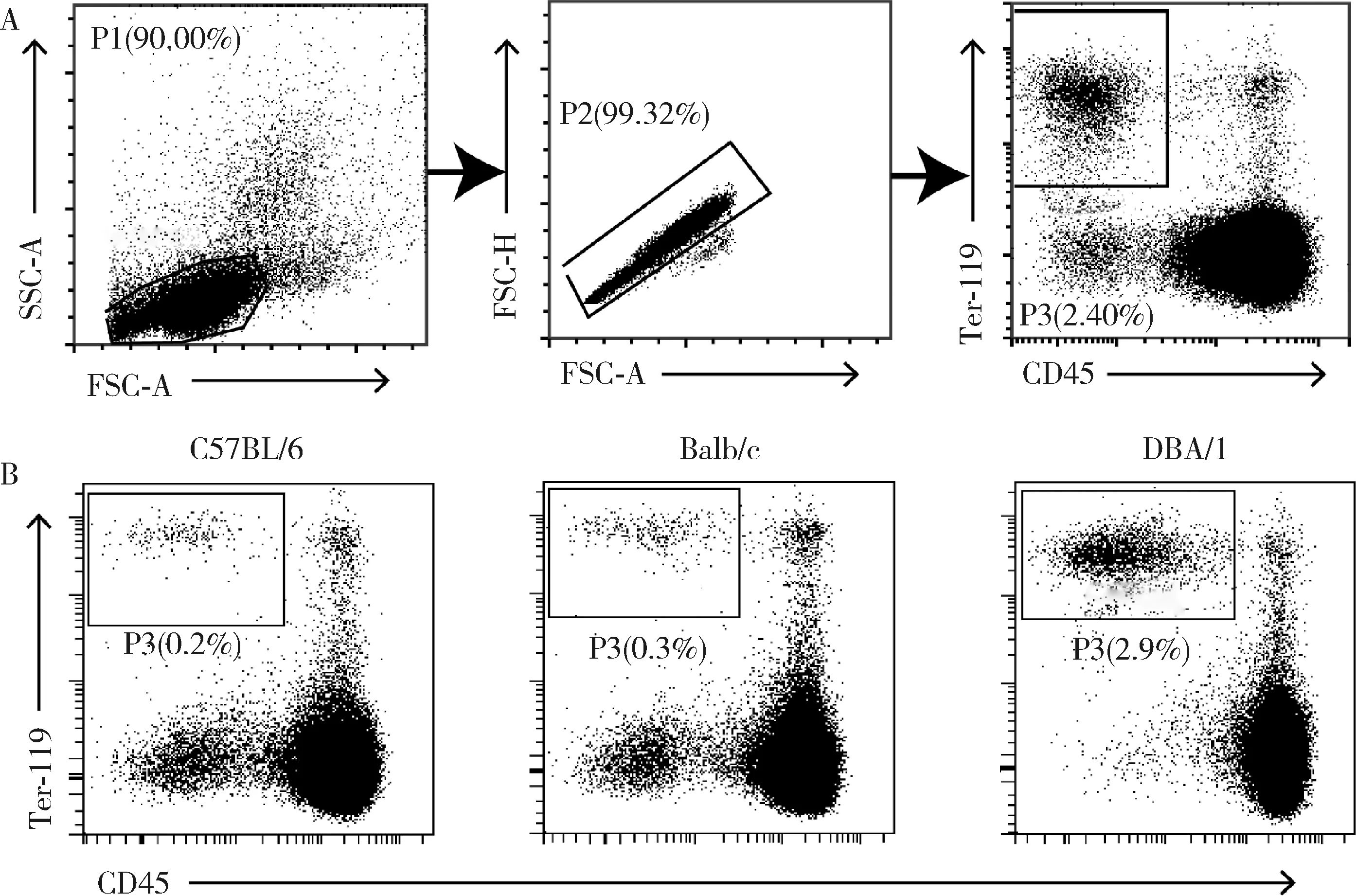
A,gating strategies for Ter cells in the spleen of mice; B, the frequencies of Ter cells in C57BL/6, Balb/c and DBA/1 mice.圖1 Ter細胞在不同品系小鼠脾臟中的分布Figure 1 Distribution of Ter cells in the spleen of different strains of mice
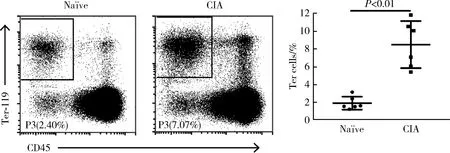
CIA, collagen-induced arthritis. Frequencys of Ter cells in the spleen of na?ve and CIA mice. Ter cells were increased markbly in CIA mice compared with na?ve mice.圖2 Ter細胞在發病高峰期CIA小鼠中明顯增加(n=6)Figure 2 Ter cells were significantly increased in CIA mice (n=6)
2.3 發病高峰期Ter細胞比例與CIA關節評分及T、B細胞亞群比例的相關性分析
根據關節評分將發病高峰期CIA小鼠分為兩組,以8分為分界線,評分≤8分為低評分,評分>8分為高評分。比較兩組小鼠脾臟Ter、Th1、Th17、GC-B細胞的比例,結果顯示,高評分組小鼠脾臟Ter細胞比例明顯低于低評分組(6.217%±0.841%vs. 10.827%±0.917%,P<0.01)。高評分組小鼠脾臟Th1細胞比例明顯高于低評分組(1.337%±0.110%vs. 0.727%±0.223%,P<0.05),高評分組小鼠脾臟Th17細胞比例高于低評分組(0.750%±0.171%vs. 0.477%±0.051%,P=0.099), 高評分組小鼠脾臟GC-B細胞比例明顯高于低評分組(1.243%±0.057%vs. 1.097%±0.015%,P<0.05),提示高峰期CIA小鼠脾臟Ter細胞比例與T、B細胞及其亞群比例可能存在相關性(圖3)。進一步的相關性分析結果顯示,發病高峰期CIA小鼠脾臟Ter細胞比例與CD4+T、Th1、Th17、GC-B細胞比例均呈強負相關,與B10細胞比例呈強正相關,初步提示這群細胞在CIA中可能具有保護作用(圖3)。
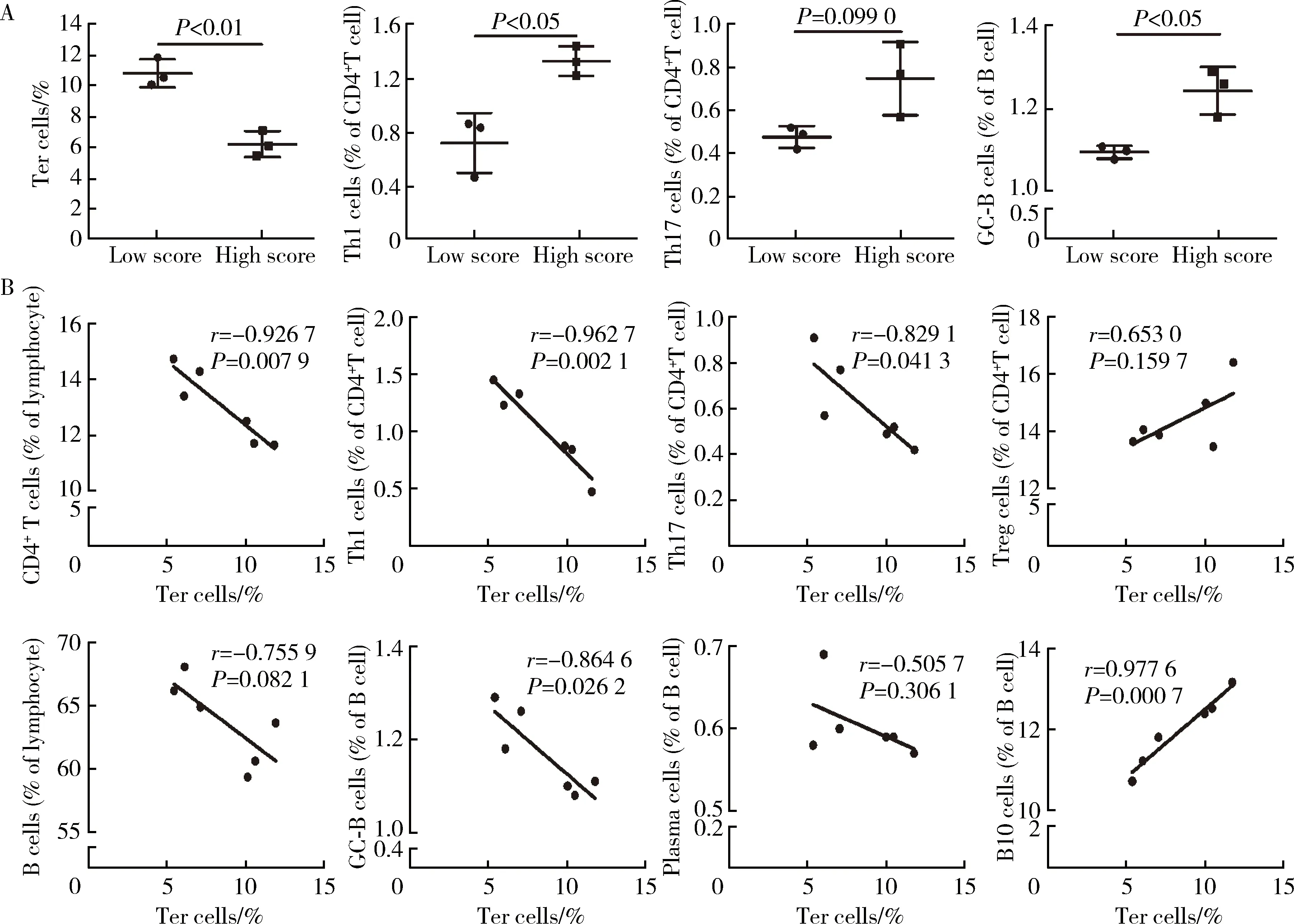
A, The differences of the frequencies of Ter, Th1, Th17 and GC-B cells between the mice with high score and low score at the peak stage of CIA; B, Correlation analysis of Ter cell frequencies with T and B cell subsets.圖3 CIA發病高峰期Ter細胞比例與關節評分及T、B細胞亞群的相關性分析Figure 3 Correlation analysis of Ter cell frequencies with joint score, T and B cell subsets
2.4 Ter細胞呈現動態變化,在CIA發病晚期比例降低
根據CIA發病時間和關節評分將CIA分為發病早期(發病1~2天,評分≤2分)、高峰期(發病15 d左右)、晚期(發病60 d以上)。流式細胞儀檢測各個階段CIA小鼠脾臟Ter細胞比例,觀察其動態變化過程。結果顯示,晚期CIA小鼠脾臟Ter細胞比例明顯低于高峰期(0.917%±0.588%vs. 8.522%±2.645%,P<0.001,圖4),進一步提示其可能作為一群免疫保護細胞參與CIA發病,但其具體作用及機制仍需后續進一步的體內及體外實驗驗證。
3 討論
RA的發病機制復雜,多種免疫細胞及細胞因子參與其發病過程,之前的研究主要集中在淋巴系和髓系細胞,例如T細胞、B細胞、自然殺傷細胞等淋巴細胞及其亞群及MDSCs細胞的相關研究,但關于紅系細胞在RA發病中的作用卻未見報道。
本研究首先證實了小鼠脾臟中存在Ter細胞,并且發現發病高峰期CIA小鼠脾臟中Ter細胞比例較na?ve小鼠明顯升高,提示Ter細胞可能參與CIA發展。接下來的實驗結果顯示,發病高峰期CIA小鼠脾臟Ter細胞比例與CD4+T、Th1、Th17、GC-B細胞比例均呈強負相關,與B10細胞比例呈強正相關。而研究表明,Th1、Th17、GC-B細胞在RA中發揮致病作用[9-10],B10細胞在RA中發揮保護作用[11],提示Ter細胞在CIA中可能具有保護作用。隨著疾病進展,發病晚期CIA小鼠脾臟Ter細胞比例明顯降低,進一步提示Ter細胞在CIA中可能作為一種保護性細胞發揮作用。
Ter細胞在RA中發揮保護作用的具體機制仍需進一步研究確認。在體外通過Ter細胞與na?ve T細胞共培養,觀察其對T細胞分化的影響;通過Ter細胞與不同T、B細胞亞群共培養,觀察其對不同T、B細胞亞群增殖的作用。在體內通過過繼轉移Ter細胞到CIA小鼠體內,觀察其對CIA發展的加重或減輕情況。通過以上研究將進一步明確Ter細胞在RA發病中的作用。
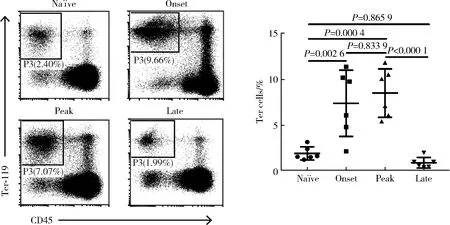
Frequencys of Ter cells in the spleen of na?ve and CIA mice at different stages. Ter cells were decreased markbly in CIA mice at late stage compared with peak stage.圖4 CIA不同發病階段Ter細胞的動態變化(n=6)Figure 4 Dynamic changes of Ter cells in different stages of CIA (n=6)
Han等[7]研究發現,在荷瘤小鼠中Ter細胞主要在脾臟發生異常擴增,參與疾病進展。RA的主要受累部位是關節和滑膜組織,Ter細胞是否在此部位異常聚集尚不清楚。我們目前正在進行RA患者滑膜組織中Ter細胞的數量及功能的研究;此外,CIA小鼠關節滑膜組織中Ter細胞的特征及功能也是我們未來的研究內容之一。
Ter細胞通過分泌artemin促進肝癌的進展,但Ter細胞在CIA中是通過artemin還是其他途徑發揮作用目前仍不清楚。研究表明,artemin在多種腫瘤中表達上調,促進腫瘤進展[12-14],但關于其在RA中的表達情況及作用仍未見報道,值得進一步研究。
綜上所述,本研究發現成紅細胞樣Ter細胞在發病高峰期CIA小鼠脾臟中明顯擴增,并且與關節評分及Th1、Th17、GC-B細胞比例均呈負相關,與B10細胞比例呈正相關,晚期CIA小鼠脾臟Ter細胞比例較高峰期明顯降低,提示Ter細胞參與RA發病并且可能發揮保護作用,表明紅系細胞可能參與RA的發病。后續研究中我們將進一步完善紅系細胞對RA發病作用的研究,以期深入理解RA的發病機制,并為RA的治療提供新的靶點。

