基于清炒法對白術物性及主成分含量變化的研究*
陳天朝,王 嬌,馬彥江 ,李瑞穎
(1.河南中醫藥大學第一附屬醫院藥學部,河南 鄭州 450000; 2.河南中醫藥大學藥學院,河南 鄭州 450008; 3.許昌市中醫院藥學部,河南 許昌 461000)
清代徐靈胎的《醫學源流論·方藥·制藥論》上卷第一章記載:“……或制其形,或制其味,或制其性,或制其質……”說明古人已經認識到炮制能改變中藥的形、色、氣、味,從而改變中藥的性能[1]。中藥炮制包括水制、火制、水火共制等多種方法,尤其是火制,即清炒法,包括炒黃、炒焦、炒炭。傳統火制能降低或消除藥物的毒性或副作用,改變或緩和藥物的性能,改變藥物作用的部位或增強對某部位的作用。多糖類藥材白術為菊科植物白術的干燥根莖,具有健脾益氣、燥濕利水、止汗、安胎的功效[2]。白術的炮制方法有麩炒、土炒、炒焦、炒炭、蒸制等,白術炮制品在臨床上使用較多,如生術片、焦白術、炒白術、土炒白術、白術炭和蒸白術等[3-4]。通過查閱相關文獻,筆者發現麩炒白術報道較多,清炒法白術炮制研究較少。基于此,本實驗對白術進行清炒法研究,探究不同清炒前后白術性質發生的變化,為日后炮制用藥提供指導,并且為白術清炒法炮制提供新的工藝。前期課題組陳天朝等人研究了黨參清炒前后物性及有效成分變化[5],探究了細粉與飲片之間物性傳遞[6]。本實驗以中藥宏觀屬性如中藥飲片物性,分子屬性如大分子、小分子的量變為指標,研究生藥飲片-炒黃飲片-炒焦飲片-炒炭飲片和細粉的動態過程。
1 藥品、試劑與儀器
白術,購置安徽普仁中藥飲片有限公司,批號1704093,經河南中醫藥大學第一附屬醫院藥學部陳天朝主任藥師鑒定,符合2015版《中國藥典》一部項下的各飲片來源規定。D(+)-無水葡萄糖,100 mg/瓶,上海源葉生物科技有限公司產品,批號S08J6G1。101AS-1型不銹鋼數顯電熱鼓風干燥箱,功率1.8 kW, 蘇州江東精密儀器有限公司產品;BSA224S-CW電子天平,德國賽多利斯公司產品;KSY可控硅溫控制器,沈陽節能電爐廠公司產品;A-13箱式電阻爐,沈陽節能電爐廠公司產品;CMAG HP7德國IKA加熱板,上海子期實驗設備有限公司產品;HH-S4電熱恒溫水浴鍋,北京科偉永興儀器有限公司產品;T11型智能滴定系統,上海晟聲自動化分析儀器有限公司產品;MH-500型可調式電熱套,功率0.2 kW,北京科偉永興儀器有限公司產品;FW-500高速萬能粉碎機,北京科偉永興儀器有限公司產品;2015版《中國藥典》藥典篩,浙江上虞市道墟五四儀器廠產品;研缽,江西景德鎮瓷器廠產品。
2 方法與結果
2.1 飲片制備
根據前期預實驗,選擇炒黃、炒焦、炒炭3種炮制方法,根據飲片炮制的形、色、氣、味、質確定實驗溫度和時間,炮制工藝見表1。

表1 白術最優炮制品對應炮制工藝
2.2 細粉制備
取2.1項下所用飲片,在高速萬能粉碎機中粉碎。對于不能完全粉碎的物料飲片,過篩采用研缽對其進行多次研磨,最后以全部通過5號藥典篩為標準。將所得的全部細粉再次過篩,備用。
2.3 物料參數的測定
2.3.1 相對密度測定
用100 mL量筒量取50 mL輕質液狀石蠟,靜置3 min,待凹液面穩定;用電子天平稱取約5 g飲片物料,投入盛有已知體積的輕質液狀石蠟的量筒中,靜置3 min;讀取體積,計算飲片物料相對密度。每種飲片平行測定3次,取平均值作為飲片的相對密度值,見表2[7]。
飲片物料相對密度(g/mL)=稱取飲片物料的質量g/(飲片投入量筒后體積mL-50)通過SPSS相關性分析,相對密度(X1)與炮制工藝參數(X2)相關性P=0.01,呈顯著性。
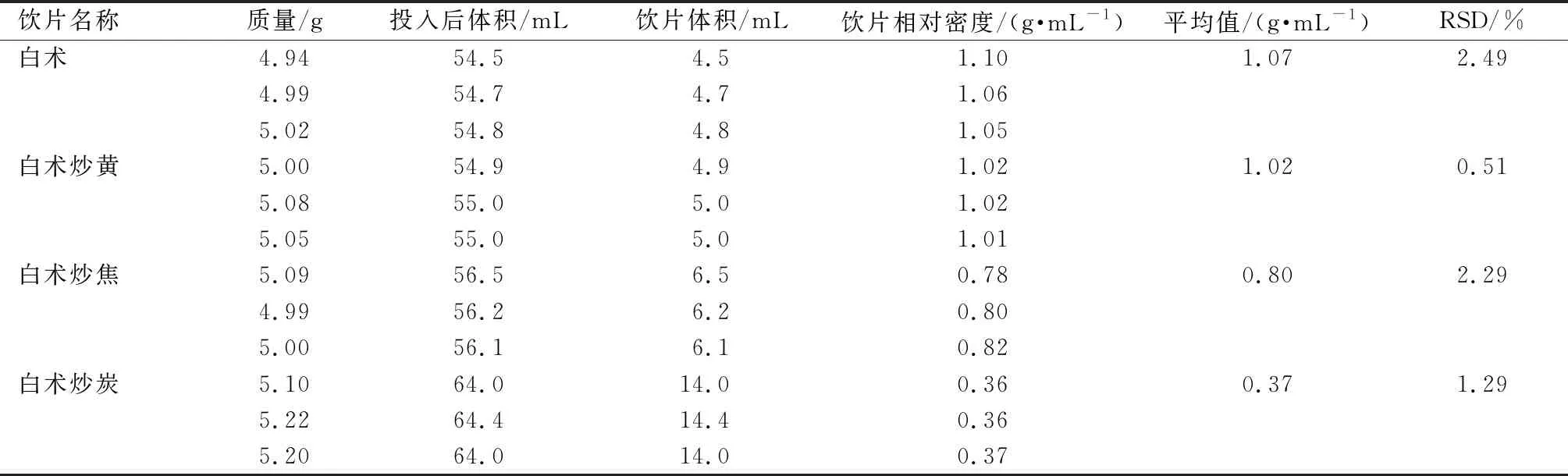
表2 白術及各炮制品的相對密度測定結果
2.3.2 氧化值測定
按照參考文獻[8-9]方法操作。準確稱取約5 g中藥飲片和200 mL蒸餾水于500 mL圓底燒瓶,混合均勻后接入蒸餾裝置,精確收集前50 mL餾分。用移液管準確移取10 mL餾分于滴定瓶內,加入25%H2SO45 mL和0.002 mol/L KMnO410 mL溶液,振蕩均勻后室溫下反應30 min。加入10% KI 5 mL,滴加Na2S2O3標準溶液,使溶液由黃棕色或深黃色變成淺黃色時,加淀粉溶液為指示劑1mL,用0.02 mol/L Na2S2O3標準溶液滴定至無色,記錄消耗Na2S2O3標準溶液體積為AmL。另以中藥飲片等質量水代替樣品重復操作進行空白試驗,記錄消耗Na2S2O3標準溶液體積為BmL。見表3。
氧化值:Ox=(B-A)×C×200/(5×0.002×V×M1)。其中,C為硫代硫酸鈉標準溶液的濃度(mol/L),200為樣品體積(mL),0.002為高錳酸鉀溶液的濃度(mol/L),V為樣品蒸餾餾分的取樣量(mL),M1為稱取樣品的質量。
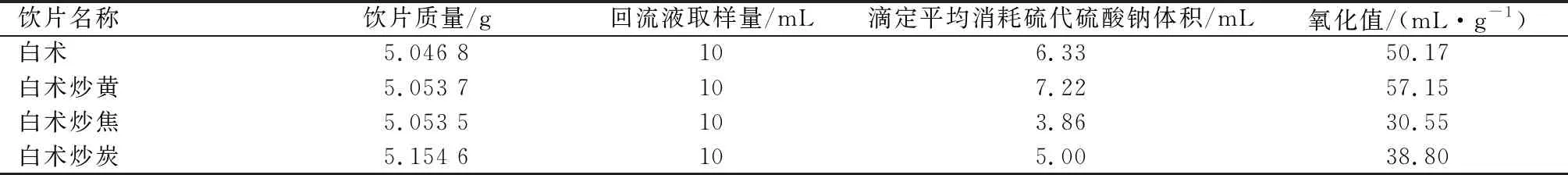
表3 白術及各炮制品氧化值測定結果
通過SPSS相關性分析,氧化值(X1)與炮制工藝(X2)之間P=0.046,呈顯著性。
2.3.3 吸水率測定
稱取約5 g中藥飲片,精密稱定,置盛有100 mL純化水的磨口錐形瓶中浸泡,分別在累積時間達到0,10,20,40,60,120,240,480,720,1 440 min后用尼龍網過濾,測定原100 mL浸泡用水剩余體積[6]。以浸泡用水體積幾乎不再減少為時間節點,對飲片在此時間下測定,每種飲片平行測定3次,取平均值作為飲片吸水率。見表4。中藥飲片吸水率=(100-吸水后浸泡用水剩余體積)/中藥飲片質量。
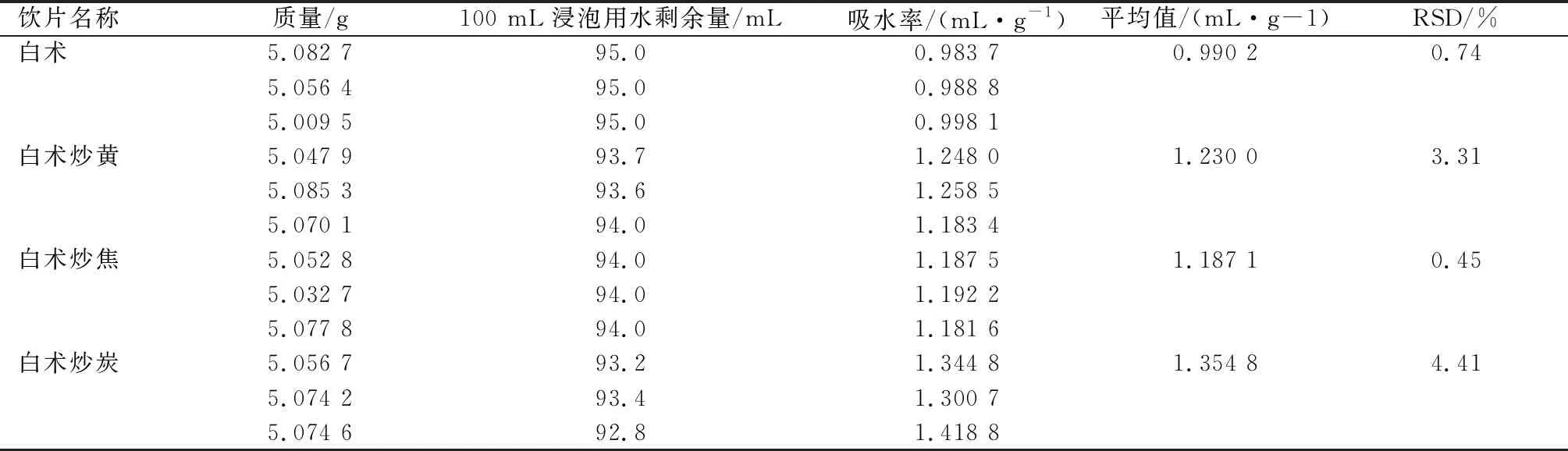
表4 白術及各炮制品吸水率測定結果
通過上述數據可知,吸水率變化不明顯,運用SPSS軟件分析,得出吸水率與炮制工藝之間無顯著性差異。
因炮制后飲片吸水率呈上升趨勢,根據經驗,炮制后飲片內有空隙,存在空腔。精密稱取約1.0 g物料細粉置于濾紙中,靜置1 h,過濾3 min,同法處理帶有物料細粉濾紙。每種物料細粉平行測定3次,取平均值,結果見表5。中藥細粉吸水率W2=(吸水飽和物料細粉和濾紙質量-吸水飽和濾紙質量)/吸水前物料細粉質量。

表5 白術及各炮制品細粉吸水率測定結果
對白術中藥飲片與細粉的吸水率進行相關性檢驗,結果P=0.007,表明中藥飲片炮制工藝與細粉的吸水率相關性顯著。
通過表4、表5得出飲片吸水率、細粉吸水率,以白術不同炮制品飲片吸水率為橫坐標、白術不同炮制細粉吸水率為縱坐標進行線性回歸,采用SPSS 20.0軟件處理,得到回歸方程[8]。結果如圖1。

圖1 白術飲片吸水率對細粉吸水率線性回歸分析
2.3.4 pH值測定
準確稱取約5 g中藥飲片,加水100 mL在室溫條件下,2.2.3項下測定時間浸泡。取濾液,測定pH值,每種飲片平行測定3份,取平均值,作為該飲片pH值。見表6。
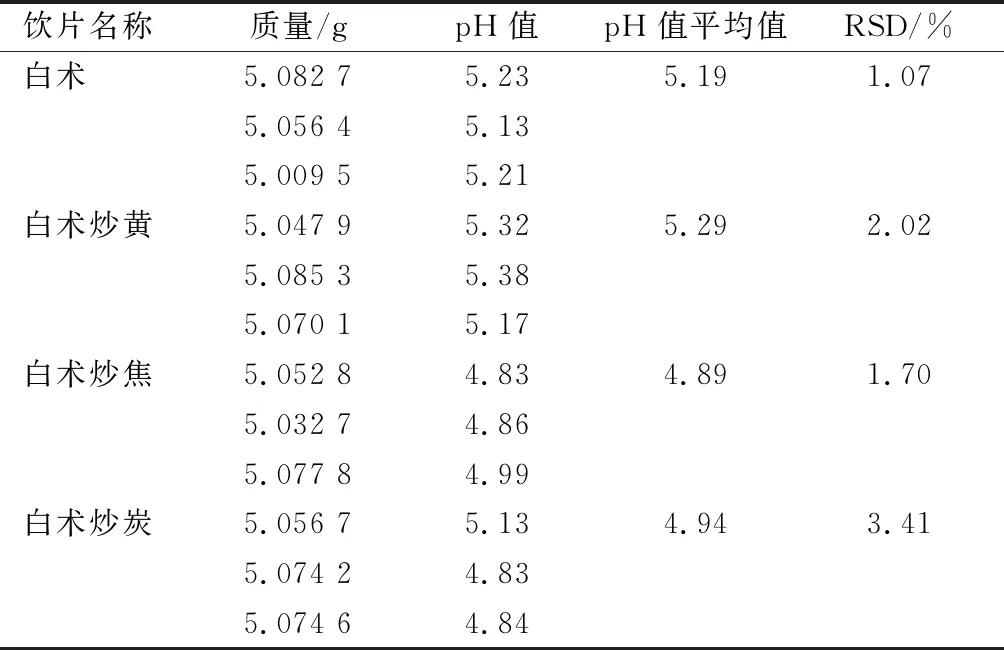
表6 白術及各炮制品PH測定結果
2.3.5 飲片色差測定

2.4 物料多糖含量測定
2.4.1 對照品溶液的制備
精密稱取105 ℃干燥至恒重的無水葡萄糖對照品5.57 mg,加蒸餾水使之溶解于50 mL容量瓶中,稀釋至刻度,搖勻,配制成0.111 4 mg/mL的葡萄糖對照品溶液[11]。
2.4.2 標準曲線制備
精密吸取葡萄糖對照品溶液0,0.1,0.2,0.4,0.6,0.8,1.0 mL置于具塞刻度的比色管中,補加純水至1 mL,置于10 mL試管中,加入的6%苯酚1 mL,搖勻,滴加濃硫酸5 mL,混勻后置沸水浴25 min,于冰水浴中15 min取出,在300~900 nm范圍內測定吸光度最大吸收波長。結果:葡萄糖最大吸收波長為490 nm。見圖2[12]。以葡萄糖含量為橫坐標,最大吸收波長下吸光度為縱坐標繪制標準曲線。見表8、圖3。
圖2 葡萄糖全波長掃描結果

葡萄糖溶液質量分數/(g·L-1)吸光度/Abs0.001 10.3800.002 20.4400.004 50.5500.006 70.6770.008 90.7830.011 40.881
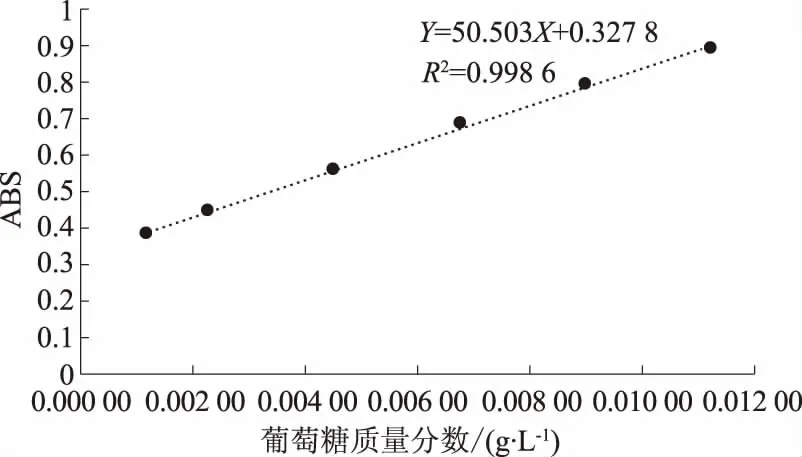
圖3 葡萄糖標準曲線
回歸方程:Y=50.503X+0.327 8(R2=0.998 6)。結果表明:葡萄糖含量在0.001 1~0.011 4 g/L之間線性良好。
2.4.3 樣品粗多糖提取
精密稱取藥材細粉1.00 g加入16倍量蒸餾水,78 ℃超聲提取48 min,離心,上清液用氯仿-正丁醇(4∶1)萃取2次,水層加4倍量950 mL/L乙醇,放入冰箱靜置過夜,濾過,殘渣用950 mL/L 乙醇、丙酮、乙醚依次洗滌,干燥[13]。
2.4.4 樣品含量測定
將所得各粗多糖加蒸餾水定容至50 mL,再精密吸取1 mL加蒸餾水定容至25 mL得樣品溶液。精密吸取1 mL置于10 mL試管中[14]。按2.3.2項下操作,在最大吸收波長下,測定供試液的吸光度值,計算各粗多糖提取率。見表9。

表9 白術及各炮制品多糖含量測定結果
通過SPSS相關性分析,多糖含量與炮制工藝之間P=0.04,呈顯著性。
2.4.5 精密度試驗
分別取濃度為0.004 3,0.005 7,0.007 2 g/L葡萄糖對照品溶液,在490 nm波長處測定吸光度,分別連續測定5次,RSD值均小于3%。結果表明:該儀器在490 nm下進行比色法精密度良好。
2.4.6 穩定性試驗
分別取白術生品供試品溶液,按照2.3.1項下方法,在490 nm處波長運用比色法分別于0,10,20,30,40,50,60 min后,測定吸光度,其RSD為1.65%。
2.4.7 重復性試驗
取白術生品細粉5份,按照2.3.2項下制備供試品溶液,按照2.3項下方法,在490 nm處波長采用比色法處測定吸光度,RSD為1.64%。
3 討 論
3.1 飲片炮制工藝對相對密度、吸水率、pH值的影響
中藥清炒炮制工藝通過對物性參數變化的影響而表現為動態傳遞過程,主成分含量經清炒炮制后存在主成分之間的相互轉化,物性與炮制工藝之間存在某種傳遞性。炒制火候對白術藥材的外觀性狀和內在質量有顯著影響。隨著火候的加深,白術相對密度逐漸下降,飲片吸水率呈上升趨勢,細粉吸水率呈下降趨勢,由此可得出:炮制改變了白術飲片內部結構,炮制程度越深,內部結構改變程度越大,使得飲片內部形成空腔越多。飲片大小影響其表面積。飲片被粉碎后,比表面積增大,對水的吸附性增加,對吸水率影響大,因此,有必要通過吸水率這一物性指標對清炒法進行數字化評價。白術pH值呈下降趨勢,證明隨著火候加深,藥材中離子解離度變大,電離出H+增多。通過測定藥材的pH值,可對中藥方劑學和藥物制劑學的研究提供某些參考[14]。
3.2 飲片炮制工藝對氧化值變化的影響
揮發油為白術的主要活性成分,油脂經高溫和氣流的作用會加速氧化,形成小分子有機酸。經不同炮制方法的白術揮發油含量會發生變化,飲片回流時有機酸會被氣流帶入裝有冷凝水的回流管中。利用油脂中的過氧化物與試劑發生化學反應,可測定油脂中的過氧化值。白術炒黃氧化值最大,可推測經炮制(炒黃)揮發油成分開始不穩定,大量油脂成分變成小分子有機酸,經回流被帶出,回流液中含大量揮發性成分,氧化值上升;當溫度繼續升高(炒焦、炒炭),白術揮發性成分開始大量流失,飲片中小分子酸成分也減少,回流液中含有的有機酸降低,使其氧化值降低。這與炒白術可緩和其辛燥之性相吻合,亦與后術炒焦后有“焦香健脾”作用相一致。測定發現炒白術的氧化值較生品降低,從美拉德反應來看,白術炒焦產生了令人增加食欲的愉悅香味[15]。
3.3 飲片炮制工藝對多糖含量的影響
多糖是由10個以上的單糖分子通過糖苷鍵聚合而成的,是分子量較大的多聚物。經炒制后白術多糖含量顯著升高(除炒炭下降外),說明還原糖含量隨炮制程度的加深含量增多,水溶性糖隨炮制程度加深含量減少。白術物料基礎為葡萄糖分子,受熱之后動態轉化,分子重新排列組合后可以相互轉化。同時隨著炒制程度的加大,揮發油的散失也在加大[16]。有研究表明土炒對白術多糖含量影響無統計學意義;白術炮制過程中多糖含量增加主要由炒制引起,輔料土無實質作用[17]。炮制是中醫藥的特色,經炮制產生的多種飲片規格在臨床的功用側重不同,其機制尚不完全清楚。清炒炮制不僅可以通過指標性成分判斷飲片是否合格達標,同時也可以通過物性指標來判斷。炮制程度與指標性成分之間具有一定的關聯性,間接影響飲片的臨床療效[18]。

