羅非魚羅湖病毒RT-PCR檢測方法的建立及初步應用
雷 燕,肖 洋,趙振峰,唐紹林,黎建斌,陳福艷
?
羅非魚羅湖病毒RT-PCR檢測方法的建立及初步應用
雷 燕1,2,肖 洋1,2,趙振峰1,2,唐紹林1,2,黎建斌3,陳福艷3
(1. 廣州利洋水產科技股份有限公司,廣東 廣州 510515;2. 廣州金水動物保健品有限公司,廣東 廣州 510515;3. 廣西水產科學研究院 廣西遺傳育種與健康養殖遺傳重點試驗室,廣西 南寧 530021)
【】建立快速檢測羅非魚羅湖病毒(Tilapia Lake Virus,TiLV)的RT-PCR方法。【】參照GenBank中羅非魚羅湖病毒全基因序列,依據其假定蛋白基因片段3設計合成1對特異性擴增引物,提取羅湖病毒RNA,逆轉錄成cDNA,進行PCR擴增,通過優化擴增條件和擴增體系,建立快速檢測羅非魚羅湖病毒的RT-PCR方法。用該方法對自然感染羅湖病毒發病的羅非魚樣品進行RT-PCR擴增。【】RT-PCR擴增得到與試驗設計相符的499 bp的特異性目的條帶,而對健康羅非魚、野生羅非魚及其他病毒對照組的擴增結果均為陰性。測序比對結果表明,該方法檢測結果準確,最低可檢測出約10 fg/mL的質粒DNA,具有較好的特異性和較高的敏感性。用該方法對332份臨床樣品進行RT-PCR檢測,其中36份樣品擴增出特異性的目的條帶,經測序比對,檢測結果正確。【】建立的檢測方法可用于TiLV的檢測。
羅非魚;羅湖病毒;快速檢測;RT-PCR
羅非魚羅湖病毒(Tilapia Lake Virus,TiLV),是近年來發現并報道的一種新病毒,最早于2009年在以色列被檢測到[1-2],已相繼在以色列[3]、哥倫比亞[4]、厄瓜多爾[4]、埃及[5]和泰國[6]發現。該病原體雖不會引起公共衛生問題,但可導致受感染種群大量死亡。據報道,該病毒傳染性較強,已造成以色列、厄瓜多爾、哥倫比亞等養殖羅非魚大面積死亡,死亡率高達80% ~ 90%,在埃及則造成5% ~ 15%的死亡[6]。據聯合國糧農組織發布的消息,TiLV可能比目前已知的分布范圍更廣,給全球羅非魚養殖造成嚴重威脅,目前已引起多個國家的重視。
TiLV是一種負鏈RNA病毒,基因組由10個獨立的基因片段組成,目前仍未確定其分類地位,極可能是正黏病毒科一種新型病毒[6]。其適宜生長溫度為24 ~ 33 ℃,最適生長溫度25 ℃[2]。目前尚無針對性疫苗和有效治療措施報道。2017年5月,本課題組首次從國內養殖的羅非魚中檢測出該病毒[7]。目前,羅湖病毒檢測僅見巢式PCR檢測方法[8]。本研究依據TiLV的假定蛋白(Hypothetical protein)基因segment 3的基因序列,建立針對TiLV的RT-PCR檢測方法,為其臨床對該病的診斷提供一種快速、敏感、準確的技術手段,有利于TiLV早期感染階段的檢測和流行病學的調查。
1 材料和方法
1.1 實驗用魚
TiLV陽性材料采自海南省文昌市潭牛鎮某羅非魚養殖池塘,由廣州利洋水產科技股份有限公司水產動物疾控中心實驗室(下稱“本實驗室”)收集、PCR擴增和測序鑒定并保存。野生未發病羅非魚樣品采集自廣東省珠海市,養殖未發病羅非魚采自廣東省廣州市。
1.2 實驗用毒株
錦鯉皰疹病毒(Koi herpesvirus,KHV)、鯉皰疹病毒Ⅱ型(Cyprinid herpesvirus II,CyHV-2)、真鯛虹彩病毒(Red-sea bream iridovirus,RSIV)、傳染性脾腎壞死病毒(Infectious spleen and kidney necrosis virus,ISKNV)的DNA和草魚出血病病毒(Grass carp reovirus,GCRV)、鯉春病毒血癥病毒(Spring viremia of carp virus,SVCV)、神經壞死病毒(Nervous necrosis virus,NNV)的cDNA均由本實驗室收集、保存。臨床樣品分別采自海南、廣東、云南、廣西等地羅非魚養殖池塘,計332份。
1.3 主要試劑
2×Taq PCR MasterMix、大腸桿菌()DH5α感受態細胞、高純度質粒小提試劑盒、大量瓊脂糖凝膠DNA回收試劑盒等購自天根生化科技(北京)有限公司。DNA分子標準DL2000、pMD19-T載體、RNAiso Plus、PrimeScriptTMRT Reagent Kit等購自寶生物工程(大連)有限公司。其他試劑為國產分析純。
1.4 引物設計與合成
根據GenBank中TiLV分離株Til-4-2011的假定蛋白基因segment 3的基因序列(GenBank登錄號:KU751816),應用DNAStar 5.0和Oligo6.0軟件設計1對特異性引物,預期擴增目的基因片段長度為499 bp。正向引物F:5′-GAATAATAAAGT GAGCTTAAG-3′,反向引物R:5′-CAGGGAAAG TACTGCATAGCG-3′。引物由華大基因(廣州)科技股份有限公司合成。
1.5 病毒RNA的提取
分別取TiLV陽性羅非魚的鰓、肝臟、脾臟、腎臟等組織100 mg,加入600 μL滅菌ddH2O,用玻璃勻漿器充分勻漿研磨,于-80℃至室溫反復凍融3次,將組織勻漿液以12 000 r/min、4 ℃條件離心10 min,取上清液400 μL,加入RNAiso Plus 400 μL,充分振蕩,室溫下靜置5 min。加入氯仿120 μL,用力振蕩10 s,室溫下靜置10 min,以4 ℃、12 000 r/min條件離心10 min,取上清液,加入等體積異丙醇充分混勻,靜置15 min,以4 ℃、12 000 r/min條件離心15 min。棄上清液,加入1 mL -20 ℃下預冷的體積分數75%乙醇,充分混勻,以4 ℃、12 000 r/min條件離心5 min,棄上清液,于室溫下干燥10 min,加入DEPC處理水60 μL溶解,- 80℃下保存。野生未發病羅非魚、養殖未發病羅非魚及待檢發病羅非魚樣品同法抽提RNA。
1.6 RT-PCR檢測方法的建立
逆轉錄(RT)反應體系(10 μL):1 μg/mL RNA 模板7 μL,5×PrimeScriptBuffer 2 μL、PrimeScript RT Enzyme Mix I 0.5 μL、Random 6 mers 0.5 μL。反應程序:于37 ℃下逆轉錄反應15 min,85 ℃下滅活逆轉錄酶5 s,4 ℃下保存,得cDNA產物。
PCR擴增體系(20 μL):2×Taq PCR MasterMix 10 μL、滅菌ddH2O 6 μL、cDNA模板3 μL和10 mmol/L上下游引物各0.5 μL。反應參數:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 35 s,72 ℃ 35 s,共30個循環;72 ℃ 10 min,4 ℃下保存。結果用12 mg/mL瓊脂糖凝膠電泳檢測。
1.7 陽性重組質粒的構建
PCR產物經回收試劑盒純化回收,與pMD19-T 載體連接后轉化至DH5α感受態細胞。在含氨芐青霉素的培養板上,于37℃下培養12~16 h,挑取單個菌落,增菌后用小量質粒抽提試劑盒提取質粒進行PCR分析鑒定,篩選出陽性重組質粒送上海英俊生物技術有限公司測序。
1.8 PCR反應體系和反應條件的優化
分別用寶生物公司的DNA聚合酶試劑盒及天根的PCR預混液優化Mg2+濃度、dNTPs濃度、酶濃度等指標,發現Mg2+濃度、dNTPs濃度、酶濃度等指標對實驗結果幾無影響;因此,反應體系僅優化引物濃度和模板濃度指標。
10 mmol/L上下游引物分別為0.1、0.2、0.3、0.4、0.5、0.6、0.8、1.0 μL,PCR產物電泳后確定引物濃度。
模版分別為0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 μL,PCR產物電泳后確定模板濃度。
分別以45.0、46.2、48.9、52.7、57.6、61.6、63.8、65.0 ℃作為退火溫度進行PCR,產物電泳后確定退火溫度。
1.9 RT-PCR特異性試驗
應用建立的RT-PCR方法分別對自然感染TiLV發病的羅非魚、健康羅非魚、野生羅非魚、KHV、CyHV-2、RSIV、ISKNV、GCRV、SVCV、NNV的DNA和cDNA進行檢測,驗證該方法的特異性。
1.10 RT-PCR敏感性試驗
測定構建的pMD19-CMNV質粒濃度,將重組質粒稀釋成1 ng/mL,再進行10倍梯度稀釋,以各濃度梯度的質粒作為模板,取1 μL進行PCR檢測,驗證該方法的敏感性。
1.11 臨床樣品檢測試驗
應用本研究建立的羅非魚羅湖病毒的RT-PCR檢測方法,對來自海南、廣東、云南、福建、廣西、江蘇、天津等地的332份臨床樣品進行檢測,將檢出的陽性樣本RT-PCR擴增產物送華大基因(廣州)科技股份有限公司進行測序,進一步驗證該方法的準確性和特異性。
2 結果
2.1 RT-PCR檢測方法的建立
利用臨床收集的羅非魚羅湖病毒陽性材料,設計合成特異性檢測引物,建立針對羅非魚羅湖病毒的RT-PCR檢測方法,該方法可從羅非魚羅湖病毒陽性材料中擴增出片段長度與實驗設計相符的目的條帶(圖1)。
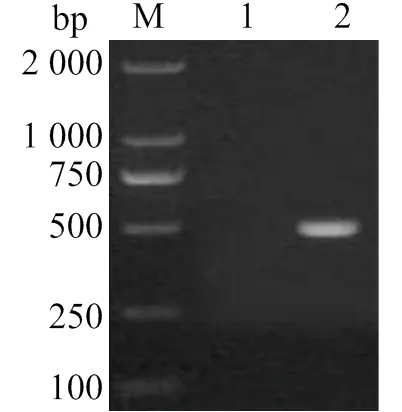
M:DNA分子標準DL2000;1:陰性對照;2:擴增產物
2.2 陽性重組質粒的構建
陽性目的條帶經純化回收,與pMD19-T載體連接,轉化DH5α感受態細胞。經篩選培養增菌后,用小量質粒抽提試劑盒提取質粒進行PCR鑒定,將此陽性克隆通過正反兩端2次測序獲得499 bp的序列,與GenBank中發布的羅非魚羅湖病毒基因序列(GenBank登錄號:KU751816)的同源性為99.6%。
2.3 PCR反應體系和反應條件的優化
比較不同濃度的引物、不同的模板濃度以及不同的退火溫度條件下PCR結果(圖2),確定反應體系為:2×Taq PCR MasterMix 10 μL,滅菌ddH2O 7 μL,cDNA模板2 μL,上下游引物各0.5 μL;反應程序為:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 35 s,72 ℃ 30 s,共30次循環;72 ℃ 10 min;4 ℃下保存。
2.4 RT-PCR特異性擴增結果
對自然感染羅湖病毒發病的羅非魚、健康羅非魚、野生羅非魚、KHV、CyHV-2、RSIV、ISKNV、GCRV、SVCV、NNV的DNA和cDNA的擴增結果顯示,僅自然感染TiLV發病的羅非魚擴增出499 bp的特異性目的條帶,而野生羅非魚、健康羅非魚及其他對照組均未擴增出任何條帶(圖3),表明該方法有較強的特異性。
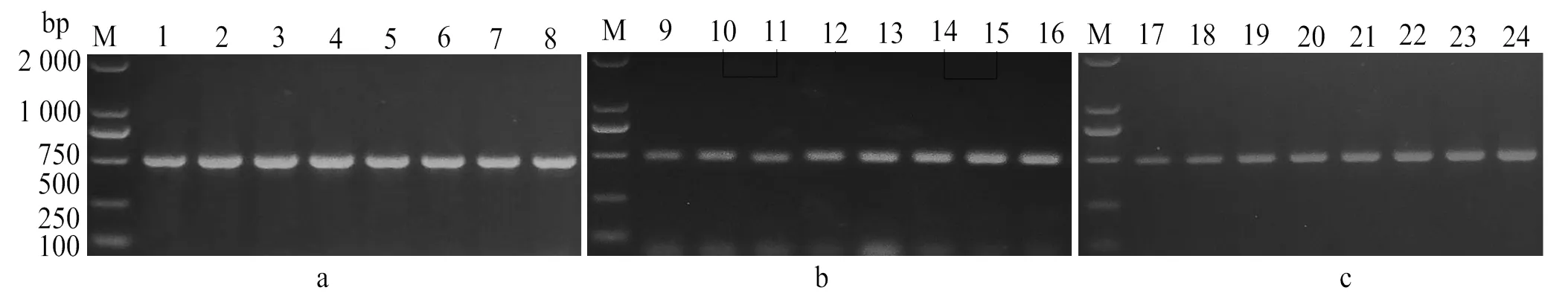
M:DL2000 DNA分子標準;1-8:引物用量分別為0.1、0.2、0.3、0.4、0.5、0.6、0.8、1.0 μL;9-16:模板用量分別為0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 μL ;17-24:退火溫度設為45.0、46.2、48.9、52.7、57.6、61.6、63.8、65.0 ℃

M:DNA分子標準DL2000;1:自然感染TiLV發病羅非魚;2:健康羅非魚;3:野生羅非魚;4:KHV;5:CyHV-2;6:RSIV;7:ISKNV;8:GCRV;9:SVCV;10:VNNV
2.5 RT-PCR敏感性擴增結果
將原始濃度為1 ng/mL的重組質粒DNA稀釋10-5倍時,仍可擴增出清晰的目的條帶,即該PCR檢測方法最低能檢出10 fg/mL的pMD19-TiLV質粒模板(圖4)。

M:DNA 分子標準;1-7:1 ng/mL, 100 pg/mL, 10 pg/mL, 1 pg/mL, 100 fg/mL, 10 fg/mL, 1 fg/mL 的pMD19-TiLV質粒
2.6 臨床樣品的檢測和測序分析
應用建立的羅非魚羅湖病毒RT-PCR檢測方法對332份臨床樣品進行檢測,檢出36份羅湖病毒陽性樣品(表1),經序列測定、比對,從自然發病羅非魚陽性材料中擴增的目的條帶基因序列與GenBank中羅湖病毒的基因序列同源性高達99.6%,進一步證實該檢測方法的準確性和特異性。
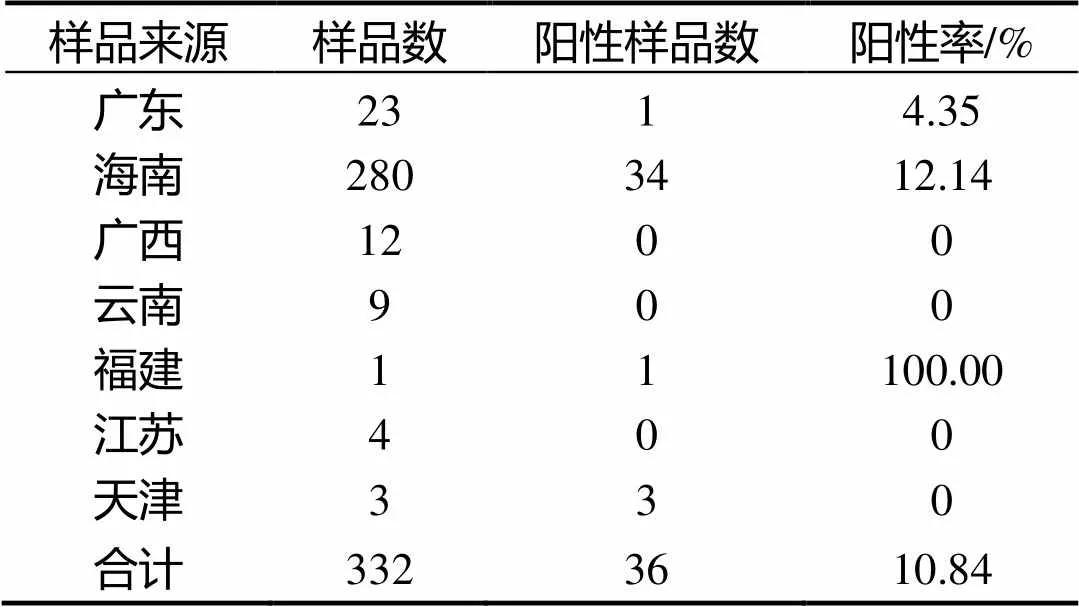
表1 不同地區臨床羅非魚樣品TiLV的RT-PCR檢測結果
3 討論
羅非魚為聯合國糧農組織(FAO)向全世界推廣養殖的優良魚種之一,其養殖已遍布多個國家和地區[9]。我國羅非魚養殖產量自2000年一直占世界羅非魚養殖總產量的50%以上[10]。近年來,隨著我國羅非魚養殖規模擴大,各種傳染性疾病呈現不斷增長的趨勢,危害羅非魚的主要傳染病有鏈球菌病[11-13]、細菌性敗血癥等[14-17]。2016年,Eran等[18]報道一種新型的致命病毒——羅湖病毒造成以色列、厄瓜多爾、埃及等國的養殖羅非魚大面積死亡。
本研究建立針對TiLV假定蛋白基因segment 3的RT-PCR檢測方法。最低檢出限為10 fg/mL重組質粒DNA,說明建立檢測方法有較高的敏感性。
本研究方法僅對自然感染羅湖病毒發病的羅非魚檢測出羅湖病毒,而對健康羅非魚、野生羅非魚、KHV、CyHV-2、RSIV、ISKNV、GCRV、SVCV、NNV均未檢出,說明所建立的RT-PCR檢測方法有很高的特異性。
目前對于TiLV的檢測,未見其他有效方法,Dong等[8]和Kembou等[19]建立了TiLV的巢式PCR檢測法,但該方法檢測步驟繁瑣,耗時長,不利于臨床樣品快速檢測要求。本研究建立的TiLV的RT-PCR檢測方法,可以特異、快速地檢測臨床樣品,可在3 h內完成檢測,且可對大量樣品進行檢測,這對羅湖病毒的早期診斷以及大量臨床樣品的檢測有重要意義。
綜上,本研究建立的羅非魚羅湖病毒RT-PCR檢測方法在對羅非魚樣品進行檢測時有較強的特異性和較高的敏感性,可快速地對大量臨床樣品進行檢測,適用于臨床樣本的批量檢測和羅湖病毒的流行病學監測。
[1] FERGUSON H W, KABUUSU R, BELTRAN S, et al. Syncytial hepatitis of farmed tilapia,(L.): a case report[J]. J Fish Dis, 2014, 37: 583-589.
[2] EYNGOR M, ZAMOSTIANO R, KEMBOU TSOFACK J E, et al. Identification of a novel RNA virus lethal to tilapia[J]. J Clin Microbiol, 2014, 52: 4137-4146.
[3] BACHARACH E, MISHRA N, BRIESE T, et al. Characterization of a novel rthomyxo-like virus causing mass die-offs of tilapia[J]. MBio, 2016, 7: e00431-00416.
[4] DEL-POZO J, MISHRA N, KABUUSU R, et al. Syncytial hepatitis of tilapia (L.) is associated with Orthomyxovirus-like virions in hepatocytes[J]. Vet Pathol, 2017, 54: 164-170.
[5] FATHI M, DICKSON C, DICKSON M, et al. Identification of tilapia lake virus in Egypt in Nile tilapia affected by “summer mortality” syndrome[J]. Aquaculture, 2017, 473: 430-432.
[6] DONG H T, SIRIROOB S, MEEMETTA W, et al. A warning and an improved PCR detection method for tilapia lake virus (TiLV) disease in Thai tilapia farms. https://www.researchgate.net/publication/316283907.
[7] 雷燕, 趙振峰, 李海濤.池塘養殖發病羅非魚檢出羅湖病毒.http://bbs.liyang-tech.com/forum.php?mod=view thread&tid=14932&highlight=%C2%DE%BA%FE%B2%A1%B6%BE&_dsign=01c74355.
[8] DONG H T, SIRIROOB S, MEEMETTA W, et al. Emergence of tilapia lake virus in Thailand and an alternative semi-nested RT-PCR for detection[J]. Aquaculture, 2017, 476: 111-118.
[9] 王瑋,丁建樂,房金岑.羅非魚產業標準化現狀及分析[J]. 上海海洋大學學報,2012,21(6):976-981.
[10] 楊弘.中國羅非魚產業發展趨勢與建議[J].海洋與漁業,2010(5):33-34.
[11] 盧邁新.羅非魚鏈球菌病研究進展[J].南方水產,2010,6(1):75-79.
[12] 王民權,葛朋彪.羅非魚主要病害控制技術[J]. 中國水產,2006(7):57.
[13] 郭玉娟,張德鋒,樊海平,等.中國南方地區羅非魚無乳鏈球菌的分子流行病學研究[J].水產學報,2012,36(3):399-405.
[14] 楊寧,黃海,張希,等.尼羅羅非魚嗜水氣單胞菌病的病原分離鑒定和藥敏試驗[J].水產科學,2014,33(5): 306-310.
[15] 陳善真,潘忠超,段元慧,等.一株尼羅羅非魚致病性嗜水氣單胞菌的分離鑒定及藥敏試驗[J]. 廣東農業科學,2014(7): 158-161.
[16] 李聰,蔡巖,周永燦,等.海南羅非魚致病性維氏氣單胞菌分離鑒定及藥敏特性研究[J].水產科學,2015,34(10): 640-646.
[17] 韋陽道,楊軍,文衍紅,等.羅非魚豎鱗病病原維氏氣單胞菌的分離鑒定與致病性研究[J].中國畜牧獸醫,2016,43(11):3047-3052.
[18]ERAN B, NISCHAY M, THOMAS B, et al. Characterization of a novel orthomyxo-like virus causing mass die-offs of Tilapia[J]. American Society for Microbiology, 2016, 7(2): 1-7.
[19] KEMBOU TSOFACK J E, ZAMOSTIANO R, WATTED S, et al. Detection of Tilapia lake virus in clinical samples by culturing and nested reverse transcription-PCR[J]. Journal of Clinical Microbiology, 2017, 55(3): 759.
Development and Application of a RT-PCR Assay of Tilapia Lake Virus
LEI Yan1,2, XIAO Yang1,2, ZHAO Zhen-feng1,2, TANG Shao-lin1,2, LI Jian-bin3, CHEN Fu-yan3
(1.,510515,; 2.,510515,; 3.,,530021,)
【】To establish a method for rapidly detecting tilapia lake virus (TiLV) byRT-PCR. 【】A pair of specific primers were designed according to the complete genome hypothetical protein segment 3 of a novel RNA virus, called TiLV, and RNA of TiLV was extracted and reversely transcribed to cDNA as template for PCR. A rapid RT-PCR method was established for detection ofTiLV by optimization of the reaction parametersAnd the Tilapia whichnaturally infected with TiLV was detected by the RT-PCR method. 【】The specific band of 499 bp was amplified from the positive sample, but no specific band was found from healthy tilapia, wild tilapia and other control. Sequencing analysis indicated that this method was accurate, and 10 fg/mL DNA plasmid of the TiLV could be detected. 332 clinical samples were collected and 36 of those were positive, and the detection result was verified by sequencing and sequence alignment.【】 The findings indicated that the RT-PCR assay could be used for the detection of TiLV. The established RT-PCR assay could lay the foundation for the detection and epidemiological investigation of TiLV infection.
Tilapia; Tilapia Lake Virus; rapid detection; RT-PCR
S943.125.41
A
1673-9159(2019)03-0001-05
10.3969/j.issn.1673-9159.2019.03.001
2017-06-27
廣西科技重大專項(桂科AA17204081-5);國家現代農業產業技術體系廣西創新團隊建設專項資金(nycytxgxcxtd-08-02)
雷燕(1983—),男,碩士,研究方向為養殖水產動物病害防治。E-mail: leikunnuy@163.com
陳福艷(1979—),女,副研究員,研究方向為水生動物病害與防治。E-mail: 215174469@qq.com
雷燕,肖洋,趙振峰,等. 羅非魚羅湖病毒RT-PCR檢測方法的建立及初步應用[J]. 廣東海洋大學學報, 2019, 39(3): 1-5.
(責任編輯:劉慶穎)

