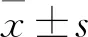
多肽301LARSLKT307對斑馬魚胚胎早期心臟發育的影響
胡 銀,劉 恒,嚴湘蕓,莊 斌,陳文娟,王星云,韓樹萍,余章斌
法洛四聯癥是常見的復雜先天性心臟病,其發生率約占活產嬰兒的4‰,死亡率則達5%以上,且需二次手術的患兒高達30%[1],給家庭和社會帶來沉重的負擔。早期診斷及早期治療可以顯著提高患兒的存活率。本課題組早期利用氣-液聯動質譜技術,對法洛四聯癥流產胎兒心肌組織進行多肽組學進行分析[2],發現TALIN-1結構域來源的多肽301LARSLKT307含量較對照組有顯著差異,提示這條多肽可能與心臟的發育及功能相關。為了驗證此假設,該研究用顯微注射技術將多肽注射入斑馬魚受精卵,構建胚胎發育模型,研究在此條件下該多肽對心臟發育的影響。
斑馬魚的心臟發育,在基因表達、形態發生以和生理特性上均與哺乳動物高度相似[3]。并且,斑馬魚胚胎在體外受精與發育、胚胎透明、產量大,且可不完全依賴于心血管系統存活[4]。斑馬魚心臟發育迅速,72 h即可完成胚胎期心臟發育[5],相當于人類妊娠8周內心臟發育的過程。這些優勢使得斑馬魚成為心臟發育研究的重要模型。該研究從多肽對斑馬魚的生長發育過程的影響入手,為闡明多肽與胚胎心臟發育畸形的內在機制提供理論依據和線索,以期望能夠對人類先天性心臟病的診斷及治療的研究方面有所幫助。
1 材料與方法
1.1 實驗動物Tubingen品系野生型成年斑馬魚購自南京大學模式動物研究所,雌雄斑馬魚分缸飼養,每日予光照14 h、黑暗10 h的人工光照周期;成年斑馬魚予脫殼豐年蟲喂食3次/d。實驗前12 h,將成年雌雄斑馬魚等比例配對移入交配缸,并用擋板分開,次日亮燈前抽取擋板,光照刺激促排卵,15 min后收集胚胎。收集的胚胎置于28.5 ℃恒溫培養箱中,及時更換培養液并挑出死亡的胚胎,防止影響其他胚胎發育。
1.2 試劑與儀器
1.2.1主要試劑 多肽及對照隨機亂序肽均委托北京澤溪源公司化學合成,序列分別為LARSLKT和ALKTLRS;原位雜交RNA探針:心肌肌球蛋白輕鏈2型基因(cardiacmyosin light chain-2,cmlc2)、心室肌球蛋白重鏈基因(ventricular myosin heavy chain,vmhc)、心房肌球蛋白重鏈基因(atrtal myosin heavy chain,amhc)由南京市婦幼保健院醫學研究中心贈送;Tween-20購自美國Amresco公司;甲酰胺購自美國Promega公司;酵母RNA、多聚甲醛、蛋白酶K、色素抑制劑、馬來酸、左旋咪唑、苯甲酸、苯甲醇、甲基纖維素、三卡因均購自美國Sigma公司;封閉劑、地高辛抗體、地高辛標記的UTP、顯色液、氯化硝基四氮唑藍(NBT)、對甲苯胺藍(BCIP)均購自德國Roche公司;TRIzol購自美國Invitrogen公司;動物組織總RNA提取試劑盒購自北京天根公司;反轉錄試劑盒及SYBR Premix Ex TaqTM II購自日本TAKARA公司;余試劑均為國產分析純。
1.2.2主要試驗儀器 隔水式電熱恒溫培養箱(型號:PYX-DHS)購自上海躍進公司;Olympus體式顯微鏡(型號:MVX-TV0.63XC)購自日本Olympus公司;徠卡立體顯微鏡(型號:MZ16F)購自英國Leica公司;原位雜交爐(型號:HL-2000 Hybrilinker)購自美國UVP公司;Real-time PCR儀(型號:ViiA 7)購自美國UVP公司。
1.3 實驗方法
1.3.1實驗分組與多肽的顯微注射 將1次所產的胚胎隨機分為3組,野生型組(WT)、實驗多肽注射組(PEP)、對照多肽注射組(NC)。PEP組在45 min內(斑馬魚胚胎1細胞期)進行顯微注射,每個胚胎注射10 μmol/L的實驗多肽液1 nl于受精卵的卵黃囊部位。NC組的胚胎在45 min內注射10 μmol/L的對照多肽液1 nl于受精卵的卵黃囊部位。WT組正常生長,不作處理。注射完成后,胚胎立即置于28.5 ℃恒溫培養箱中,及時更換培養液并挑出死亡的胚胎,防止影響其他胚胎發育。
1.3.2斑馬魚心率計數 將斑馬魚胚胎置于3%甲基纖維素中,于顯微鏡下計數斑馬魚胚胎1 min心跳數,得到心率。
1.3.3斑馬魚胚胎原位雜交 收集不同發育時期的胚胎,每管40個胚胎。胚胎撕掉鞘膜,用4%的多聚甲醛固定過夜后,25%、50%、75%、100%甲醇梯度脫水,保存于-20 ℃。原位雜交時,25%、50%、75%、100%的PBST梯度水化胚胎,4%多聚甲醛固定20 min,蛋白酶K(20 μg/ml)處理20 min,緩沖液反復清洗后,轉移到hyb-液中,65 ℃雜交爐孵育5 min,換入hyb+液預雜交4 h,接著加入含有1 ng/μl的RNA探針(cmlc2、vmhc、amhc)的hyb+液,65 ℃雜交爐中過夜,SSC溶液反復洗去非特異性結合的探針,然后換入封閉液室溫封閉1 h終止反應,之后換為含有1/4 000體積地高辛抗體的封閉液,4 ℃過夜,MABT室溫洗滌,用于洗去非特異性結合的抗體,依次加入平衡液和顯色液進行避光顯色4 h。顯色結束后用緩沖液清洗,進一步洗去非特異性信號,將胚胎置于包埋液(苯甲酸與苯甲醇按2 ∶1配制),于徠卡立體顯微鏡下拍照并采集圖像。
1.3.4RNA的提取及cDNA的制備 收集12 h的三組斑馬魚胚胎各20個,加入0.7 ml TRIzol,用勻漿器充分研磨。室溫靜置10 min后,加入140 μl氯仿,震蕩混勻,4 ℃、10 400 r/min離心15 min;轉移上層液體到新的離心管,加入1.5倍體積的乙醇充分混勻,轉移至RNeasy,室溫10 400 r/min離心1 min,棄廢液;向吸附柱中加入350 μl RW1,10 400 r/min離心1 min,重復1次;加入500 μl RW,室溫2 min后10 400 r/min離心1 min,棄廢液,重復1次;空轉10 400 r/min離心1 min,置于通風處放置5 min,向吸附柱中加入50 μl水,室溫靜置2 min,將吸附柱轉移至另一1.5 ml離心管,10 400 r/min離心2 min。核酸定量儀讀OD值測出濃度,A260/A280為1.8~2的判定質量較好。加入2.0 μl 5×gDNA Eraser Buffer、1.0 μl gDNA Eraser、1 μg斑馬魚總RNA,用DEPC水定容到10 μl,混勻之后,42 ℃反應2 min,冰上放置2 min以去除基因組DNA;加入4.0 μl 5×PrimeScript? Buffer 2(for Real Time)、1.0 μl PrimeScript? RT Enzyme Mix I、1.0 μl RT Primer Mix,DEPC水定容到20 μl,此過程在冰上進行,混勻之后37 ℃反應15 min,85 ℃反應5 s,所得cDNA貯存在-20 ℃。
1.3.5實時定量PCR(qPCR) 采取SYBR Green法進行實時定量PCR,使用的相關引物見表1,模板為胚胎12 h的cDNA,10 μl反應體系,其中包括5 μl 2×SYBR Green Master Mix,0.5 μl 的正向引物(10 μmol/L)和反向引物(10 μmol/L),50 ng cDNA,0.2 μl Rox,加DEPC水定容至10 μl。將上述體系試劑加入384空板中,放入熒光定量PCR儀中進行40個循環的PCR擴增,反應條件如下:50 ℃ 2 min;95 ℃ 10 min;95 ℃ 10 s;60 ℃ 31 s。擴增結束后所得CT值采用相對定量法以β-actin為內參基因計算目的基因表達量的比值,用Fold值表示,用標準的t檢驗進行統計學分析。

表1 實時定量PCR目的基因的引物
1.4 多肽的基本生物信息學分析通過NCBI(https://www.ncbi.nlm.nih.gov/protein/)在線網站查找多類物種的TALIN-1前體蛋白序列;采用Uniprot(http://www.uniprot.org/)蛋白數據庫Blast方法確定該肽的位置及其與前體蛋白和結構域間的關系;使用ProtParam tool(https://web.expasy.org/protparam/)在線數據庫分析該肽的理化性質特征。
2 結果
2.1 多肽301LARSLKT307的生物學信息通過NCBI在線網站查找出包括斑馬魚及人類在內多類物種的序列,發現在這些物種中,TALIN-1蛋白的該段多肽序列高度一致(圖1A),這種進化上的高度保守性提示TALIN-1蛋白的該段序列肽,可能在生物的發育過程中起重要作用。利用質譜定量技術,對這條肽進行分析,結果見圖1B。通過Uniprot在線網站查詢得知,該條肽的前體蛋白TALIN-1主要位于細胞膜及細胞骨架中,該肽位于其前體蛋白的301~307氨基酸位點,在其前體蛋白的B41結構域內,該結構域的功能是與細胞膜相結合,在細胞膜的組裝和穩定中起支撐和調節作用。這條肽處于該結構域中,可能可以發揮與之相同或相反的功能。通過ProtParam tool查找發現該多肽在真核生物中的半衰期是5.5 h,不穩定系數為59.21;親脂系數(aliphatic index)為:125.71,親水系數(grand average of hydropathicity)為-0.07,這提示該肽是脂溶性較親水性強的多肽,易通過擴散或者胞吞的方式進入細胞內。
2.2 多肽對斑馬魚心包的影響為更進一步了解斑馬魚心臟發育情況,顯微注射后利用立體顯微鏡記錄下斑馬魚發育36、48和72 h各組的心臟的發育情況(圖2)。研究表明PEP組的斑馬魚在36 h已開始出現輕微的心包水腫,隨著時間的遷移,斑馬魚心包的水腫情況越來越明顯。
2.3 多肽對斑馬魚心率的影響心率是衡量心臟功能的重要指標,是衡量多肽對心臟發育影響的重要依據。分別計數36、48、72 h各組斑馬魚的心率,每組每個時間點計數至少10條斑馬魚。36 h斑馬魚心率WT組為(150.20±7.16)次/min、NC組為(150.00±8.84)次/min、PEP組為(87.20±15.14)次/min;48 h斑馬魚心率WT組為(143.67±6.15)次/min、NC組為(142.25±7.58)次/min、PEP組為(120.75±11.80)次/min;72 h斑馬魚心率WT組為(174.73±5.98)次/min、NC組為(171.18±5.98)次/min、PEP組為(161.73±10.44)次/min,具體的結果見圖3。WT組與NC組斑馬魚胚胎心率差異無統計學意義,36、48和72 h的P值分別為0.96、0.62、0.12。但與WT組相比,PEP組各時間點的心率均呈下降趨勢,差異有統計學意義,36、48、72 h的P值分別為5.82E-10、5.30E-06、1.02E-03。
2.4 原位雜交檢測多肽對心臟環化的影響收集斑馬魚48 h的胚胎,利用cmlc2、amhc、vmhc這3種分別標記斑馬魚的心臟整體、心房和心室的探針,與斑馬魚胚胎原位雜交,顯色后使得心臟的形態在立體顯微鏡下得以顯示,以此來研究多肽處理對心房心室發育的影響。結果顯示,WT組與NC組均能正常環化,心房心室呈S型,但PEP組心臟卻未見明顯環化(圖4)。
2.5 qPCR檢測多肽對心臟祖細胞分化的影響本研究對發育12 h的斑馬魚胚胎進行相關基因qPCR檢測,包括祖細胞分化發育相關基因mef2c、nkx2.5和心臟房室發育相關基因amhc、vmhc。以WT組的各基因相對表達量為1,PEP組各基因的相對表達量amhc(0.37±0.05)、vmhc(0.248±0.072)、mef2c(0.092±0.014)、nkx2.5(0.56±0.127),各基因的表達出現不同程度的降低,P值分別為6.73E-04、1.85E-02、2.02E-05、1.08E-01,除nkx2.5,其余均小于0.05(圖5),這說明多肽301LARSLKT307對于胚胎心臟發育的影響,從心臟祖細胞時期的細胞分化就已經有影響,但對于mef2c的影響作用強于對nkx2.5的影響。

圖1 多肽301LARSLKT307生物學基本特征分析

圖2 多肽301LARSLKT307處理對斑馬魚心臟發育的影響 ×120
A、D、G:野生型斑馬魚發育的大體形態;B、E、H:對照多肽處理對斑馬魚發育大體形態的影響;C、F、I:實驗多肽處理對斑馬魚心包水腫的影響

圖3 多肽301LARSLKT307對斑馬魚心率的影響
3 討論
多肽能夠影響心臟的發育與功能,對于治療和預測心血管疾病有著巨大的潛力。多肽301LARSLKT307是在法洛四聯癥心臟組織中發現的一條TALIN-1來源的多肽。TALIN-1是細胞黏附的關鍵蛋白,對于維持心臟Z-盤穩定和內皮完整性是必要的[6]。且這條多肽位于起支撐和調節細胞膜的組裝和穩定作用的B41結構域中。多肽301LARSLKT307所處的前體蛋白及其結構域,對于心臟的功能及結構的影響均已有文獻報道。但是由TALIN-1蛋白的結構域剪切所產生的多肽對于心臟的發育與功能是否存在影響,還沒有相關研究。本課題組在斑馬魚發育1細胞期,通過顯微注射構建多肽301LARSLKT307處理的斑馬魚胚胎實驗模型。生物信息學分析顯示這條多肽是脂溶性較強的多肽,易于進入細胞內,是多肽可能在細胞內發揮功能的前提條件。雖然這條多肽的半衰期為5.5 h,但斑馬魚的心臟發育是一個連續而協調的過程,造成的影響可能是長期而深遠的。根據研究結果,PEP組的斑馬魚胚胎出現心率降低、心包水腫、心臟的環化及祖細胞的分化受到影響。這些都提示這條多肽能夠影響斑馬魚心臟的發育及功能的行使。
心臟的泵血功能受心率及每搏輸出量影響。本研究顯示,與WT組及NC組比較,PEP組的斑馬魚出現心率下降的情況,差異有統計學意義。心包水腫會使得心包腔內壓力增大,妨礙房室的舒張充盈,使得每搏輸出量降低。心率降低與心包水腫綜合作用,使得心臟每分搏出量更加降低,影響心臟泵血功能,說明多肽能夠影響心臟的功能。

圖4 原位雜交觀察多肽注射對于心臟房室環化的影響 ×120

圖5 qPCR檢測多肽對12 h時斑馬魚胚胎心臟發育相關基因的影響
1:amhc;2:vmhc;3:mef2c;4:nkx2.5;與WT組比較:*P<0.05,***P<0.001
斑馬魚心臟的發育是一個復雜的過程,包括胚胎前端中軸兩側的側板中胚層細胞(祖細胞)分化成心臟前體細胞、前體細胞向中軸遷移匯聚、融合成原始心管、房室分化完成、心臟環化和瓣膜的發生與成熟[7]。其中,心臟環化為多腔室器官的形成提供條件,是脊椎動物心臟發育過程中關鍵的形態發育事件,法洛四聯癥的出現與心臟的環化異常高度相關[8]。心臟環化異常可導致房室間隔發育延遲,動脈干未及時反向轉動及位置異常,因而導致心腔和血管之間組裝出現問題,這是法洛四聯癥出現的重要病理機制。原位雜交是一種應用標記探針與組織細胞中的待測核酸雜交,再應用標志物相關的檢測系統,在核酸原有的位置將其顯示出來的一種檢測技術。本研究選用cmlc2、vmhc和amhc這些在斑馬魚心臟房室特異性表達的基因探針進行原位雜交,來觀察心臟的發育。cmlc2是心肌輕鏈2型,特異性在整個心臟表達;vmhc是心室肌球蛋白重鏈基因,特異性在心室表達;amhc是心房肌球蛋白重鏈基因,特異性在心房表達,是心房肌的分化標志物。研究[5]表明正常斑馬魚胚胎在48 h心臟環化已經完成,心房心室呈S型。本研究顯示胚胎發育48 h時,PEP組的斑馬魚心臟環化尚未完成,證實多肽301LARSLKT307能影響斑馬魚胚胎心臟的環化,說明該多肽對于心臟的結構也存在影響。
為了進一步深入了解多肽301LARSLKT307對心臟功能和結構影響的機制,本實驗對心臟祖細胞分化發育相關基因mef2c、nkx2.5及房室發育相關基因amhc、vmhc進行檢測。nkx2.5是前部側板中胚層心臟祖細胞分化的標記基因[9]。mef2c是最早在心臟中表達的mef2家族基因,與nkx2.5一起促進心肌細胞的分化[10]。實驗發現,PEP組中這些基因的表達較野生型組及NC組降低,說明多肽301LARSLKT307對于斑馬魚胚胎心臟房室發育的影響,是從心臟祖細胞時期就已經存在,且可影響心臟祖細胞的分化。祖細胞的分化程度降低可能是房室發育異常的原因,而心率的減慢及心臟環化的異常也可能與心臟祖細胞的分化受阻相關。
綜上所述,法洛四聯癥來源的多肽301LARSLKT307能夠在胚胎期顯著抑制心臟的發育與功能,這可能是通過影響心臟祖細胞的分化所導致。本研究為深入探討多肽在心臟發育及功能中的影響奠定了基礎,同時也為先天性心臟病的早期診斷和治療提供了新的靶點和思路。

