基于歐盟經驗的我國藥品“兩票制”流通監管模式創新研究
王茂林,張建華
(1.陜西省榆林市食品藥品稽查大隊,陜西 榆林 719000;2.西安交通大學醫學院,陜西 西安 710061)
近幾年,國內藥品流通行業在醫療衛生行業與健康行業的發展中做出了重大貢獻。隨著我國經濟實力的不斷提高,這個行業的作用越來越大[1]。然而,隨著藥品流通行業發展速度的提高,出現了一些監管方面的問題[2],如公立醫院壟斷銷售的問題以及以藥養醫的問題等[3],同時還存在著市場監管不足、價格管理不夠靈活、醫保支付不夠健全、招標采購不夠透明等問題[4],使藥品流通行業在轉型的過程中出現了穩定性不夠的無序狀態。所以,“多、小、散、亂”出現在當今的藥品市場中,造成了流通環節和流通秩序混亂等問題,影響了藥品市場的健康發展[5]。中央于2016年出臺了《關于深化醫藥衛生體制改革2016年重點工作任務的通知》,在文件中發布了關于藥品流通的“兩票制”管理方案。隨后,一些省(市、自治區)分別發布了相關文件。藥品流通行業的改革受到了醫療衛生部門的重視,被公認為是難度最大的改革領域。當前,我國實行“兩票制”改革方案的省、直轄市、自治區(港、澳、臺除外)已經達到了31個,有16個省已經開始試行[6]。在“兩票制”的改革背景下,傳統的藥品流通體系逐漸瓦解,構建新的藥品流通商業模式勢在必行。所以,本研究對傳統藥品流通商業模式的特點進行了闡述,對“兩票制”對相關行業的影響進了分析,在借鑒歐盟藥品流通監管經驗的基礎上,提出加強“兩票制”下藥品流通監管的建議,為進一步完善我國藥品“兩票制”流通監管模式提供參考。
1 我國傳統藥品流通商業模式的特點
藥品流通在試行“兩票制”政策之前,傳統的藥品流通模式有兩種,一種是直營辦事處模式,另一種是招商代理模式[1]。藥品進入市場采用什么樣的流通模式,是由生產商的實力(經營水平、生產水平、銷售水平、壟斷水平)等決定的。從理論方面看,直營辦事處模式對于品牌藥和原研藥兩種類型的藥物較為適合,這種類型對大型制藥企業比較有利。同時,代理模式對于小型制藥企業比較適合,他們往往采取的是混合模式,所采用的藥也一直是非重點品種,這些藥物通常由代理商管理,他們只負責重點品種的管理,參與一些重要的市場活動。
1.1 直營辦事處模式
直營辦事處模式是一種網絡營銷模式[7],藥品生產商負責市場開發、學術推廣和產品宣傳,物流與分銷則由經銷商負責完成。這種模式不僅具有捕捉市場信息速度快的優勢,而且更容易把握市場需求,同時對市場的銷售情況、銷售渠道、銷售能力都有充分的掌握,能夠對庫存做到精準管理。同時不僅建立了自己的銷售團隊和宣傳團隊,還有自己的推廣團隊,對公司品牌形象的提升有著重要的作用。但是該模式也有不足之處:后期運作投入過多,使得成本大幅提高,同時由于大部分利潤都在生產商手中,經銷商利潤太少,影響了他們銷售的動力。
1.2 招商代理模式
研究表明,“兩票制”政策沒有出臺之前,國內的4800多家制藥公司中只有600多家建立了營銷隊伍,絕大部分制藥公司由于人力和財力資源有限,通常通過營銷網絡和代理商進行藥品銷售[8]。受招商代理模式的影響,制藥公司給代理商的價格是成本價,整個環節都由代理商負責,這種模式不僅打開市場快,而且資金回收快,容易提高市場的覆蓋面。然而公關、推廣與營銷等多方面的費用較高,同時分銷商太多,加價的次數太多,使藥品的價格太高,也影響了質量的可靠性。
2 “兩票制”對藥品流通行業的影響
“兩票制”主要發生在藥品流通領域,在流通的過程中,需要開兩次發票,一次是藥品生產企業向流通企業開票,另一次是流通企業向醫療機構開票。“兩票制”對出廠價高的企業沒有太大影響,對于出廠價很低的企業影響卻很大。從宏觀上來看,“兩票制”主要作用在于減少藥品流通的中間環節,使流通秩序趨于穩定發展。要使藥品轉手的次數減少,就需要對購銷過程進行監測,主要依據就是兩票。對市場中的“走票”行為進行嚴厲打擊,確保流通過程的簡潔化、透明化與正規化,有利于藥品行業的健康發展。
2.1 “兩票制”對藥品生產企業的影響
很多的中小型制藥企業能力(人才、資金、渠道、政府關系等)非常有限,難以在短期內回籠資金,不能采用“直營辦事處模式”,只能采取“底價招商代理模式”[9]。“兩票制”出現后,不僅提高了生產商的財務管理能力、營銷能力等,還增加了經銷商的數量。代理商減少,就會影響到銷售的業績,只能與下游分銷商進行合作。分銷商的數量增加,同時還需要更多的財務人員進行管理,從而增加了運營的成本。另外,由于沒有代理商墊付資金,同時由于一些公立醫療機構的匯款速度很慢,容易造成死賬、呆賬的出現,成本的提高以及資金回籠問題會提高生產商的競爭力與創新水平。
2.2 “兩票制”對藥品流通企業的影響
受監管新政的影響,大型藥品流通企業將越來越大,越來越強。受此影響,“兩票制”將會給企業的發展帶來一定的難度[10]。特別是中小藥品企業,他們要么進行轉型和重組,要么進行兼并或者退市。物流企業也有可能被第三方兼并。具有終端資源的企業也可以選擇集中化經營方案,由生產型向銷售型轉化。合同銷售組織的主體是產品銷售服務外包公司,它們可以接受生產企業管理,主要從事銷售的外部服務,為客戶提供全面的銷售服務,可以提供專業的銷售服務,不僅是產品策劃和渠道設計,還可以在市場調研和市場推廣方面提供相應服務。
3 歐盟藥品流通監管經驗
歐盟藥品流通監管制度分成3個層級來進行管理,分別是法律、指令和指南[11-14]。①法律層級是指Regulation(EC)No.726/2004,它規定了對歐盟境內所有藥品進行監督管理的部門,即:歐洲藥品局(EMA),負責對藥品流通進行監管,它制定了關于藥品流通管理的很多法律法規。②指令層級主要是Directive2001/83/EC,是歐洲關于人用藥品最完整的指令,歐盟所有國家的用藥監管法律都是根據它制定的。在人用藥品方面,無論是歐盟境內的藥物批發,還是代理、價格和責任都要受到該指令的影響,該指令對歐盟境內人用藥的批發和代理行為進行監管。③指南層級指的是《藥品流通質量管理規范指南》(GDP),該指南中對藥物流通的管理規定不僅包括人員資質與外包活動,還包含了質量管理與文件管理,不管是代理商還是藥品流通商,都必須遵守這個指南。
3.1 代理及代理商的內涵
從級別和地位上來看,歐盟的藥品流通監管體系中的代理商與批發分銷商是一致的。Directive2001/83/EC對“批發分銷”也進行了規定,認為它們是將醫藥產品提供給市場,活動類型不僅包含藥品的采購與供應,還包含了藥品的儲存與出口等活動。參與整個流程的不僅有藥品制造商、進口商及藥劑師,還包含了倉儲商與批發分銷商等,他們獲得授權后就可以向市場推銷藥品。“藥品代理”跟實物的處理無關,他們只負責開展一些與藥品的銷售或者購買相關的活動,這些活動不包括批發和分銷活動。“代理商”擁有獨立談判資格,他們能夠代表另一法人進行購銷活動,也不參與實物的處理工作,他們所參與的購銷活動與分銷的藥品無關。
3.2 代理商的特殊規定
Directive2001/83/EC對代理商也有嚴格的要求:首先,藥品代理商要確定相關藥品符合上市的規定,這些規定包含了歐盟委員會第726/2004號法規對于藥品的規定,以及各成員國對于產品的批準。代理商在歐盟登記的聯系方式與地址是固定的,從而保證了當局的監督、定位與識別活動。其次,代理商的固定地址也需要向當局進行注冊,注冊的內容不僅包括公司名稱和注冊人的姓名,還包含固定地址。如果信息發生更改,需要向當局提出更改申請,當局同意后才可以進行。然后,代理商注冊所在成員國主管當局有責任對他們進行監督和管理,當代理商違反規定時,可以取消代理商的資格。
3.3 代理商注冊、變更流程
比如英國的代理商在申請的過程中,提出申請的部門是英國藥品及健康產品管理局(Medicines and Healthcare Products Regulatory Agency,MHRA),如果代理商有意拓展業務,也需要進行申請。代理商在提出申請的90天以內,MHRA會做出批復,代理商在進行資格審查、面試等一系列檢查后,如果合格才可以被批準并公示。公示期無異議后代理商才有權在歐洲經濟區范圍內進行代理活動。代理商變更信息所需要的時間為30天,也需要申請并審核通過才可以進行,同時注冊也是需要收費的,費用的多少與提交注冊申請時涉及的場地數量有關。
4 加強“兩票制”下藥品流通監管的建議
4.1 厘清代理商與經銷商的概念,允許合法代理行為的存在
在普通商品的流通過程中,經銷商也是一個單獨的經營機構,它們盈利的主要方式是通過營銷賺取差價;代理商相當于中介,他們首先獲得其它企業的代理權,與下一級分銷商或者消費者達成交易,從中賺取服務費用。歐盟藥品流通法律對這兩種經營機構的權限進行了詳細的規定,但是我國的法律卻沒有進行區分,代理商的范圍沒有明確的界定。與傳統的“底價招商”的模式相比,真正的代理商需要從委托企業處賺取傭金。所以傳統的“代理商”的利潤是進銷差價,二者的收入來源存在著不同。所以,國內的一些企業會冒充“代理商”進行商業活動,從法律角度來看,這種做法是違法行為。還有一些從事商業活動的“合同銷售組織”,他們也是“代理商”的一種,只是名稱有所變化,在本質上存在著一致性。代理商與經銷商之間不僅概念區分不清,而且經營活動相互交叉,使我國的藥品流通行業不能健康發展。但是,從整體上來看,我國藥品代理活動還是健康的,只是部分代理商與經銷商在渾水摸魚。為此,本文建議要厘清代理商與經銷商的概念,允許合法代理行為的存在,本研究基于文獻和經驗總結,認為代理商和經銷商的區別見表1。
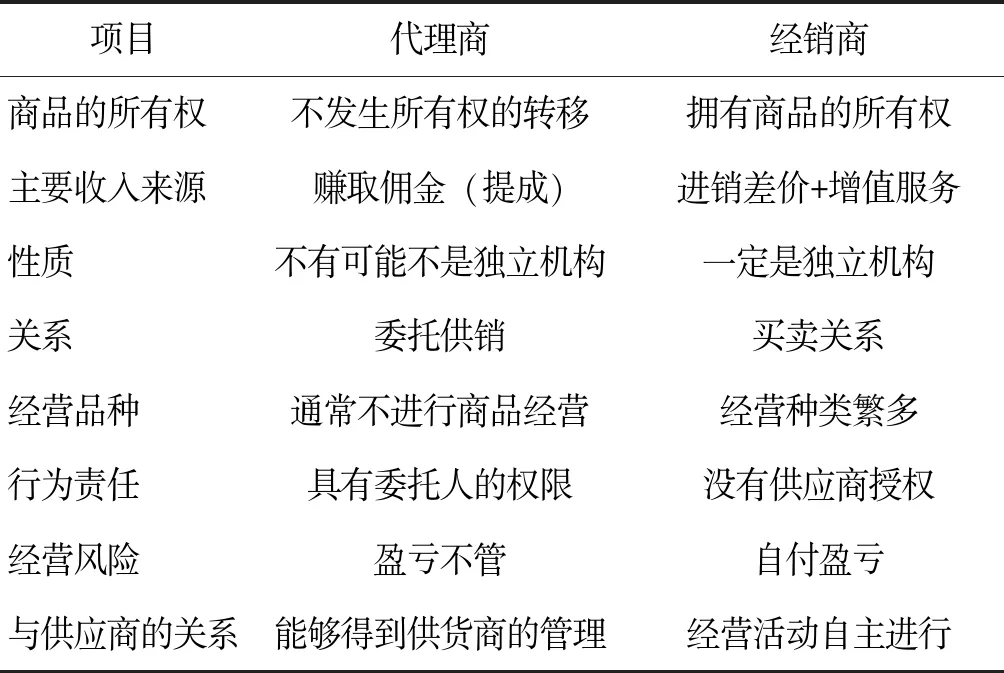
表1 代理商與經銷商的區別
4.2 加強中小流通企業轉型合同銷售組織的監管
隨著我國醫藥行業的發展,醫藥外包產業專業化程度越來越高,逐步向全球發展。據報道,全球2009年藥品外包的總產值為27億美元,截至2015年,藥品銷售外包的總產值已經達到了56億美元[15]。國外與合同銷售組織(CSO)簽約的藥企的數量越來越大。雖然當前國際采用了“營改增”與“兩票制”來對市場進行規范,然而很多企業為了洗錢,運用CSO模式來對票據作假,以達到偷稅漏稅的目的,服務水平較低,做出了違反法律的行為,影響了國際藥品行業的健康發展。政府加強中小流通企業轉型合同銷售組織的監管,使企業不能將CSO模式當做規避“兩票制”和“營改增”的手段,而應穩扎穩打,堅持費用合理、票據合格、交付物合約、協議合法,促進藥品流通領域的健康發展。
4.3 完善藥品管理法,將第三方醫藥物流主體納入監管范圍
上市許可持有人制度已經在藥品行業實施,并且專業性越來越強,分工也逐步走向精細化深入。傳統的藥品流通模式已經不符合時代的需要,于是一種新興的市場主體出現了,它就是第三方醫藥物流。同時,國家也制定了關于藥品流通的法律,目的是為了保障這個領域的健康發展。借鑒歐盟管理制度的經驗,我國也應完善藥品管理法,將合同銷售組織(或代理商)等第三方醫藥物流主體納入監管范圍,盡快完善合同銷售組織(或代理商)注冊、審批、監管等配套制度,出臺注冊標準、發證機構的職權范圍,批準或不批準的程序,中止、信息變更、除名的程序,違法行為及處罰細則等。

