大腸桿菌磷酸烯醇式丙酮酸羧化酶的克隆和表達
何曉亮 李竹 梁立強 孟萬利
摘要:為了更好地研究磷酸烯醇式丙酮酸羧化酶的結構和功能,采用PCR(聚合酶鏈式反應)、雙酶切和細胞轉化等基因工程方法對磷酸烯醇式丙酮酸羧化酶基因進行克隆并使用SDS-聚丙烯酰胺凝膠電泳進行表達分析,擴增出一個新的大腸桿菌磷酸烯醇式丙酮酸羧化酶基因,將其基因克隆到原核表達載體pET-30a上,并導入到大腸桿菌表達菌株BL21(DE3)中。通過IPTG誘導成功表達出大腸桿菌的磷酸烯醇式丙酮酸羧化酶。所提出的方法能夠高效表達磷酸烯醇式丙酮酸羧化酶,為進一步大規模表達純化和應用提供參考。
關鍵詞:基因工程;大腸桿菌;磷酸烯醇式丙酮酸羧化酶;基因表達;二氧化碳
中圖分類號:Q812文獻標志碼:A
Abstract:In order to better study the structure and function of phosphoenolpyruvate carboxylase, the phosphoenolpyruvate carboxylase gene is cloned and expressed by PCR (polymerase chain reaction), double enzyme digestion and cell transformation. The results show that the new phosphoenolpyruvate carboxylase gene of Escherichia coli is successfully amplified and cloned into the prokaryotic expression vector pET-30a, and then introduced into Escherichia coli BL21 expression system. The phosphoenolpyruvate carboxylase of Escherichia coli is successfully induced by IPTG. The phosphoenolpyruvate carboxylase can be efficiently expressed by using the proposed method, which provides preparation for further scale expression, purification and application.
Keywords:genetic engineering; Escherichia coli; phosphoenolpyruvate carboxykinase; protein expression; CO2
磷酸烯醇式丙酮酸羧化酶(PEPC)是一種存在于磷酸烯醇式丙酮酸和二氧化碳反應生成草酰乙酸過程中的催化酶[1-3]。PEPC酶在Mg2+和HCO-3存在的情況下催化磷酸烯醇式丙酮酸(PEP)不可逆的β-羧化生成草酰乙酸(OAA)和無機磷酸(Pi)[4-5]。
磷酸烯醇式丙酮酸羧化酶廣泛存在于植物和細菌中,而動物和絲狀霉菌中缺少這種酶。磷酸烯醇式丙酮酸羧化酶屬于變構酶,主要功能為三羧酸循環提供草酰乙酸,另外也與C4植物光合二氧化碳固定反應(C4二羧酸循環)及景天科植物的蘋果酸形成(景天酸代謝)等有關[6]。非光合型PEPC酶參與四碳酸的回補代謝途徑[7]。植物PEPC的生理作用還包括:種子萌發和形成[8]、調節保衛細胞[9]、促進蘋果酸的合成為固氮根瘤菌提供呼吸基質[10],并且在植物抗生物和非生物脅迫中有重要作用[11]。
此外,PEPC酶參與NADPH代謝、C-N的交互反應、CO2的重吸收、蘋果酸發酵和pH調節等眾多重要的生理過程[12]。磷酸烯醇式丙酮酸羧化酶分子的二級結構主要以β桶型結構、α螺旋為主,還有少量的β鏈[13-14]。它的4個亞基是以同構方式結合,其四級結構屬于D2對稱性,在空間上可能排列成擬四面體[15]。通常植物PEPC的氨基酸序列具有高度的保守型[16],殘基數一般為960~970[17],在N末端附近有磷酸化位點(E/DR/KxxSIDAQL/MR)是植物特有的結構[18]。位于C端的963QNTG966基序與PEPC催化活性有關[19]。
為了更好地研究PEPC酶的結構和功能的特征,本研究克隆了大腸桿菌的PEPC基因的序列并進行了誘導表達,旨在為PEPC酶結構和功能的研究提供一定的信息。
1材料與方法
1.1材料
原核表達載體pET-30a由河北科技大學周曉輝教授饋贈,大腸桿菌JM109,DH5α,BL21(DE3)購自北京天根生物科技有限公司。
1.2方法
1.2.1PCR擴增
大腸桿菌JM109基因組DNA提取的方法按照細菌基因組DNA提取試劑盒的說明書(北京天根)進行。按照從National Center for Biotechnology Information (NCBI)上檢索到的大腸桿菌pepc基因序列的ORF使用Prime primer 5.0設計上、下游引物,分別加入Bam HI(GGATCC)和Hind III(AAGCTT)限制性內切酶的酶切位點,引物由上海英濰捷基公司合成,具體序列如下:
上游引物:5-CGCGGATCCATGCGCGTTAACAATGGTTTGAC-3。
下游引物:5-GGCAAGCTTTTACAGTTTCGGACCAGCCGCTAC-3。
以大腸桿菌基因組DNA為模板在Gene Amp PCR system 9700進行PCR 反應擴增pepc基因序列,PCR 反應條件:94 ℃ 5 min;94 ℃ 45 s,60 ℃ 45 s,72 ℃ 2 min,循環35 次;72 ℃延伸10 min。PCR產物經1%的瓊脂糖凝膠電泳檢測確認后使用膠回收試劑盒(北京全式金)回收,送交測序公司(上海英濰捷基)測序[20]。
1.2.2重組表達載體pET-30a-pepc的構建
pET-30a質粒的提取按照質粒提取試劑盒(GenStar BioSolutions)的說明書進行。質粒提取完畢之后,進行瓊脂糖凝膠電泳檢測。pepc基因擴增產物的回收產物和pET-30a質粒分別用Bam HI和Hind III(TAKARA)進行雙酶切,pET-30a質粒經雙酶切后要用去磷酸化酶(New England Biolabs)處理,酶切反應和去磷酸化反應后均用膠回收試劑盒(北京全式金)進行回收。經過雙酶切處理的基因和載體,用T4DNA連接酶(TAKARA)連接。連接好的重組體使用熱激的方法轉入大腸桿菌DH5α,利用PCR技術和雙酶切技術進行驗證,進而將驗證正確的送交測序公司(上海英濰捷基)測序進行鑒定。
1.2.3PEPC酶的表達
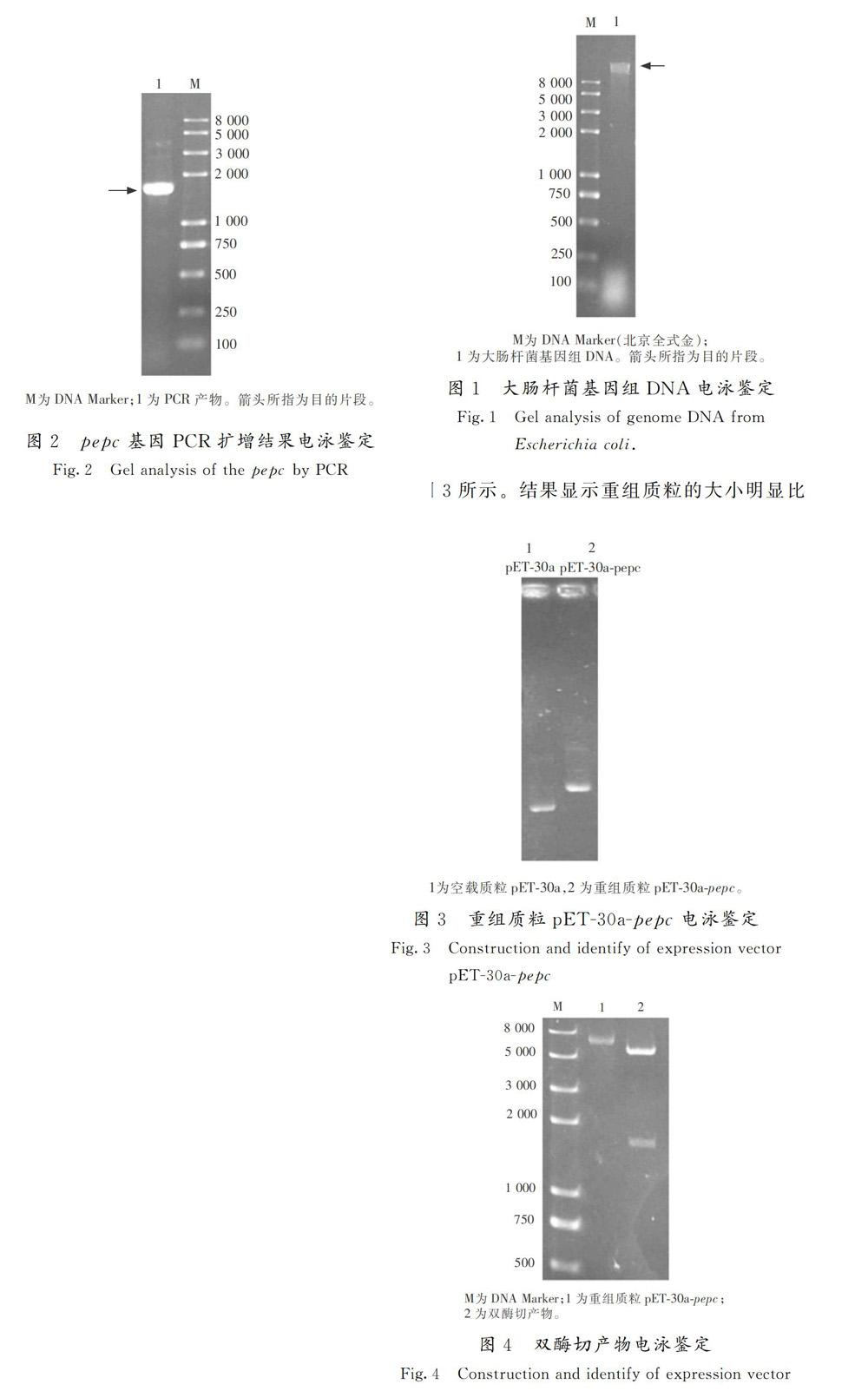
將測序成功的重組質粒轉化到大腸桿菌BL21(DE3)中,獲得pET-30a-pepc-BL21重組菌株。將過夜培養的pET-30a-pepc-BL21菌液,按2%接種量,依次轉接于9瓶50 mL的LB(100 μg/mL Kan)液體培養基中,160 r/min,37 ℃培養。至OD600 nm為0.4~0.6,加入終濃度依次為0,0.01,0.5 mmol/L的IPTG誘導劑,37 ℃時誘圖1大腸桿菌基因組DNA電泳鑒定
Fig1Gel analysis of genome DNA from
Escherichia coli.導3~4 h,OD600 nm值到2.0左右。8 000 r/min,4 ℃離心15 min。用細胞懸浮液重新懸浮上述離心后的菌體沉淀,加入終濃度為0.1 mmol/L PMSF和一片蛋白酶抑制劑。使用超聲波細胞破碎機(寧波新芝)進行細胞破碎(破碎10 min,其中工作3 s間隔5 s),進而用超速冷凍離心機(Beckman Coulter)14 000 r/min,4 ℃離心30 min,取上清液。分別取各組的上清液,制備樣品,用SDS-PAGE鑒定蛋白的表達情況。
2結果與分析
2.1大腸桿菌pepc基因的克隆
2.1.1大腸桿菌基因組DNA的提取
按照細菌基因組DNA提取試劑盒所提供的提取方法提取大腸桿菌JM109的基因組DNA,并用瓊脂糖凝膠電泳檢測提取結果,如圖1所示。結果顯示出現了目的條帶,且該條帶的大小比DNA Marker的最大條帶要大得多,說明基因組提取成功。
2.1.2pepc基因的PCR擴增
以大腸桿菌基因組DNA為模板,利用上、下游引物克隆pepc基因,用瓊脂糖凝膠電泳檢測PCR產物,結果顯示在1 600 bp左右出現了條帶,并且條帶單一,大小與理論值相符,結果見圖2所示,說明引物設計正確,目的基因擴增成功。
2.1.3重組表達載體pET-30a-pepc
將pepc基因和pET-30a質粒分別經Bam HI和Hind III酶切,然后在T4 DNA連接酶的作用下,將酶切產物連接成為重組質粒pET-30a-pepc,用瓊脂糖凝膠電泳檢測連接結果,如圖3所示。結果顯示重組質粒的大小明顯比空載的pET-30a大,說明目的基因成功連接到載體pET-30a上。
2.1.4雙酶切驗證
提取重組質粒pET-30a-pepc,并將質粒進行雙酶切驗證,結果為酶切后的混合物內含有與目的基因大小一致的片段,表明pepc基因成功插入pET-30a質粒,電泳結果與預期結果相符,如圖4所示。
2.1.5重組質粒的測序驗證
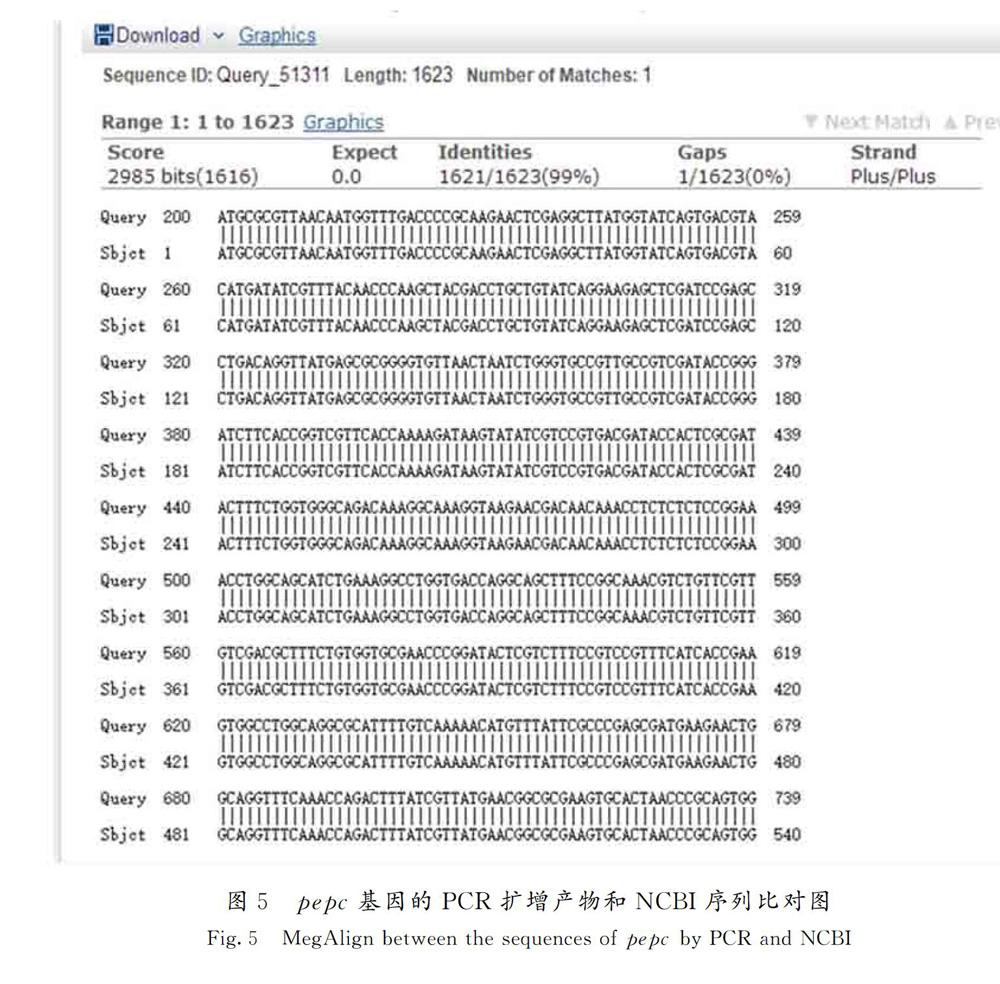
將雙酶切驗證正確的質粒,送交測序公司測定堿基序列,并與NCBI上的pepc基因的測序結果比對,其比對結果為99%,如圖 5所示,即重組質粒構建成功,該基因編碼完整的磷酸烯醇式丙酮酸羧化酶。
2.2重組表達載體pET-30a-pepc在大腸桿菌中的表達
用15%的SDS-PAGE驗證表達結果。由圖6可知,在66.2 kDa附件出現一條明顯的條帶,與理論值66 kDa相符,說明該蛋白能夠單獨表達,IPTG濃度高蛋白表達量也高。
3結論
1) 利用基因工程的技術和方法成功克隆到新的大腸桿菌磷酸烯醇式丙酮酸羧化酶,并且成功構建了表達菌株。接種量的多少直接影響菌種的生長情況,通過對表達菌株的生長曲線進行測定,經過優化確定了2%的接種量最合適,為大規模的培養磷酸烯醇式丙酮酸羧化酶的基因工程菌株提供了數據參考。
2) IPTG的濃度對基因的表達效果和蛋白質的最終濃度,通過添加不同濃度的IPTG,確定了最佳誘導濃度。
3) 建立的方法確實能夠高效表達磷酸烯醇式丙酮酸羧化酶,如何更大規模地表達該酶是今后需要進一步關注的重點。
參考文獻/References:
[1]GOWIK U, WESTHOFF P. C4-phosphoenolpyruvate Carboxylase[M].Netherlands:Springer, 2011:257-275.
[2]CHRISTIN P A, PETITPIERRE B, SALAMIN N, et al. Evolution of C4 phosphoenolpyruvate carboxykinase in grasses, from genotype to phenotype[J]. Molecular Biology and Evolution, 2009, 26(2): 357-365.
[3]GEHRIG H, TAYBI T, KLUGE M, et al. Identification of multiple PEPC isogenes in leaves of the facultative crassulacean acid metabolism(CAM) plant Kalanchoe blossfeldiana Poelln. cv. Tom Thumb[J]. FEBS Letters, 1995, 377(3):399-402.
[4]UHRIG R G, OLEARY B, SPANG H E, et al. Coimmunopurification of phosphorylated bacterial-and plant-type phosphoenolpyruvate carboxylases with the plastidial pyruvate dehydrogenase complex from developing castor oil seeds[J]. Plant Physiology, 2008, 146(3):1346-1357.
[5]OLEARY B, RAO S K, KIM J, et al. Bacterial-type phosphoenolpyruvate carboxylase(PEPC)functions as a catalytic and regulatory subunit of the novel class-2 PEPC complex of vascular plants[J]. Journal of Biological Chemistry, 2009, 284(37):24797-24805.
[6]IZUI K, MATSUMURA H, FURUMOTO T, et al. Phosphoenolpyruvate carboxylase:A new era of structural biology[J]. Annu Rev Plant Biol, 2004, 55:69-84.
[7]NUNES-NESI A, FERNIE A R, STITT M. Metabolic and signaling aspects underpinning the regulation of plant carbon nitrogeninteractions[J]. Molecular Plant, 2010, 3(6):973-996.
[8]OLEARY B, FEDOSEJEVS E T, HILL A T, et al. Tissue- specific expression and post- translational modifications of plant- and bacterial- type phosphoenolpyruvate carboxylase isozymes of the castor oil plant, Ricinus communis L [J]. Journal of Experimental Botany, 2011, 62(15): 5485-5495.
[9]COUSINS A B, BAROLI I, BADGER M R, et al. The role of phosphoenolpyruvate carboxylase during C4 photosynthetic isotope exchange and stomatal conductance [J]. Plant Physiology, 2007, 145(3): 1006- 1017.
[10]NOMURA M, MAI H T, FUJII M, et al. Phosphoenolpyruvate carboxylase plays a crucial role in limiting nitrogen fixation in Lotus japonicus nodules [J]. Plant & Cell Physiology, 2006, 47(5): 613- 621.
[11]CHENG G, WANG L, LAN H. Cloning of PEPC-1 from a C4 halophyte Suaeda aralocaspica without Kranz anatomy and its recombinant enzymatic activity in responses to abiotic stresses [J]. Enzyme and Microbial Technology, 2016(83): 57- 67.
[12]BRENDAN O L, JOONHO P, WILLIAM C P. The remarkable diversity of plant PEPC(phosphoenolpyruvate carboxylase):Recent insightsinto the physiological functions and post-translational controls ofnon-photosynthetic PEPCs[J]. Biochemical Journal, 2011, 436(1):15-34.
[13]MATSUMURA H X Y, SHIRAKATA S. Crystal structures of C4 form maize and auaternary complex of E. coli phosphoenolpyruvate carboxylases[J]. Structure, 2002, 10(12): 1721- 1730.
[14]王岳坤,陽江華. 橡膠樹磷酸烯醇式丙酮酸羧化酶基因Hb PPC1 的克隆和表達分析[J]. 熱帶作物學報,2015,36(5):895-900.
WANG Yuekun, YANG Jianghua. Cloning and expression analysis of phosphoenolpyruvate carboxylase gene Hb PPC1 from hevea brasiliensis[J]. Chinese Journal of Tropical Crops,2015,36(5):895-900.
[15]魏紹巍, 黎茵. 植物磷酸烯醇式丙酮酸羧化酶的功能及其在基因工程中的應用[J]. 生物工程學報, 2011, 27(12): 1702-1710.
WEI Shaowei, LI Yin. Functions of plant phosphoenolpyruvate carboxylase and its applications for genetic engineering[J]. Chin J Biotech, 2011, 27(12): 1702-1710.
[16]KAI Y M H, INOUE T, TERADA K,et al. Three dimensional structure of phosphoenolpyruvate carboxylase: A proposed mechanism for the allosteric inhibition[J]. Pro Natl Acad Sci,1999(96): 823- 828.
[17]SHYLAJANACIYAR M, DINESHBABU G, RAJALAKSHMI R, et al. Analysis and elucidation of phosphoenolpyruvate carboxylase in cyanobacteria [J]. The Protein Journal, 2015, 34(1): 73- 81.
[18]RUIZ-BALLESTA I, FERIA A B, NI H, et al. In vivo monoubiquitination of anaplerotic phosphoenolpyruvate carboxylase occurs at Lys624 in germinating sorghum seeds [J]. Journal of Experimental Botany, 2014, 65 (2): 443- 451.
[19]ALVAREZ R, GARCA-MAURI O S, FERIA A B, et al. A conserved 19-amino acid synthetic peptide from the carboxy terminus of phosphoenolpyruvate carboxylase inhibits the in vitro phosphorylation of the enzyme by the calcium-independent phosphoenolpyruvate carboxylase kinase [J]. Plant Physiology,2003, 132(2): 1097- 1106.
[20]HE X, ZHOU X, YANG Z, et al. Cloning, expression and purification of d-tagatose 3-epimerase gene from Escherichia coli JM109[J]. Protein Expression & Purification, 2015, 114(2):77-81.第40卷第2期河北科技大學學報Vol.40,No.2

