辣椒疫病病原菌的分離與鑒定
付靜 陳建中 付偉等
摘要 [目的]明確發生在邯鄲地區大名縣辣椒大棚中的疫病病原菌。[方法]從辣椒大棚里采集辣椒疫病病樣,對病原菌進行分離與純化,并通過形態學觀察、ITS序列分析及致病力測定,對病原菌進行鑒定。[結果]辣椒疫病病原菌為辣椒疫霉(Phytophthora capsici)。[結論]該研究為當地辣椒疫病防治提供科學的理論依據。
關鍵詞 辣椒;疫病;病原菌;分離;鑒定;辣椒疫霉
中圖分類號 S436.418.1文獻標識碼 A
文章編號 0517-6611(2019)04-0150-03
Abstract [Objective] The research aimed to identify the pathogen of pepper blight from Daming County of Handan area.[Method] Pepper disease samples were collected from greenhouses and the pathogen was isolated and purified.The pathogen of pepper blight was identified by comprehensive morphological characteristics,ITS DNA sequences analysis and pathogenicity test.[Result] The pathogen of pepper blight in Handan area was Phytophthora capsici.[Conclusion] The study provides a scientific theoretical basis for the prevention and control of local pepper blight.
Key words Pepper;Blight;Pathogen;Isolation;Identification;Phytophthora capsici
辣椒疫病是辣椒生產上的重要病害,目前已廣泛分布于我國的辣椒種植區。辣椒在苗期、成株期都可感染疫病,而且在田間擴展迅速,常造成辣椒生產的毀滅性破壞[1]。辣椒疫病的病原為辣椒疫霉菌(Phytophthora capsici Leonian),屬于藻界卵菌門疫霉屬,其寄主范圍較廣,可引起多種重要作物病害[2]。辣椒疫霉菌以卵孢子在土壤中越冬,環境適宜時卵孢子萌發產生游動孢子侵入寄主,經風、雨、水等傳播,進行初侵染和再侵染[3]。為了明確邯鄲地區辣椒疫病病原菌的分類特征及為害特點,有效地控制辣椒生產中疫病的發生危害,筆者對邯鄲大名縣大棚辣椒疫病的病原菌進行分離和鑒定。
1 材料與方法
1.1 試驗材料 辣椒疫病病樣采自河北省邯鄲地區大名縣大棚栽培辣椒的根。病原菌的致病力測定中供試辣椒品種為“瑞豐”“長健”“瑞朗”“尖椒1號”和“133”,采用常規育苗,長至1片真葉時選擇大小一致的健壯辣椒苗,移栽于盛有適量營養土的盆中,日光溫室內常規管理。選擇8葉期長勢一致的健康植株用做致病力測定。
1.2 試驗方法
1.2.1 病原菌的分離和純化。
病原菌的分離采用組織分離法[4],將辣椒疫病病株根部的外表皮除去,取內部組織的病健交界處5 mm左右小塊,在75%乙醇中浸漬30 s,再用0.1%升汞水溶液處理4 min,然后用無菌水清洗3次,置于選擇性燕麥培養基平板上(含青霉素50 mg、五氯硝基苯50 mg、鏈霉素30 mg),25 ℃恒溫培養。
將長出的菌絲轉接到10% V8培養基上培養至菌絲長滿平板后,向平板中倒入滅菌的自來水沖洗一遍,去除菌絲表面的營養物質,再加入滅菌的自來水至剛剛淹過菌絲面。置于日光燈下連續照光,經過48 h,菌落表面可產生大量孢子囊。加入少量滅菌自來水至產生大量孢子囊的培養基平板中,4 ℃冰箱放置10 min后,取出室溫下放置30 min,刺激游動孢子的釋放[5]。調節孢子懸浮液濃度到4×10倍顯微鏡下每視野1個孢子左右,用移液槍吸取孢子懸浮液50 μL在水瓊脂平板上涂布均勻,12 h后低倍鏡下檢查、標記單個孢子的位置,用移植鏟切取、移植含有單孢子的水瓊脂塊,轉至10% V8培養基上培養,獲得純培養[6]。
1.2.2 病原菌的形態學鑒定。
在光學顯微鏡下觀察病原菌菌絲隔膜的有無、孢子囊和游動孢子的形態特征。將病原菌接種到燕麥、玉米粉、10%V8、PDA培養基上,25 ℃培養3 d后,用直徑6 mm打孔器沿菌落邊緣打取菌餅,移至4種培養基平板中央,分別轉接4皿,置于25 ℃培養。每隔24 h用十字交叉法測量菌落直徑,4 d后觀察病原菌在不同培養基上的菌落形態。
1.2.3 病原菌的分子生物學鑒定。
將純化的病原菌接種到PDA培養基上,待其長出菌絲后,挑取0.1 g菌絲于1.5 mL 的離心管中,加液氮研磨至粉末。采用CTAB法提取DNA[7]。用真菌ITS區通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)對提取物進行PCR擴增。25 μL PCR 反應體系包括10×PCR buffer(Mg2+ plus)2.5 μL,dNTP Mixture(各2.5 mmol/L)0.5 μL,模板DNA 1.0 μL,5 U/μL TaqDNA聚合酶0.3 μL,ITS1 和ITS4 引物(10 μmol/L)各1.0 μL,加ddH2O定容至25 μL。反應程序為:95 ℃預變性3 min;95 ℃變性30 s,53 ℃退火30 s,72 ℃延伸1 min,35 個循環;最后72 ℃延伸10 min。用1.5%的瓊脂糖凝膠電泳檢測PCR產物,測序由北京擎科新業生物技術有限公司完成。將測序結果與GenBank數據庫中的已知序列進行Blast對比分析,取相似性最高的序列和測定序列在ClustalX程序中進行完全比對。然后利用Mega 4.0軟件以鄰位相連(Neighbor-joining,NJ)算法構建系統發育樹[8]。
1.2.4 病原菌的致病力測定。
采用活體刺莖接種[9],將在PDA平板上25 ℃條件下培養7 d的辣椒疫霉菌菌株沿菌落邊緣打成直徑為6 mm的菌餅。用滅菌的解剖針刺傷供試辣椒(8葉期)的莖稈,然后將菌餅挑貼于傷口處,菌絲一面貼近傷口,用脫脂棉蘸水保濕24 h,24 h 后除去滅菌棉,以空白培養基塊接種作為對照。每處理重復10次,接種后的辣椒置于人工氣候培養箱內,25 ℃保濕培養,24 h 后開始測量病斑長度,每12 h 測量1 次,根據病斑長度評價各菌株致病力的差異。
2 結果與分析
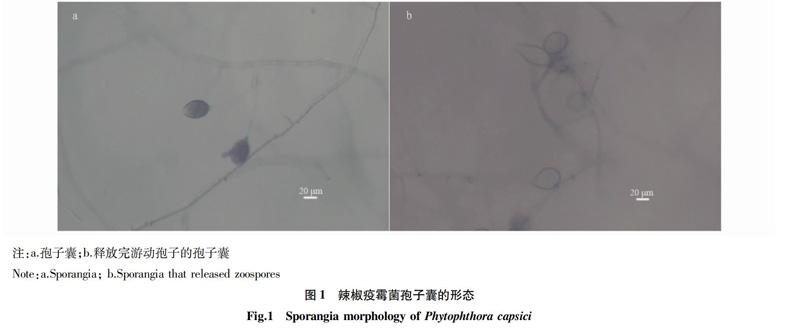
2.1 病原菌的分離純化 從辣椒疫病病樣中分離的病組織塊上均長出白色絨毛狀的菌落,初步鑒定為同一菌株。將分離出的病原菌轉接到10% V8培養基上,經過培養誘導,在顯微鏡下觀察到了大量的孢子囊,對孢子囊進行刺激,釋放出大量游動孢子。將孢子涂布在WA培養基上培養,共挑取出3個單孢子,將菌株保存到PDA斜面培養基并命名為Bz。
2.2 病原菌的形態特征
經顯微鏡觀察,病原菌菌絲無隔膜,孢囊梗分枝不規則;孢子囊形狀長橢圓形、卵圓形,大多數有1個乳突,大小為 (36.403~86.594) μm × (19.794~41.247) μm,長寬比為1.009~2.702(圖1)。游動孢子腎形,帶有鞭毛,游動孢子游動一段時間后停止游動。初步確定其為辣椒疫霉。
從圖2可看出,病原菌在4種培養基上的培養性狀不同。在燕麥培養基上的菌落呈圓形,絨毛狀,氣生菌絲很少,菌絲疏松、色白;在玉米粉培養基上的菌落接近圓形,棉絮狀,氣生菌絲較多,菌絲濃密、較厚,色白;在10%V8培養基上呈放射狀生長,菌落圓形、氣生菌絲很少,菌絲較疏松,色較淺;而在PDA培養基上的菌落呈圓形,花瓣狀,氣生菌絲較少,菌絲較濃密、較厚,色白。
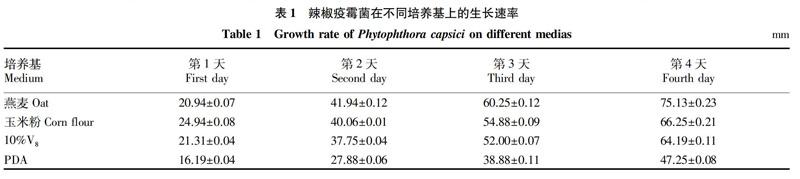
從表1可看出,病原菌在4種培養基上的生長速率各不相同。病原菌在燕麥培養基上的生長最快,在玉米粉和10%V8培養基上的生長較快,在PDA培養基上的生長最慢。
2.3 病原菌的分子生物學鑒定
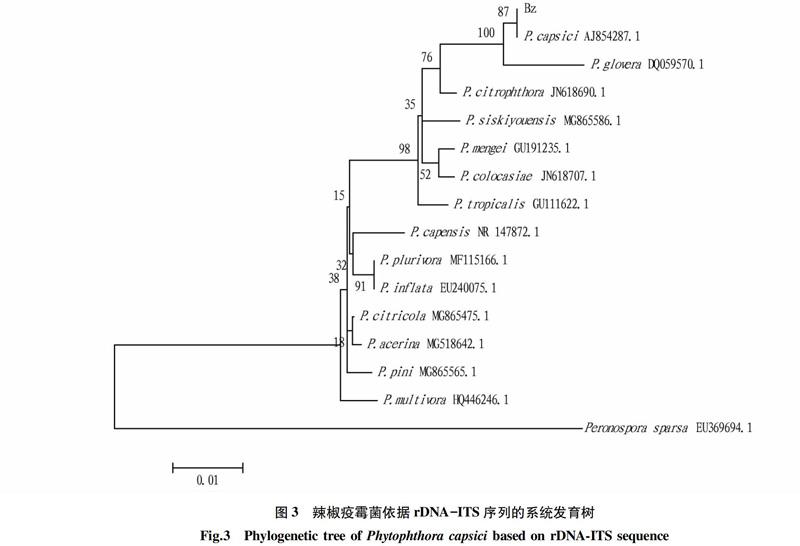
以提取的辣椒疫霉菌株Bz的DNA為模板,使用通用引物ITS1和ITS4進行擴增,并對擴增產物進行序列測定,獲得長度為792 bp的特異性片段。將該片段序列在GenBank數據庫中進行Blast比對,結果顯示,該序列與已報道的辣椒疫霉菌(登錄號:AJ854287.1)的序列相似性達99%。從GenBank數據庫中選取代表疫霉屬不同種的ITS序列,以Peronospora sparsa作為外群構建系統發育樹,由圖3聚類分析結果可知,菌株Bz與辣椒疫霉菌的rDNA-ITS聚在一起,而外群菌株Peronospora sparsa則以較遠的親緣關系處在系統發育樹的外圍。結合菌株的形態特征和培養性狀,鑒定Bz為辣椒疫霉菌(Phytophthora capsici)。
2.4 病原菌的致病力測定
用辣椒疫霉菌株Bz接種5個辣椒品種的莖稈,在自然條件下培養3 d后,辣椒莖稈均出現褐色病斑,而對照未發病。菌株Bz對5個辣椒品種的致病力沒有顯著性差異,且致病力均強于標準菌株CT(表2)。之后病斑不斷擴大導致病株萎蔫,癥狀與大棚自然發病癥狀一致。從接種的病組織中分離的病原菌與從大棚發病植株分離的病原菌形態一致,證明該致病菌為辣椒疫病的病原菌。
3 結論與討論
該研究通過形態學和分子生物學鑒定方法,確定了發生在邯鄲地區大名縣辣椒大棚中的疫病病原菌為辣椒疫霉(Phytophthora capsici),通過致病力測定發現該病原菌可以侵染健康辣椒并導致辣椒疫病的發生。
發現辣椒疫霉菌在玉米粉和燕麥培養基上生長最佳;張世才等[11]發現辣椒疫霉菌在燕麥培養基上生長速度最快,但在V8培養基上產孢最多。該研究結果表明,辣椒疫霉菌在燕麥培養基上的生長最快,在10%V8培養基上產生大量孢子囊和游動孢子,這與前人的研究結果一致。傳統疫霉屬卵菌的鑒定主要依據其形態特征,但難于區分形態相似的種。研究發現,rDNA-ITS序列在疫霉屬種內不同菌株間高度保守,而種間序列變異豐富,為卵菌的分類鑒定提供豐富的遺傳信息[12]。因此,該研究根據形態學特征和ITS序列分析明確了邯鄲大名縣辣椒疫病的病原分類地位,為辣椒疫病的防治提供理論依據。該研究采用活體刺莖接種法進行致病力測定,結果表明,所分離的辣椒疫霉菌Bz接種到5個辣椒品種后均引起辣椒發病,顯示菌株Bz為辣椒疫病的病原菌。
參考文獻
[1] 姜國慶,丁和明.辣椒疫病的發生及防治技術[J].湖北植保,2014(1):26,28.
[2] KAMOUN S,FURZER O,JONES J D,et al.The top 10 oomycete pathogens in molecular plant pathology [J].Molecular plant pathology,2015,16(4):413-434.
[3] 曲丹丹,馬莉莉,周海洋.辣椒疫病發病原因及綜合防治措施[J].現代農業科技,2017(18):90,92.
[4] 武玉環,章彥俊,張紅杰,等.辣椒疫霉菌的分離純化及室內藥劑篩選[J].北方園藝,2013(8):138-140.
[5] 鄭小波.疫霉菌及其研究技術[M].北京:中國農業出版社,1997.
[6] 邱小燕,湯智鵬,張敏,等.一種適用于多數植物病原真菌的單孢分離方法[J].安徽農業科學,2011,39(9):5263-5264.
[7] 楊叔青,胡栓紅,楊志剛,等.不同地區辣椒疫霉菌生理小種的鑒定和生物學特性的研究[J].華業農學報,2015,30(2):104-109.
[8] SAITOU N,NEI M.The neighborjoining method:A new method for reconstructing phylogenetic trees[J].Molecular biology and evolution,1987,4(4):406-425.
[9] 李萍,江濤,高智謀,等.辣椒疫霉 (Phytophthora capsici) 對辣椒的致病力分化研究[J].植物病理學報,2012,42(4):431-435.
[10] 徐作珽,李林,魏道君,等.大棚辣椒疫病菌的分離培養及藥劑防治[J].植物保護,1999,25(2):29-31.
[11] 張世才,熊艷,黃任中,等.重慶地區辣椒疫霉菌的分離培養及生理小種鑒定[J].植物保護,2015,41(3):183-187.
[12] 程亮,溫國泉,吳永官,等.廣西南瓜疫病的病原分離與鑒定[J].西南農業學報,2014,27(6):2398-2401.

