桑脈帶相關病毒RTLAMP檢測方法的建立
吳凡 李楊秀 黃海娟 陳保善 蒙姣榮


摘要桑脈帶相關病毒Mulberry vein bandingassociated virus (MVBaV)是廣西桑樹病毒病的主要病原病毒。本研究根據MVBaV基因組的核外殼蛋白(nucleocapsid protein, N)基因序列設計了5組引物,篩選獲得了1組有效引物,建立了該病毒的反轉錄環介導等溫擴增技術(reverse transcription loopmediated isothermal amplification, RTLAMP)檢測方法。該方法能在恒溫條件(63℃)下1 h內檢測MVBaV,其靈敏度是RTPCR檢測方法的10倍。對6個田間樣品進行RTLAMP檢測,其結果與RTPCR的結果一致。該方法可直接在反應管中加入SYBR GreenⅠ,通過顏色變化即可判定結果,無需經過瓊脂糖電泳或專門儀器,具有靈敏、快速和特異性好的優點,可應用于MVBaV 的快速診斷及其田間監測。
關鍵詞桑脈帶相關病毒;反轉錄環介導等溫擴增技術;檢測方法
中圖分類號:S 888.71
文獻標識碼:A
DOI:10.16688/j.zwbh.2018063
桑樹病毒病是桑園常見的一類病害,在廣西桑蠶區發生嚴重,發生率為40%左右,是廣西桑樹的主要病害之一,嚴重影響廣西桑蠶業的發展[12]。桑脈帶相關病毒Mulberry vein bandingassociated virus(MVBaV)是番茄斑萎病毒屬Tospovirus成員,是廣西桑樹病毒病主要病原病毒[34]。病毒檢測在了解病毒分布、病害發生規律及品種抗性評估中均具有重要意義,是病害預防與防治研究的重要基礎[5]。目前尚未有針對MVBaV檢測方法進行系統研究的報道。
植物病原物的檢測方法主要有酶聯免疫吸附法(enzymelinked immunosorbent assay,ELISA)、PCR技術、小RNA深度測序以及環介導等溫擴增技術(loopmediated isothermal amplification, LAMP)等[58]。ELISA檢測需要制備高質量的病毒血清,且檢測時間長,靈敏度低[7]; PCR技術以及小RNA深度測序等具有靈敏度高的優點[67],但是需要購買專門的儀器,且費用昂貴。LAMP技術則可以恒溫條件下對靶基因進行擴增,反應結束后加入熒光染料即可觀察到結果,具有檢測速度快、靈敏度高和無需專業儀器等優點[89]。RTLAMP檢測是在LAMP檢測的基礎上加入反轉錄酶,在同一溫度條件下實現反轉錄及核酸擴增[10]。多數的植物病毒是RNA病毒,RTLAMP已被廣泛應用于植物病毒病的診斷與病毒檢測[1015]。本研究依據MVBaV基因組N基因的序列,設計、篩選該病毒RTLAMP檢測體系的特異引物,評估其特異性及靈敏性,并進行田間樣品檢測應用,以期為桑脈帶病毒病的早期診斷、預測預報及防控決策等提供方便、快捷的檢測技術。
1材料與方法
1.1材料
具有典型脈帶癥狀的桑脈帶病毒病樣品采集于廣西忻城縣并移栽種植于廣西大學桑園, 疑似MVBaV感染樣品及健康桑葉樣品采集自廣西大學桑園;番茄環紋斑點病毒Tomato zonate spot virus (TZSV)侵染的煙草樣品采自廣西靖西煙田、朱頂紅褪綠環斑病毒Hippeastrum chlorotic ringspot virus (HCRV)侵染的水鬼蕉,采自廣西大學校園。以上樣品均經過RTPCR檢測驗證,置于-80℃冰箱保存。攜帶N基因的質粒SXCSY17由亞熱帶農業生物資源保護與利用國家重點實驗室構建并保存[3]。
Loopamp脫氧核糖核酸擴增試劑盒、核糖核酸擴增試劑盒購自榮研生物科技(中國)有限公司。Bst DNA polymerase、硫酸鎂由New England Biolabs公司生產;AMV逆轉錄酶購自Promega公司;RNA提取試劑盒購自天根生化科技(北京)有限公司;SYBR Green Ⅰ (10 000 ×) 購自上海索萊寶生物科技有限公司;一步法 RTPCR Kit購自諾唯贊生物科技有限公司。
1.2方法
1.2.1引物設計
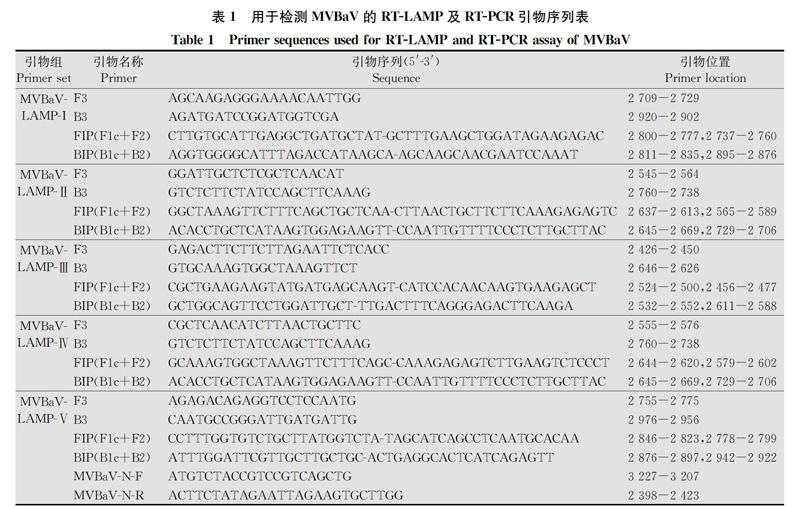
依據MVBaV的N基因序列(KM819701.1)[3],利用LAMP在線引物設計網頁Primer Explorer V4 (http:∥primerexplorer.jp/elamp4.0.0/index.html),設計5組LAMP引物,同時設計一對引物MVBaVNF和MVBaVNR特異擴增N基因,用于MVBaV RTPCR檢測,該引物目的片段大小為800 bp。所有引物序列見表1,由北京奧科鼎盛生物合成。
1.2.2總RNA的提取
參照天根生化科技(北京)有限公司總RNA提取試劑盒說明書分別提取所有植物樣品的總RNA,分別用于MVBaV的RTPCR擴增和RTLAMP檢測。
1.2.3MVBaV的RTPCR檢測
參照諾唯贊生物科技有限公司的一步法RTPCR試劑盒說明書進行操作。反應體系50.0 μL,依次加入2×One Step Mix 25.0 μL,One Step Enzyme Mix 2.5 μL,MVBaVNF、MVBaVNR 各1.0 μL(濃度為10.0 μmol/L),模板總RNA 1.0 μL,加水至50.0 μL。反應條件為:50℃反轉錄30 min;94℃預變性3 min;94℃變性30 s,56℃退火30 s,72℃延伸55 s,35個循環;72℃終延伸7 min。取1.0 μL產物進行1%瓊脂糖凝膠電泳檢測。
1.2.4MVaBV的LAMP及RTLAMP反應體系
LAMP反應體系為25.0 μL:2×反應緩沖液(RM)12.5 μL,酶溶液(EM)1.0 μL,FIP、BIP各2.0 μL(濃度為20.0 μmol/L),F3、B3各0.5 μL(濃度為20.0 μmol/L),質粒DNA模板(質粒SXCSY17, 濃度10 ng/μL)1.0 μL,去離子水補足25.0 μL。63℃反應60 min,80℃ 5 min。反應結束,取1.0 μL產物進行2%瓊脂糖凝膠電泳檢測。LAMP反應體系用于篩選LAMP檢測引物組。
RTLAMP反應體系25.0 μL:Bst DNA polymerase 1.0 μL,10 ×Bst Buffer 2.5 μL,MgSO4 1.5 μL,Betaine 1.0 μL(1.0 mol/L),AMV 1.0 μL,RNase Inhibitor 1.0 μL,FIP、BIP各2.0 μL(濃度為20.0 μmol/L),F3、B3各0.5 μL(濃度為20.0 μmol/L),dNTPs 3.5 μL(10 mmol/L),總RNA模板,加RNase Free H2O至25.0 μL,充分混勻。63℃反應60 min,80℃滅活5 min。反應結束,取1.0 μL產物進行2%瓊脂糖凝膠電泳,同時向RTLAMP產物中加入2.0 μL SYBR Green Ⅰ(稀釋10倍),直接觀察,綠色為陽性,橙色為陰性。
1.2.5RTLAMP特異性和靈敏度測定
提取TZSV和HCRV陽性樣品的總RNA,使用本研究篩選獲得的RTLAMP引物按照“1.2.4”的反應體系進行RTLAMP檢測,評估引物特異性;提取感染桑脈帶病毒病并且已經顯癥的桑葉樣品總RNA,并將總RNA進行10倍梯度稀釋,共設10.0 ng/μL、1.0 ng/μL、100.0 pg/μL、10.0 pg/μL、1.0 pg/μL、100.0 fg/μL和10.0 fg/μL共7個梯度,分別按照“1.2.3”進行RTPCR檢測和“1.2.4”進行RTLAMP檢測,通過比較其最低檢測量評估靈敏度。
1.2.6MVBaV病株的檢測
提取田間采集的MVBaV病株或疑似病株的總RNA,分別按照“1.2.3”進行RTPCR檢測和“1.2.4”進行RTLAMP檢測。
2結果與分析
2.1引物篩選及RTLAMP體系的建立
使用所設計的5組候選引物組(表1),以攜帶MVBaVN基因重組質粒SXCSY17為模板,在63℃恒溫條件下LAMP反應。LAMP產物經2.0%瓊脂糖凝膠電泳檢測,結果顯示,第Ⅴ組引物組的反應產物可見典型的LAMP反應階梯狀條帶,而第Ⅰ~Ⅳ組引物組的反應產物除了一些疑似模板DNA的條帶,沒有可見階梯狀條帶(圖1)。因此選擇第Ⅴ組引物組進行下一步的RTLAMP檢測。
分別以感染MVBaV的桑葉及健康桑葉(均經過RTPCR方法確認)的總RNA為模板,利用第Ⅴ組引物組,63℃恒溫條件下進行RTLAMP反應1 h,80℃處理5 min終止反應,向RTLAMP反應液中加入SYBR Green Ⅰ,陽性樣品變成綠色,陰性樣品為橙色(圖2)。
2.2RTLAMP檢測方法的特異性
以MVBaV陽性樣品為對照,對TZSV、HCRV陽性樣品進行RTLAMP檢測。結果顯示,只有MVBaV陽性樣品為綠色,TZSV與HCRV陽性樣品為橙色(圖3),RTLAMP僅檢測出目標MVBaV,不能檢測出TZSV和HCRV,表明MVBaV的RTLAMP引物具有較強的特異性。
2.3RTLAMP檢測方法的靈敏度
提取MVBaV感染的桑病葉組織總RNA,使用微量分光光度計測定其濃度并按照10倍比例稀釋,共設7個梯度,分別進行RTLAMP檢測和RTPCR檢測。結果顯示,使用RTLAMP方法檢測,當模板含量為100 fg時,反應液呈綠色(陽性反應),電泳時條帶清晰可見(圖4a~b);使用RTPCR方法檢測,采用1%的瓊脂糖凝膠電泳檢測RTPCR擴增產物,當模板含量為1 pg時,擴增條帶較弱;當模板含量為100 fg時,已無明顯的可見特性條帶(圖4c)。RTLAMP檢測方法比RTPCR檢測方法的靈敏度高10倍。
2.4MVBaV RTLAMP檢測方法的應用
采用RTLAMP對6份田間樣品進行檢測。結果顯示,1、3、5、6號樣品顯示為綠色,表明這4個樣品中帶有MVBaV(圖5a),2、4號樣品顯示為橙色,表明這2個樣品中沒有MVBaV。進一步RTPCR進行驗證,其結果顯示1、3、5、6號樣品可擴增出約800 bp的特異性條帶(圖5b),2、4號樣品無可見條帶,與RTLAMP結果一致。值得一提的是,3號樣品為無明顯癥狀的隱癥樣品,說明RTLAMP方法檢測到隱癥樣品中的目標病毒。
3討論
本研究以MVBaV N基因為靶標,建立了該病毒的RTLAMP 檢測技術,該技術可以直接檢測桑葉中的MVBaV,可用于桑脈帶病毒病的快速診斷及MVBaV檢測。桑樹病毒病在田間具有花葉狀、環斑狀和畸形等多種癥狀表現,是由多種病毒引起的病害類群[2,16]。國際分類委員會網站及其歷年的病毒報告中記錄的侵染桑樹的病毒有桑潛隱病毒和桑環斑病毒[17]。近年來,隨著小RNA深度測序技術的應用,在桑樹病毒病樣品中發現了番茄斑萎病毒屬Tospovirus[4]、雙生病毒屬Geminiviruses[18]、桿狀DNA病毒屬Badnavirus[19]和線蟲傳多面體病毒屬Nepovirus[20]等多種病毒。桑樹病毒病的診斷依據主要是病害癥狀。由于多數病毒的田間癥狀常受不同氣候條件、品種、栽培條件的影響,癥狀復雜多變,而且不同的病毒也有可能引起相同或相似的癥狀,易造成誤診。本研究建立的MVBaV RTLAMP 檢測技術在反應完成后可以依據顏色變化直接判斷檢測結果,不需要對產物進行電泳,具有檢測時間短、操作簡便等優點,可為科研單位及生產單位檢測MVBaV提供技術支持。MVBaV引起的桑脈帶病毒病存在高溫隱癥現象[23],也給該病害的診斷和無毒苗木的調運帶來一定的困難。本研究建立的RTLAMP 檢測方法不僅適用顯癥樣品中病毒的檢測,對隱癥樣品的快速檢測同樣有效,在無毒種苗生產中也有重要實用價值。
參考文獻
[1]張璐,朱麗玲,潘瑞蘭,等.利用酵母雙雜交系統研究桑脈帶相關病毒核外殼蛋白自身相互作用[J].基因組學與應用生物學,2015,34(11):24282435.
[2]邱長玉,朱方容,林強.桑樹花葉病的研究進展[J].廣西蠶業,2011(2):3237.
[3]MENG Jiaorong, LIU Pingping, ZHU Liling, et al. Complete genome sequence of mulberry vein banding associated virus, a new tospovirus infecting mulberry [J/OL]. PLoS ONE, 2015, 10(8): e0136196.
[4]MENG Jiaorong, LIU Pingping, ZOU Chengwu, et al. First report of a tospovirus in mulberry [J]. Plant Disease, 2013, 97(7): 1001.
[5]陶源, 吳興泉. 植物病毒檢測方法的研究進展[J]. 分子植物育種, 2017, 15(7): 29012906.
[6]FANG Y, RAMASAMY R P. Current and prospective methods for plant disease detection[J]. Biosensors, 2015, 5(3): 537561.
[7]BOONHAM N, KREUZE J, WINTER S, et al. Methods in virus diagnostics: from ELISA to next generation sequencing[J]. Virus Research, 2014, 186: 2031.
[8]WARD L I, HARPER S J. Loopmediated isothermal amplification for the detection of plant pathogens [M]∥SUCHER N J, HENNELL J R, CARLES M C. Plant DNA Fingerprinting and Barcoding: Methods and Protocols.New York: Humana Press, 2012: 161170.
[9]NOTOMI T, OKAYAMA H, MASUBUCHI H, et al. Loopmediated isothermal amplification of DNA[J/OL]. Nucleic Acids Research, 2000, 28(12): e63.
[10]WU Xinghai, CHEN Chanfa, XIAO Xizhi, et al. Development of reverse transcription thermostable helicasedependent DNA amplification for the detection of tomato spotted wilt virus [J]. Journal of AOAC International, 2016, 99(6): 15961599.
[11]張永江, 辛言言, 李桂芬, 等. 葡萄A病毒RTLAMP檢測方法的建立[J].中國農業科學, 2016, 49(1): 103109.
[12]湯亞飛, 何自福, 佘小漫, 等. 辣椒黃脈病毒RTLAMP快速檢測方法的建立[J].植物保護, 2016, 42(6): 100104.
[13]陳柳, 尚巧霞, 陳笑瑜, 等. 草莓輕型黃邊病毒RTLAMP檢測方法的建立[J].中國農業科學, 2015, 48(3): 613620.
[14]陳先鋒,張吉紅,崔俊霞,等.南芥菜花葉病毒的RTLAMP檢測試劑盒的研制[J].植物保護學報,2013,40(2):189190.
[15]郭木金,廖富榮, 陳青, 等. 豇豆重花葉病毒RTLAMP檢測方法的建立[J].植物保護, 2012, 38(1): 123127.
[16]蒯元璋. 桑樹病毒與病毒病的研究進展(Ⅰ)[J].蠶業科學, 2010(5): 818825.
[17]陳明勝, 吳福安. 桑花葉病研究的現狀與對策[J].中國蠶業, 2009(2): 2023.
[18]MA Yuxin, NAVARRO B, ZHANG Zhixiang, et al. Identification and molecular characterization of a novel monopartite geminivirus associated with mulberry mosaic dwarf disease [J].The Journal of General Virology,2015,96(8):24212434.
[19]CHIUMENTI M, MORELLI M, DE STRADIS A, et al. Unusual genomic features of a badnavirus infecting mulberry [J]. The Journal of General Virology, 2016, 97(11): 30733087.
[20]LU Quanyou, WU Zujian, XIA Zhisong, et al. A new nepovirus identified in mulberry (Morus alba L.) in China [J]. Archives of Virology, 2015, 160(3): 851855.
(責任編輯:田喆)

