冰菜鹽脅迫下的轉(zhuǎn)錄組分析
練冬梅, 賴正鋒, 姚運(yùn)法, 林碧珍, 洪建基
?
冰菜鹽脅迫下的轉(zhuǎn)錄組分析
練冬梅, 賴正鋒, 姚運(yùn)法, 林碧珍, 洪建基*
(福建省農(nóng)業(yè)科學(xué)院亞熱帶農(nóng)業(yè)研究所,福建 漳州 363005)
為了解冰菜()葉片抗鹽相關(guān)基因組學(xué),利用Illumina Hi-seq TM2500高通量測序技術(shù)研究冰菜葉片在400 mmol L–1NaCl脅迫下轉(zhuǎn)錄組基因的差異表達(dá)。結(jié)果表明,從400 mmol L–1NaCl脅迫和對照的冰菜葉片中共獲得13.01 Gb Clean data,Q30堿基均大于90.08%。共獲得123個差異表達(dá)基因(DEGs),包括73個上調(diào)基因,50個下調(diào)基因,其中功能注釋的基因有96個。根據(jù)Unigene庫序列進(jìn)行GO、COG和KEGG注釋,篩選出8個與抗鹽性相關(guān)差異表達(dá)基因,植物激素代謝相關(guān)基因,脫落酸8?-羥基化酶、吲哚-3-乙酰酸酰胺合成酶和茉莉酮酸酯ZIM結(jié)構(gòu)域蛋白基因均下調(diào)表達(dá),生長素響應(yīng)蛋白、細(xì)胞分裂素合酶基因則上調(diào)表達(dá),糖代謝相關(guān)基因棉子糖合成酶基因上調(diào)表達(dá),質(zhì)膜H+-ATPase基因上調(diào)表達(dá),脫水蛋白基因下調(diào)表達(dá)。這為冰菜耐鹽基因組學(xué)和分子生物學(xué)的研究奠定基礎(chǔ)。
冰菜;鹽脅迫;葉片;轉(zhuǎn)錄組;差異表達(dá)基因
土壤的鹽漬化已經(jīng)成為全球性的生態(tài)問題,影響農(nóng)作物生長發(fā)育和產(chǎn)量的重要制約因素,因此,研究鹽生植物的耐鹽機(jī)制對防治土壤鹽漬化具有重要意義。中國沿海面積廣闊,部分地區(qū)由于自然和人為因素造成了土壤鹽漬化,其中,福建省地處沿海的土壤也受到不同程度的破壞。而園林植物生長緩慢,種類較少,資源貧乏[1],土壤修復(fù)慢,因此需要一些耐鹽速生植物來維持生態(tài)環(huán)境的可持續(xù)發(fā)展。近來,福建地區(qū)已成功引進(jìn)種植冰菜,并受到消費(fèi)者的青睞。
冰菜(),即冰葉日中花,為番杏科(Aizoaceae)日中花屬植物,原產(chǎn)非洲南部和東部。冰菜在20.0%~40.0%海水濃度及低于400 mmolL–1NaCl下均具有極強(qiáng)的耐鹽性[2–3]。冰菜含豐富的營養(yǎng)物質(zhì),每100.0 g冰菜含有31.0g葉酸、77.0g視黃醇、926.0g-胡蘿卜素、0.7 g蛋白質(zhì)[4]。所以,冰菜作為一種具有較高生態(tài)功能和保健功能的蔬菜,值得深入研究和廣泛推廣種植。當(dāng)前,國內(nèi)外對冰菜的相關(guān)研究主要集中在栽培技術(shù)、抗鹽生理生態(tài)上[5–7],而對其細(xì)胞和分子水平的研究還亟待發(fā)展完善。
基于測序技術(shù)的進(jìn)步,近年來植物響應(yīng)非生物脅迫,尤其是鹽脅迫的轉(zhuǎn)錄組研究成果層出不窮[8–11]。目前,轉(zhuǎn)錄組分析是揭示植物耐鹽分子機(jī)制的主流方法,可以全面、系統(tǒng)地反映植物的耐鹽分子機(jī)制[12]。分析鹽生植物在鹽脅迫下的轉(zhuǎn)錄組是研究植物耐鹽分子機(jī)制和鑒定耐鹽相關(guān)基因的重要策略之一[13–14]。冰菜的分子遺傳學(xué)和功能基因組學(xué)研究不深,冰菜在鹽脅迫下的分子調(diào)控機(jī)制仍不清楚,關(guān)聯(lián)轉(zhuǎn)錄組學(xué)是一種鑒定調(diào)控目標(biāo)性狀候選基因的新方法。本研究采用Illumina Hiseq 2500高通量測序技術(shù),從分子層面研究和解析鹽脅迫處理后冰菜葉片基因的表達(dá)變化,以尋找冰菜葉片中耐鹽關(guān)鍵基因,為冰菜耐鹽基因組學(xué)和分子生物學(xué)研究提供參考。
1 材料和方法
1.1 材料
冰菜()種子來自于福建省農(nóng)業(yè)科學(xué)院亞熱帶農(nóng)業(yè)研究所。種子經(jīng)3% H2O2消毒3 min,流水沖洗數(shù)次,將種子放置在干凈的基質(zhì)中,置于培養(yǎng)箱中培養(yǎng)至三葉一心,選擇生長一致的幼苗種植于花盆中,每盆3株,脅迫組(S)和對照組(Control)各3盆。每2 d澆1/2Hoag- land營養(yǎng)液1次,置于人工氣候室中,進(jìn)行為期2周的預(yù)培養(yǎng)。此后,為避免鹽沖擊,每2 d遞增澆含50 mmol L–1NaCl的1/2Hoagland營養(yǎng)液,直到400 mmolL–1,對照僅澆1/2Hoagland營養(yǎng)液,以后仍然每2 d澆1/2Hoagland營養(yǎng)液1次,再培養(yǎng)植物35 d[15],冰菜可采食時,剪下植株相同部位的葉片(盡量去除中上部較新鮮嫩綠的葉片),每處理3個重復(fù),每個處理的所有葉片混合后置于冷凍管中,液氮速凍,存于–80℃超低溫冰箱備用。
1.2 葉片總RNA提取、轉(zhuǎn)錄組測序和分析
用PureLink Plant RNAReagent Kit試劑盒提取冰菜葉片的總RNA,用分光光度計測定A260和A280值,計算樣品濃度,然后用15%的變性聚丙烯酰胺凝膠電泳,檢測質(zhì)量合格后送北京百邁客生物技術(shù)有限公司進(jìn)行轉(zhuǎn)錄組測序,并得到轉(zhuǎn)錄組數(shù)據(jù)。運(yùn)用生物信息學(xué)技術(shù)和方法,對測序數(shù)據(jù)進(jìn)行前期處理、序列比對、基因及基因組的注釋、基因表達(dá)分析等。
2 結(jié)果和分析
2.1 數(shù)據(jù)組裝和分析
對照和脅迫處理冰菜葉片經(jīng)高通量測序和質(zhì)量控制,共獲得13.01 Gb有效數(shù)據(jù)(Clean data),其中對照為6.62 Gb,脅迫處理的為6.39 Gb,其Q30堿基均大于90.80%,表明測序結(jié)果可靠,可用于后續(xù)的分析。從表1可見,總共產(chǎn)生69 734條單基因序列(Unigene)和131 228條轉(zhuǎn)錄本序列(Transcipt), N50分別為2 323和2 058 bp,組裝完整性較高; 其中長度為200~300 bp的Unigene數(shù)量最多,有22 060條,占31.63%,且隨著長度的增加,Unigene數(shù)量減少。
2.2 Unigene功能注釋
為獲得Unigene的功能注釋信息,通過NR、Swiss-Prot、KEGG、COG、KOG、NOG、GO和Pfam等8個數(shù)據(jù)庫進(jìn)行注釋分析(表2),在69 734條Unigene中,共獲得26 360條(37.80%)注釋,以上8個數(shù)據(jù)庫分別獲得26 079 (37.39%)、16 708 (23.95%)、9 624 (13.80%)、8 029 (11.51%)、14 431 (20.69%)、24 156 (34.64%)、15 700 (22.51%)和17 910條(25.68%)注釋。
2.3 差異表達(dá)基因分析
通過對照和脅迫處理冰菜葉片差異基因的表達(dá)分析,共獲得123個差異表達(dá)基因(differential expression genes, DEGs),包括73個上調(diào)基因,50個下調(diào)基因;將DEGs單基因序列分別在8個數(shù)據(jù)庫中進(jìn)行注釋,共獲得96條基因功能注釋,COG、GO、KEGG、KOG、Pfam、Swiss-Prot、eggNOG和NR分別注釋19、43、23、37、76、67、86和92條,以NR數(shù)據(jù)庫注釋比率最高,達(dá)95.83%。
差異表達(dá)基因的GO功能注釋 GO功能注釋的43條DEGs共分為3大類,分別為生物過程、細(xì)胞組分和分子功能,又劃分為27個功能小類(表3),生物過程的DEGs以代謝過程、細(xì)胞過程和單一生物過程3個功能小類的數(shù)量最多;細(xì)胞組分的DEGs以細(xì)胞、細(xì)胞成分、細(xì)胞器和膜結(jié)構(gòu)4個功能小類的數(shù)量最多;分子功能的DEGs以催化活性和結(jié)合活性2個功能小類的數(shù)量最多。
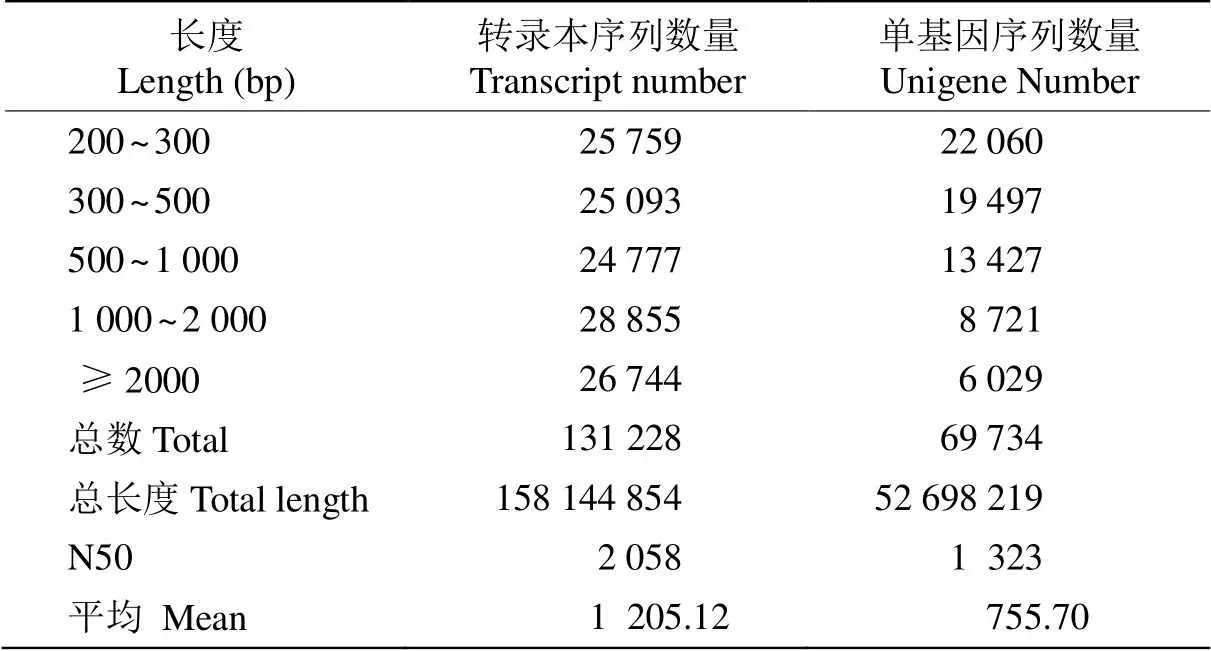
表1 組裝結(jié)果統(tǒng)計
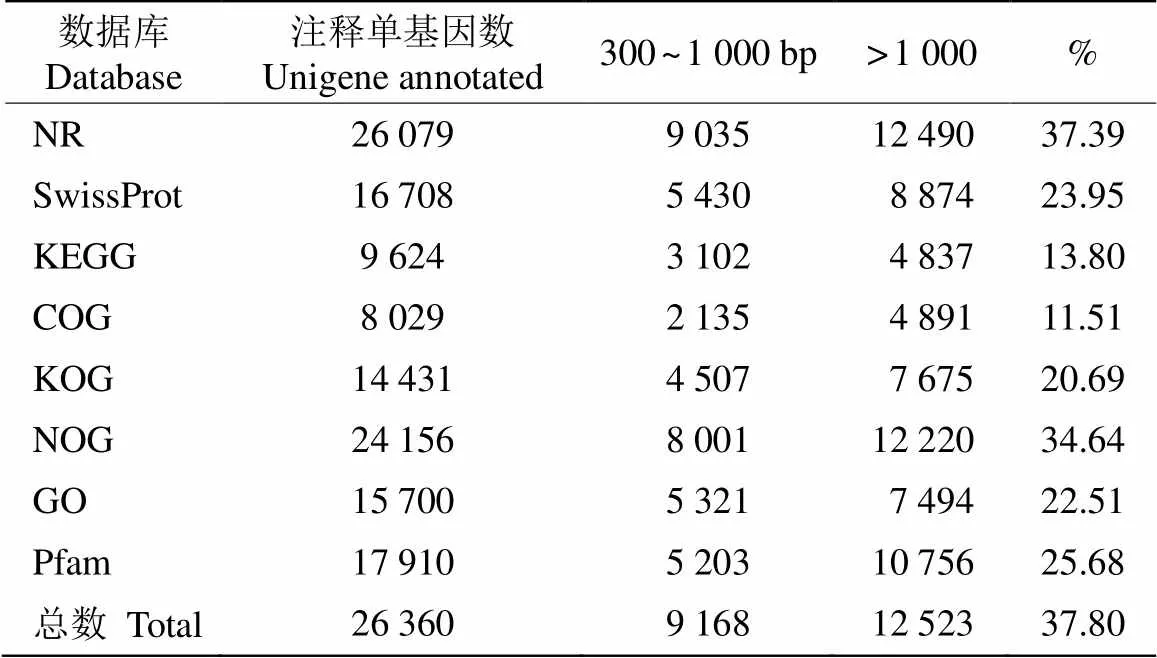
表2 單基因序列的功能注釋

表3 差異表達(dá)基因GO功能注釋
差異表達(dá)基因的COG功能注釋 COG數(shù)據(jù)庫注釋的19條DEGs進(jìn)行直系同源分類,并獲得11個功能分類(表4),主要集中在E (氨基酸的轉(zhuǎn)運(yùn)和代謝)、G (碳水化合物轉(zhuǎn)運(yùn)與代謝)、Q (次生代謝產(chǎn)物生物合成、運(yùn)輸和分解代謝)和R (一般性功能預(yù)測)。植物生長發(fā)育過程有大量基因表達(dá),在鹽脅迫下,部分涉及到了氨基酸、碳水化合物的轉(zhuǎn)運(yùn)和代謝,以及次生代謝產(chǎn)物生物合成、運(yùn)輸和分解代謝等過程,說明這些生物學(xué)過程對于冰菜生命活動特別是耐鹽性的重要性。
差異表達(dá)基因的KEGG功能注釋 有23個DEGs得到注釋(表5),分別富集在10條代謝通路,包括植物激素信號轉(zhuǎn)導(dǎo)(4個)、類胡蘿卜素生物合成(2個)、半乳糖代謝(1個)、酪氨酸代謝(1個)、玉米素生物合成(1個)、異喹啉生物堿生物合成(1個)、氧化磷酸化(1個)、-亞麻酸代謝(1個)、淀粉和蔗糖代謝(1個)和角質(zhì)、次分泌和蠟生物合成(1個)。這說明鹽脅迫下冰菜葉片的各種代謝途徑都發(fā)生了變化。
2.4 差異基因分析
通過對鹽脅迫下冰菜葉片轉(zhuǎn)錄組測序結(jié)果進(jìn)行功能注釋、功能分類及代謝途徑分析表明(表6),生長素響應(yīng)蛋白、細(xì)胞分裂素合酶、棉子糖合成酶和H+-ATPase基因的表達(dá)分別上調(diào)了351.4%、500.0%、877.9%和459.6%倍,吲哚-3-乙酰酸酰胺合成酶、脫落酸8?-羥基化酶、茉莉酮酸酯ZIM結(jié)構(gòu)域蛋白和脫水蛋白基因的表達(dá)則分別下調(diào)了100.0%、80.7%、85.4%和100.0%。可見,這些差異表達(dá)基因參與了植物激素、糖等的代謝途徑,影響著冰菜的生長發(fā)育。
3 討論
雖然目前已經(jīng)利用生理生化手段揭示和闡明了冰菜許多的耐鹽機(jī)制,但從分子水平上冰菜仍有很多抗性策略和機(jī)制有待深入研究和分析。轉(zhuǎn)錄組主要指所有編碼蛋白質(zhì)的mRNA總和[16],能夠從整體水平探索基因的結(jié)構(gòu)和功能。冰菜為非模式生物,需要通過與同源物種的測序信息進(jìn)行比對分析,從而研究各種特定的生物學(xué)過程和分子機(jī)理。在本研究中,利用Illumina HiSeq TM2500高通量測序技術(shù)構(gòu)建了冰菜在400 mmolL–1鹽脅迫下的葉片轉(zhuǎn)錄組數(shù)據(jù)庫,借助其他物種數(shù)據(jù)庫已有信息,對表達(dá)差異的基因進(jìn)行比對分析,表明鹽脅迫后冰菜的植物激素代謝、糖代謝和其它相關(guān)功能蛋白基因的表達(dá)發(fā)生了改變。

表4 差異表達(dá)基因COG功能注釋

表5 差異表達(dá)基因的KEGG功能注釋

表6 鹽脅迫下冰菜葉片差異基因的表達(dá)豐度
植物激素幾乎參與了所有的生命活動,其對鹽脅迫的響應(yīng)也不例外。植物中的激素沒有明顯的專一性,一種激素可以有多種生理效應(yīng),而多種激素又具有調(diào)節(jié)同一生理過程的作用[17]。鹽脅迫下,冰菜葉片中脫落酸8?-羥基化酶、吲哚-3-乙酰酸酰胺合成酶和茉莉酮酸酯ZIM結(jié)構(gòu)域蛋白基因均下調(diào)表達(dá),而生長素響應(yīng)蛋白、細(xì)胞分裂素合酶基因上調(diào)表達(dá),均有利于合成脫落酸(ABA)、生長素(AUXIN)、茉莉酸(JA)和細(xì)胞分裂素(CTK),促進(jìn)細(xì)胞分裂,加速細(xì)胞伸長生長,提高冰菜的鹽脅迫耐受性。
鹽脅迫下,植物通過細(xì)胞積累大量可溶性物質(zhì)來提高滲透勢,增強(qiáng)對滲透脅迫的抗性[18],在表達(dá)差異基因中,冰菜葉片中的棉子糖合成酶基因上調(diào)表達(dá),有利于合成可溶性糖棉子糖,以提高細(xì)胞內(nèi)的滲透勢,從而提高冰菜的鹽脅迫耐受性。
質(zhì)膜H+-ATPase是細(xì)胞質(zhì)膜上的一種重要功能蛋白,在植物的生命活動過程中起著重要作用。在轉(zhuǎn)錄水平上,質(zhì)膜H+-ATPase參與了植物生長發(fā)育過程中的多種脅迫反應(yīng)[19]。鹽脅迫對植物造成離子毒害、滲透脅迫和營養(yǎng)不平衡,使植物的生長發(fā)育受到抑制,這可能與鹽脅迫下植物細(xì)胞的跨質(zhì)膜物質(zhì)轉(zhuǎn)運(yùn)發(fā)生改變有關(guān)。有研究表明,物質(zhì)通過植物細(xì)胞的跨膜轉(zhuǎn)運(yùn)依賴于質(zhì)膜H+-ATPase轉(zhuǎn)運(yùn)質(zhì)子產(chǎn)生的驅(qū)動力[20–21]。在鹽脅迫下,冰菜葉片中的H+-ATPase基因上調(diào)表達(dá),可以增強(qiáng)H+泵的質(zhì)子動力勢,驅(qū)動Na+/H+逆向轉(zhuǎn)運(yùn)蛋白,提高Na+外排的能力,減少K+離子外流,維持了K+/Na+平衡,從而提高冰菜的鹽脅迫耐受性。脫水蛋白是在干旱脅迫下產(chǎn)生的最具有代表性的逆境響應(yīng)蛋白,脫水蛋白基因下調(diào)表達(dá),反映了鹽脅迫下冰菜葉片自身降低脫水的生理現(xiàn)象。
植物耐鹽性是由一系列基因相互協(xié)調(diào)而共同發(fā)揮作用來表現(xiàn)的[22]。冰菜經(jīng)過400 mmolL–1鹽脅迫后,在一系列基因共同作用下進(jìn)行自我調(diào)節(jié),從而正常生長發(fā)育。從分子水平上,可更詳細(xì)地研究其對應(yīng)的耐鹽基因,為后期篩選冰菜耐鹽關(guān)鍵基因和功能驗(yàn)證提供重要的分子基礎(chǔ),同時為改善土壤鹽漬化具有重要意義。
[1] LU L M, WU F M, ZHANG Q, et al. Growth and physiological indexes of‘Gillettese How’ under Nacl stress [J]. J Trop Subtrop Bot, 2015, 23(3): 262–267. doi: 10.11926/j.issn.1005-3395. 2015.03.005.陸鑾眉, 吳福妹, 張瓊, 等. NaCl脅迫對大黃龍船花生長及生理生化的影響 [J]. 熱帶亞熱帶植物學(xué)報, 2015, 23(3): 262–267. doi: 10. 11926/j.issn.1005-3395.2015.03.005.
[2] LI G L, HU Z H, LENG P S. The physiological responses ofL. to NaCl stress [J]. J Beijing Univ Agric, 2015, 30(1): 64–70. doi: 10.13473/j.cnki.issn.1002-3186.2015.0004.李廣魯, 胡增輝, 冷平生. 冰葉日中花對NaCl脅迫的生理響應(yīng)[J]. 北京農(nóng)學(xué)院學(xué)報, 2015, 30(1): 64–70. doi: 10.13473/j.cnki.issn.1002- 3186.2015.0004.
[3] XU W F, QIN H Y, LIU J, et al. Changes of oxidative stress and anti- oxidant enzyme activity ofLinnaeus in response to different concentrations of seawater [J]. Jiangsu J Agric Sci, 2017, 33(4): 775–781. doi: 10.3969/j.issn.1000-4440.2017.04.008.徐微風(fēng), 覃和業(yè), 劉姣, 等. 冰菜在不同濃度海水脅迫下的氧化脅迫和抗氧化酶活性變化[J]. 江蘇農(nóng)業(yè)學(xué)報, 2017, 33(4): 775–781. doi: 10.3969/j.issn.1000-4440.2017.04.008.
[4] CHEN H Y. The biological characteristics and cultivation techniques ofL. [J]. Vegetables, 2016, (8): 42–45. doi: 10.3969/j.issn.1001-8336.2016.08.015. 陳宏毅. 冰菜的生物學(xué)特性與栽培技術(shù)[J]. 蔬菜, 2016, (8): 42–45. doi: 10.3969/j.issn.1001-8336.2016.08.015.
[5] ?Lesak I, Libik M, Miszalski Z. The foliar concentration of hydrogen peroxide during salt-induced C3-CAM transition inL. [J]. Plant Sci, 2008, 174(2): 221–226. doi: 10.1016/j.plantsci.2007.11.007.
[6] OH D H, BARKLA B J, VERAESTRELLA R, et al. Cell type-specific responses to salinity-the epidermal bladder cell transcriptome of[J]. New Phytol, 2015, 207(3): 627– 644. doi: 10.1111/nph.13414.
[7] COSENTINO C, FISCHER-SCHLIEBS E, BERTL A, et al. Na+/H+antiporters are differentially regulated in response to NaCl stress in leaves and roots of[J]. New Phytol, 2010, 186(3): 669–680. doi: 10.1111/j.1469-8137.2010.03208.x.
[8] HIZ M C, CANHER B, NIRON H, et al. Transcriptome analysis of salt tolerant common bean (L.) under saline conditions [J]. PLoS One, 2014, 9(3): e92598. doi: 10.1371/journal.pone.0092598.
[9] LIU J T, ZHOU Y L, LUO C X, et al.transcriptome sequencing of desert herbaceous(Achnatherum)seedlings and identification of salt tolerance genes [J/OL]. Genes, 2016, 7(4): 12. doi: 10.3390/genes7040012.
[10] SONG B, HU A H, HALIL kurban. Transcriptome analysis of differentially expressed genes inL. under salt stress [J]. J Xinjiang Agric Univ, 2017, 40(2): 92–98. doi: 10.3969/j. issn.1007-8614.2017.02.003.宋彬, 胡安鴻, 海利力·庫爾班. 沙棘NaCl脅迫下差異表達(dá)基因的轉(zhuǎn)錄組分析[J]. 新疆農(nóng)業(yè)大學(xué)學(xué)報, 2017, 40(2): 92–98. doi: 10. 3969/j.issn.1007-8614.2017.02.003.
[11] JI F S, LI Y Y, TANG L, et al. Analysis of banana leaves responses salt stress of transcriptome [J]. Mol Plant Breed, 2017, 15(3): 875–882. 吉福桑, 李元元, 唐露, 等. 香蕉葉片響應(yīng)鹽脅迫轉(zhuǎn)錄組分析[J]. 分子植物育種, 2017, 15(3): 875–882.
[12] FU C, SUN Y G, FU G R. Advances of salt tolerance mechanism in hylophyate plants [J]. Biotechnol Bull, 2013(1): 1–7.
付暢, 孫玉剛, 傅桂榮. 鹽生植物耐鹽分子機(jī)制的研究進(jìn)展[J]. 生物技術(shù)通報, 2013(1): 1–7.
[13] DEYHOLOS M K. Making the most of drought and salinity trans- criptomics [J]. Plant Cell Environ, 2010, 33(4): 648–654. doi: 10.1111/ j.1365-3040.2009.02092.x.
[14] SAHU B B, SHAW B P. Isolation, identification and expression analysis of salt-induced genes in, a natural halophyte, using PCR-based suppression subtractive hybridization [J]. BMC Plant Biol, 2009, 9: 69. doi: 10.1186/1471-2229-9-69.
[15] Epstein E, Bloom A J. Mineral Nutrition of Plants: Principles and Perspectives [M]. 2nd ed. Sunderland (Massachusetts): Sinauer Associates, 2005: 1–400.
[16] LIU H L, ZHENG L M, LIU Q Q, et al. Studies on the transcriptomes of non-model organisms [J]. Hereditas, 2013, 35(8): 955–970. doi: 10. 3724/SP.J.1005.2013.00955.劉紅亮, 鄭麗明, 劉青青, 等. 非模式生物轉(zhuǎn)錄組研究[J]. 遺傳, 2013, 35(8): 955–970. doi: 10.3724/SP.J.1005.2013.00955.
[17] MUNNS R, TESTER M. Mechanisms of salinity tolerance [J]. Annu Rev Plant Biol, 2008, 59: 651–681. doi: 10.1146/annurev.arplant.59. 032607.092911.
[18] TüRKAN I, DEMIRAL T. Recent developments in understanding salinity tolerance [J]. Environ Exp Bot, 2009, 67(1): 2–9. doi: 10. 1016/j.envexpbot.2009.05.008.
[19] LIU N G, WANG Z Y, MO B B, et al. Plasma membrane H+-ATPase and environmental stress [J]. J Trop Subtrop Bot, 2006, 14(3): 263–268. doi: 10.3969/j.issn.1005-3395.2006.03.017.劉尼歌, 王占義, 莫丙波, 等. 質(zhì)膜H+-ATPase與環(huán)境脅迫[J]. 熱帶亞熱帶植物學(xué)報, 2006, 14(3): 263–268. doi: 10.3969/j.issn.1005- 3395.2006.03.017.
[20] MICHELET B, BOUTRY M. The plasma membrane H+-ATPase: A highly regulated enzyme with multiple physiological functions [J]. Plant Physiol, 1995, 108(1): 1–6. doi: 10.1104/pp.108.1.1.
[21] PALMGREN M G. Regulation of plant plasma membrane H+-ATPase activity [J]. Physiol Plant, 1991, 83(2): 314–323. doi: 10.1111/j.1399- 3054.1991.tb02159.x.
[22] ZHOU C F, LIN P, YAO X H, et al. Selection of reference genes for quantitative real-time PCR in six oil-tea camellia based on RNA-seq [J]. Mol Biol, 2013, 47(6): 836–851. doi: 10.1134/S0026893313060198.
Transcriptome Analysis ofunder Salt Stress
LIAN Dong-mei, LAI Zheng-feng, YAO Yun-fa, LIN Bi-zhen, HONG Jian-ji*
(Subtropical Agriculture Research Institute, Fujian Academy of Agricultural Sciences, Zhangzhou 363005, Fujian, China)
In order to understand the salt related genomics in leaves of, the expression of transcriptome genes was studied under 400 mmol L–1NaCl stress by using Illumina Hiseq TM2500 high-throughput sequencing technology. The results showed that there were 13.01 Gb Clean Data from the leaves treated with 400 mmol L–1NaCl and untreated, the Q30 base was more than 90.08%. Among them, there were 123 differential expression genes (DEGs), including 73 up-regulated genes and 50 down-regulated genes, in which 96 genes were annotated. The eight salt-resistance DEGs of were screened out based on GO, COG and KEGG annotation. The plant hormone metabolism-related genes, including abscisic acid 8?-hydroxylase gene, indole-3-acetamide synthase gene, jasmonate ZIM structure domain protein gene were down-regulated, auxin responsive protein and cytokinin synthase genes were up-regulated. The sugar metabolism-related raffinose synthase genes was up-regulated, and plasma membrane H+-ATPase and dehydrated protein genes were up and down-regulated, respectively. These would provide a foundation for studing on salt tolerance genomics and molecular biology of.
;Salt stress; Leaf;Transcriptome;DEGs
10.11926/jtsb.3972
2018–07–16
2018–12–03
福建省公益類科研院所專項(2018R1101025-2)資助
This work was supported by the Special Project for Public Welfare Research Institutes in Fujian (Grant No. 2018R1101025-2).
練冬梅,女,助理研究員,主要從事特色蔬菜研究。E-mail: woshildm1987@163.com
通信作者 Corresponding author.E-mail: 76227508@qq.com

