乳酸鈉對單增李斯特菌生物被膜形成的抑制作用
付嬌嬌 , 王 旭 , 劉海泉 , 孫曉紅 , 謝 晶 , 潘迎捷 , 趙 勇 *
(1.上海海洋大學 食品學院,上海 201306;2.上海水產品加工及貯藏工程技術研究中心,上海 201306;3.農業部貯藏保鮮質量安全風險評估實驗室(上海),上海 201306)
單增李斯特菌(Listeria monocytogenes)是重要的革蘭氏陽性食源性致病菌,可引發敗血癥、胃腸炎和腦膜炎等疾病,被WHO列為關系食品衛生安全的重要病源細菌之一[1]。單增李斯特菌在自然界廣泛分布,能在多數固體表面形成生物被膜。細菌生物被膜(Bacterial biofilm,BF)是細菌自身分泌的胞外基質相互粘連形成的,有特定結構和功能的細胞群體[2-3]。自然界中大多數的細菌是以生物被膜狀態存在的,細菌處于生物被膜狀態可增強細菌對外界不利條件如干燥、極端的溫度、抗菌素和消毒劑的抵抗力[4]。因此,在食品生產、加工、運輸和保藏過程中,一旦發生細菌感染并形成生物被膜,常規殺菌方法便難以將其徹底清除,這給食品安全造成極大的隱患。可見,尋找如何有效預防和控制食品產業中細菌生物被膜形成的方法已刻不容緩。乳酸鈉作為一種天然、無毒、穩定的食品防腐劑,在肉類工業中廣泛應用,正越來越受到食品產業的重視[5]。研究表明,乳酸鈉對肉及肉類食品中常見腐敗菌和致病菌有較強的抑制作用,以延長食品貨架期[6]。然而,關于研究乳酸鈉對單增李斯特菌生物被膜形成的抑制作用尚未見報道。作者采用結晶紫染色法體外觀察不同質量濃度(0、2.5、5、10、20 g/dL)乳酸鈉對生物被膜形成的抑制效果,此外,使用實時定量熒光PCR檢測與單增李斯特菌生物被膜形成相關基因(motB、mogR、degU、flgE、dnaK、prfA 及 sigB)的表達水平,從而探究乳酸鈉對生物被膜形成的抑制作用。本研究為乳酸鈉應用于單增李斯特菌生物被膜的預防和控制奠定理論基礎。
1 材料與方法
1.1 材料與設備
1.1.1 菌株 單增李斯特菌野生型菌株WaX12由作者所在實驗室于生豬肉中分離而得,血清型為1/2a,經過形態學分析、生化特性以及分子生物學鑒定,由上海海洋大學農業部水產品貯藏保鮮質量安全風險評估實驗室保藏。
1.1.2 主要試劑和儀器 戊二醛、結晶紫、無水乙醇、磷酸緩沖液(PBS)及98%濃硫酸:均購自上海國藥化學試劑有限公司;氯化鉀:購自天津市鼎盛鑫化工有限公司;苯酚:購自上海展云化工有限公司;福林-酚、lowry reagent:均購自 Sigma 公司;MTT染料、碘化丙啶PI染料及SYBR GreenⅠ染料:均購自上海索萊寶生物科技有限公司;腦心浸液培養基(BHI培養基)、PALCAM培養基:均購自北京陸橋技術有限責任公司;24孔板、96孔微孔板:均購自Corning公司;動物總RNA快速提取試劑盒(Trizol-離心柱型):購自上海捷瑞生物工程有限公司;FastStart Universal SYBR Green Master(ROX):購自麥約爾生物技術有限公司;PrimeScriptTM RT Reagent Kit,日本TakaRa公司;BioTeK酶標儀:美國柏騰儀器有限公司;離心機、金屬浴、PCR擴增儀:美國Eppendorf公司;振蕩培養箱:上海知楚儀器有限公司;JYP2-IIN超聲波細胞粉碎機:寧波新芝生物科技股份有限公司;LSM710型激光掃描共聚焦顯微鏡:德國蔡司公司;NOVA NanoSEM230型超高分辨場發射掃描電子顯微鏡UHR FE-SEM:美國FEI公司;E-1045型離子濺射儀 Ion Sputter:日本Hitachi公司;7500 Fast Real-Time PCR System擴增儀:美國Applied Biosystems公司;BD FASSCalibur流式細胞儀:美國BD公司。
1.2 方法
1.2.1 生物被膜的形成與測定 參照文獻[7]的方法并稍作改進。具體步驟:將WaX12菌株在PALCAM選擇性培養基平板上劃線,37℃靜置過夜培養。挑取單菌落至5 mL BHI液體培養基于37℃、180 r/min振蕩培養7~8 h至OD600nm為0.6左右。配制終質量濃度分別為 0、2.5、5、10、20 g/dL 乳酸鈉的BHI培養基,將菌懸液與培養基按體積比1∶99(將10 μL 菌懸液接種于 990 μL 培養基), 按 1 mL/孔加入24孔細胞培養板中,測定培養48 h形成的生物被膜。24孔板用封口膜封口,防止培養基蒸發。設3個平行樣,以無菌BHI為空白對照。培養結束后,小心棄去孔中的培養基,用無菌PBS緩沖液洗滌3次,以除去尚未形成生物被膜的浮游菌體。室溫干燥45 min后,向每個樣品孔內加入1 mL 0.1%結晶紫溶液,染色30 min。染色結束后,用無菌PBS緩沖液洗滌3次。室溫風干后,加入1 mL 95%的乙醇溶液脫色30 min,移取200 μL洗脫液于96孔微孔板,最后用酶標儀檢測生物被膜菌的光吸收值(OD600nm)。不同濃度乳酸鈉對單增李斯特菌WaX12生物被膜形成的抑制率計算公式:

其中,CV(Cristal violet staining)為結晶紫染色法定量生物被膜的形成量,對照為不添加乳酸鈉,x為乳酸鈉的質量濃度。
1.2.2 胞外多糖 (Polysaccharide)及胞外蛋白質(Extracellular protein)的測定 菌株按1.2.1培養,測定WaX12菌株在37℃條件下培養48 h的生物被膜胞外多糖及胞外蛋白質的相對含量。參照文獻[8]方法并稍作改進。具體步驟如下:培養結束后,首先用酶標儀測定菌液OD595nm的光吸收值。然后小心棄去孔中的培養基,用無菌PBS緩沖液洗滌3次,以除去尚未形成生物被膜的浮游菌體。加入1 mL 0.01 mol/L的氯化鉀溶液重懸5 min,然后每個樣品孔超聲5 s,間隙5 s,循環5次。超聲結束后,將菌液轉移至1.5 mL無菌離心管內,于4℃條件下,轉速為 4 000 g/min,離心 20 min。隨后用直徑 0.22 μm的濾膜過濾上清液,以除去雜質。
胞外多糖的測定:吸取100 μL濾液于1.5 mL無菌離心管內,加入200 μL 98%的濃硫酸,室溫靜置30 min。隨后加入25 μL 6%的苯酚溶液,置于90℃ 金屬浴中,溫育5 min。移取200 μL樣品于96孔微孔板內,最后用酶標儀檢測OD490nm的光吸收值,計算比值OD490nm/OD595nm即為樣品多糖相對含量。
胞外蛋白質的測定:吸取40 μL濾液于1.5 mL無菌離心管內,加入 200 μL lowry reagent溶液(lowry法蛋白質濃度測定試劑),室溫靜置10 min。然后加入20 μL福林-酚溶液,室溫靜置30 min。移取200 μL樣品于96孔微孔板內,最后用酶標儀檢測OD750nm的光吸收值,計算比值OD750nm/OD595nm即為樣品胞外蛋白質的相對含量。
1.2.3 MTT法檢測生物被膜內細菌細胞活性 配制終質量濃度分別為0、5 g/dL乳酸鈉的BHI培養基,按1.2.1方法,于37℃下培養48 h形成的生物被膜。參照文獻[9]方法并稍作改進。具體步驟如下:先將形成的生物被膜經PBS洗滌3次,以去除未附著的細胞;加入1 mL新鮮BHI培養基和100 μL預先配制的終質量濃度為5 mg/mL MTT染液,于37℃避光溫育1 h,然后在通風櫥內加入1 mL二甲基亞砜溶解沉淀30 min,最后用酶標儀檢測OD570nm的光吸收值。
1.2.4 激光共聚焦顯微鏡 (Confoeal laser scanning microscopy,CLSM)觀察生物被膜結構 配制終質量濃度分別為0 g/dL和5 g/dL乳酸鈉的BHI培養基,按1.2.1方法,于37℃培養48 h形成的生物被膜,參照文獻[7]方法并稍作改進。具體步驟如下:先將形成的生物被膜經PBS洗滌3次,以去除未附著的細胞;再用4%戊二醛溶液固定30 min,PBS溶液洗滌3 次,然后用預先配制好的 SYBRGreenI(1:500000)染料于暗室中染色30 min,最后用PBS溶液洗滌3次,以除去多余的染料。立即取片,在CLSM下觀察。
1.2.5 掃描電鏡 (Scanning electron microscopy,SEM)觀察生物被膜結構 配制終質量濃度分別為0 g/dL和5 g/dL乳酸鈉的BHI培養基,按1.2.1方法,于37℃下培養48 h形成生物被膜,參照文獻[7]方法并稍作改進。具體步驟如下:先將形成的生物被膜經PBS洗滌3次,以去除未附著的細胞;再用4%戊二醛溶液固定2 h。固定結束后,分別用體積分數為30%、50%、70%、90%、100%無水乙醇進行梯度脫水 (30%、50%、70%、90%無水乙醇依次脫水一次,每次10 min,100% 無水乙醇脫水2次),于室溫下過夜干燥,在SEM下觀察。
1.2.6 流式細胞儀(Flow cytometry,FCM)檢測生物被膜內細菌細胞膜完整性 配制終質量濃度分別為0 g/dL和5 g/dL乳酸鈉的BHI培養基,按1.2.1方法,于37℃下培養48 h形成的生物被膜。參照文獻[7]方法并稍作改進。具體步驟如下:先收集生物被膜菌體,用PBS洗滌一次,加入預冷的70%乙醇固定,置于4℃下固定2 h。離心棄去固定液,然后用PBS重懸5 min。重懸結束后,使用400目的篩網過濾一次,之后離心5 min,轉速為1 000 r/min,棄去PBS。最后加入終質量濃度為10 μg/mL的PI染液,置于4℃條件下避光染色30 min。染色結束后,立即使用流式細胞儀進行檢測。使用FlowJo 7.6軟件分析實驗結果,分析所得Mean值即為熒光信號強度。
1.2.7 總RNA的提取與反轉錄cDNA 菌體收集:按1.2.1方法,分別收集WaX12菌株于37℃培養48 h的浮游態菌體和生物被膜態菌體,用于總RNA的提取。RNA提取與反轉錄cDNA:利用動物總RNA快速提取試劑盒(Trizol-離心柱型)試劑盒操作步驟提取總RNA,貯存在-80℃冰箱。RNA的濃度采用BioTek酶標儀測定,完整性通過1%的瓊脂糖凝膠電泳檢測。每個樣品中200 ng總RNA用于反轉錄,反轉錄反應按試劑盒說明書操作,產物cDNA置于-20℃備用。
1.2.8 熒光實時定量PCR(qRT-PCR) 選擇了與鞭毛合成及運動相關的基因 flgE、motB、degU及mogR;主要毒力調控因子prfA、熱激蛋白轉錄因子dnaK[10]及主要壓力應答因子sigB[11]。引物由上海生工生物有限公司合成,序列見表1。2-ΔΔCT方法用于比較不同樣本之間基因的表達量變化。Gap作為管家基因[12]。利用 FastStart Universal SYBR Green Master(ROX)方法進行熒光實時定量PCR。應用7500 Fast Real-Time PCR System擴增儀操作。不含cDNA模板的體系作為陰性對照。做三次獨立的實驗,每個樣品做3個平行。
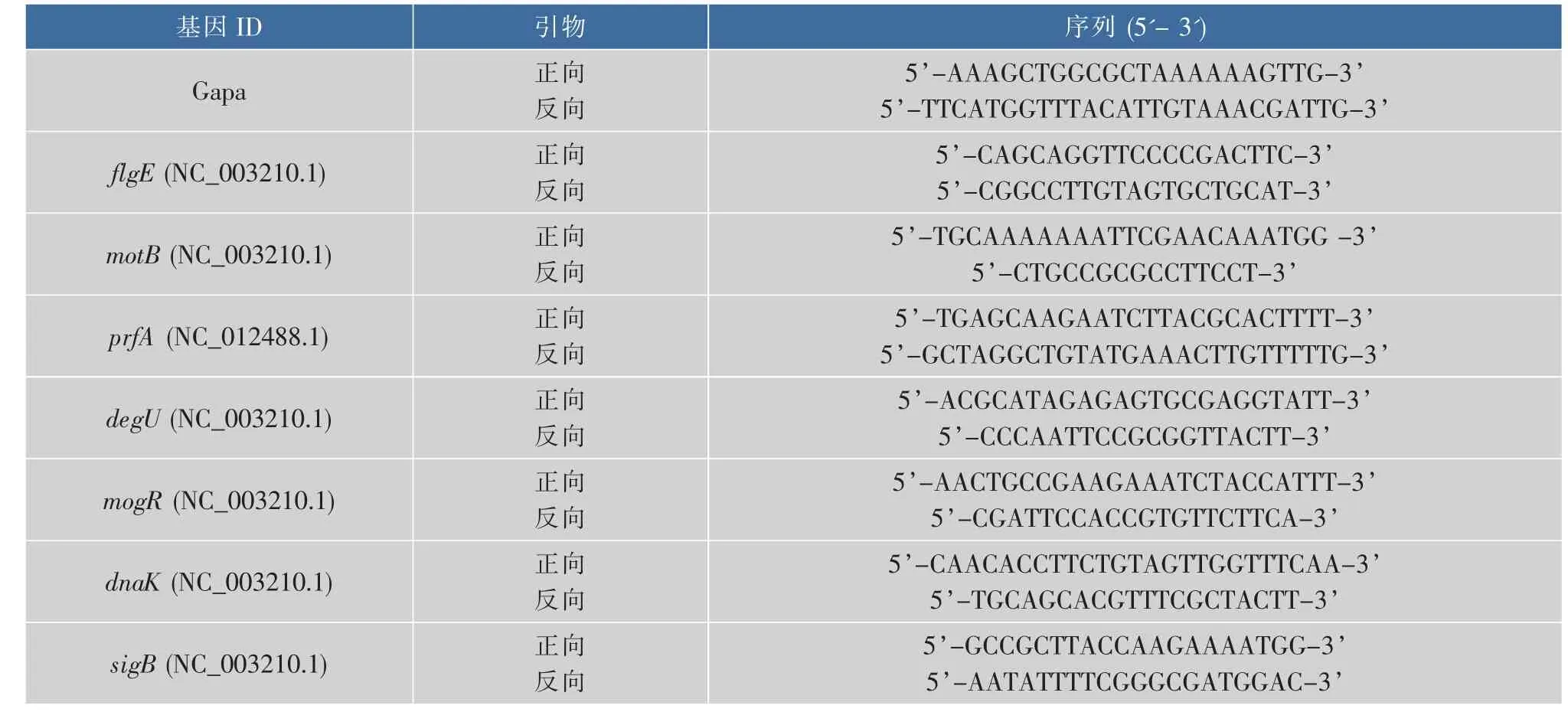
表1 熒光實時定量RT-PCR基因引物序列Table 1 List of primer sequences used in qRT-PCR
1.3 數據處理
采用Origin 8.0、SPSS17.0軟件處理,對相關數據進行統計分析。
2 結果與討論
2.1 不同質量濃度乳酸鈉對單增李斯特菌WaX12生物被膜形成的影響
將不同質量濃度的乳酸鈉(0、2.5、5、10、20 g/dL)處理單增李斯特菌WaX12,48 h后采用結晶紫法測定生物被膜的形成情況,結果見圖1。結果表明,相比于對照組,質量濃度為2.5、5、10、20 g/dL的乳酸鈉對單增李斯特菌WaX12生物被膜的抑制率分別為 8.34%(p<0.05)、32.2%(p<0.01)、46.6%(p<0.01)和55.2%(p<0.01)。可見,乳酸鈉可有效抑制單增李斯特菌WaX12生物被膜的形成。
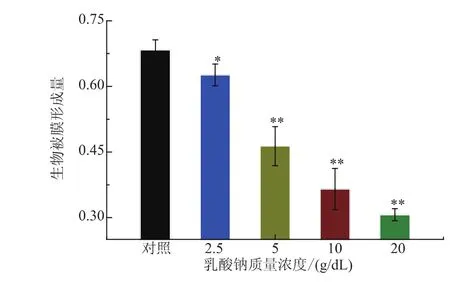
圖1 不同質量濃度乳酸鈉對單增李斯特菌WaX12生物被膜形成的影響Fig.1 Effets of sodium lactate at different concentrations on L.monocytogenes biofilm formation
2.2 顯微鏡觀察乳酸鈉對單增李斯特WaX12生物被膜結構的影響
為進一步研究乳酸鈉對單增李斯特菌生物被膜形成的抑制效果,選取5 g/dL乳酸鈉處理單增李斯特菌WaX12進行后續研究。首先,利用CLSM與SEM觀察其在37℃下培養48 h后的生物被膜結構,結果見圖2。觀察圖2(a)可知,與對照組相比,經5 g/dL乳酸鈉處理之后的生物被膜密度顯著降低。未經乳酸鈉處理的對照組生物被膜的厚度為28.70 μm,而5%乳酸鈉處理組生物被膜的厚度顯著減少,降至15.19 μm。此外,進一步通過SEM觀察WaX12菌株生物被膜的超顯微結構,結果發現對照組可形成立體且致密的成熟生物被膜結構,而5 g/dL乳酸鈉處理組的生物被膜結構明顯變稀疏,由小菌落相互交聯而成。以上結果表明,5 g/dL乳酸鈉可有效抑制單增李斯特菌WaX12生物被膜的形成,與上述結晶紫定量結果相一致。
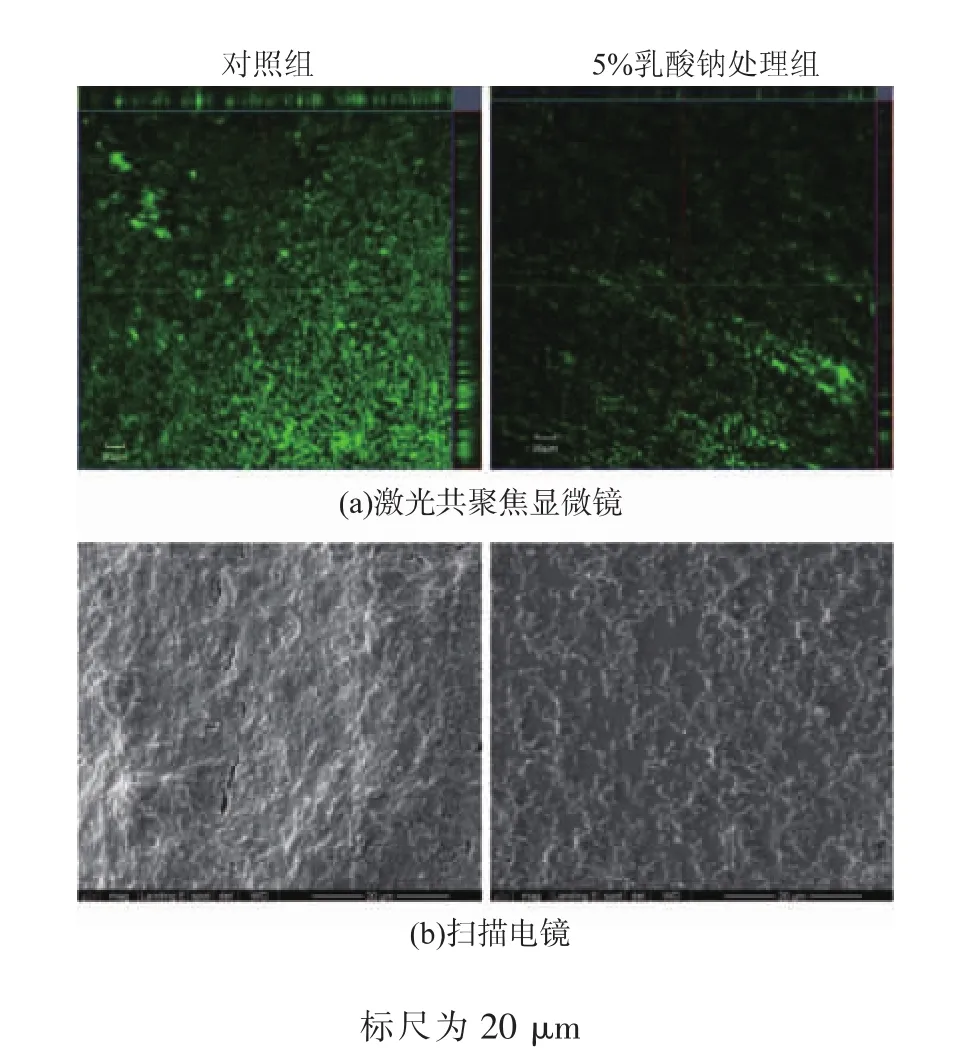
圖2 顯微鏡觀察5 g/dL乳酸鈉對單增李斯特菌WaX12生物被膜結構的影響Fig.2 CLSM and SEM images of biofilms formed by L.monocytogenes with 5%sodium lactate(right) and without(left)
2.3 乳酸鈉對單增李斯特菌WaX12生物被膜胞外多糖及胞外蛋白質形成的影響
細菌在形成生物被膜的過程中,其分泌的胞外物質主要為胞外多糖和胞外蛋白質。這些胞外物質不僅能增強微生物細胞對外界環境因素的抵抗能力,而且在細胞初始粘附及維持生物被膜穩定中起著關鍵作用。因此,研究了5 g/dL乳酸鈉對單增李斯特菌WaX12生物被膜胞外多糖及蛋白形成的影響,結果見圖3。從圖3可以看出,經5 g/dL乳酸鈉處理之后,胞外多糖及蛋白質的相對含量均顯著降低(p<0.01);與對照組相比,胞外多糖的相對含量降低了33.9%,而胞外蛋白質的相對含量降低了56.1%。可見,乳酸鈉對胞外蛋白質形成的抑制效果更明顯。綜上所述,乳酸鈉可有效抑制單增李斯特菌WaX12胞外物質的形成,從而降低了其生物被膜的形成。
圖3 乳酸鈉質量濃度對單增李斯特菌WaX12生物被膜胞外多糖及蛋白質形成的影響Fig.3 Polysaccharidesand extracelluar proteinsin biofilm of WaX12 with 5%sodium lactate and without
2.4 乳酸鈉對單增李斯特菌WaX12生物被膜內細菌細胞活性的影響
利用MTT法檢測5%乳酸鈉對單增李斯特菌WaX12生物被膜內細菌細胞活性的影響,結果見圖4。經5 g/dL乳酸鈉處理之后,單增李斯特菌WaX12生物被膜內細菌細胞活性顯著降低(p<0.01),且抑制率達到56.4%,可進一步表明其抑制WaX12菌株生物被膜形成的效果顯著。
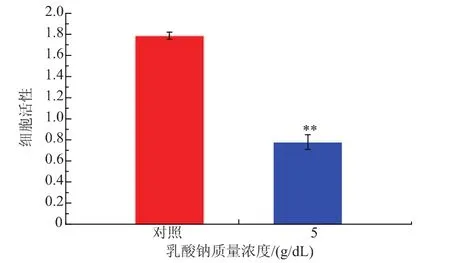
圖4 乳酸鈉質量濃度對單增李斯特菌WaX12生物被膜內細菌細胞活性的影響Fig.4 Effects of sodium lactate on viable cells in biofilm of WaX12 with 5%sodium lactate and without
2.5 乳酸鈉對單增李斯特菌WaX12生物被膜內細菌細胞膜完整性的影響
利用流式細胞儀檢測5 g/dL乳酸鈉對單增李斯特菌WaX12生物被膜內細菌細胞膜完整性的影響,結果見圖5。經5 g/dL乳酸鈉處理的WaX12菌株生物被膜內細菌細胞PI信號峰發生右移,信號強度顯著增大(圖5(c))。可見,乳酸鈉可顯著降低WaX12菌株生物被膜內細菌細胞膜的完整性,從而抑制其生物被膜的形成。
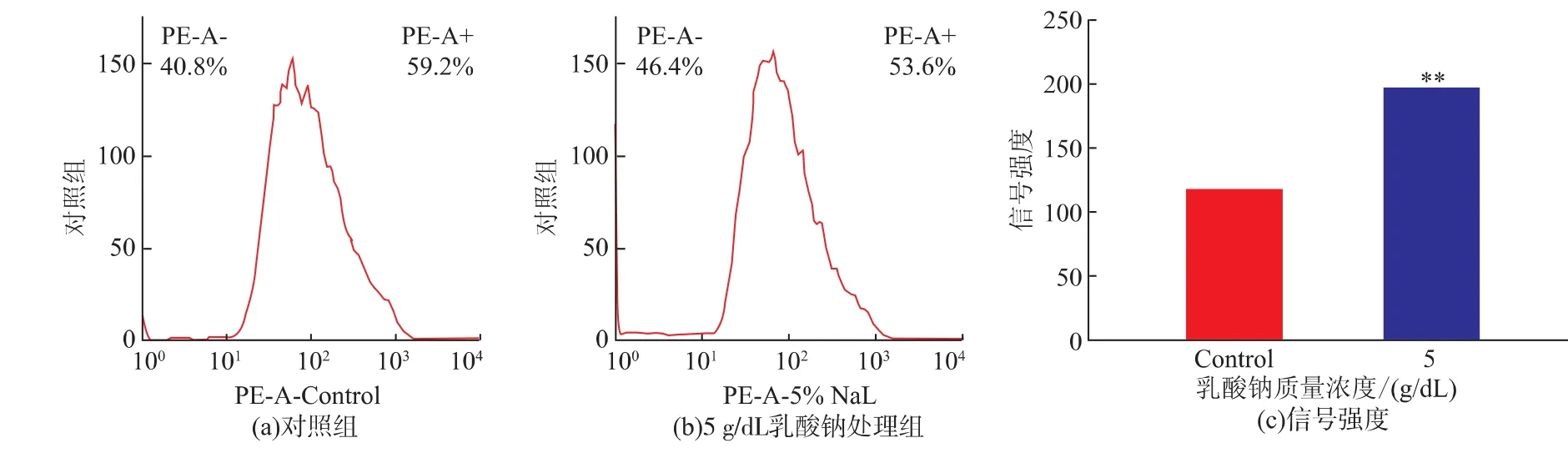
圖5 流式細胞儀分析乳酸鈉對單增李斯特菌WaX12生物被膜內細菌細胞膜完整性的影響Fig.5 Flow cytometry analysis of effects of Sodium lactate on membrane integrity of L.monocytogenes biofilm cells
2.6 乳酸鈉對單增李斯特菌WaX12生物被膜相關基因表達量的影響
采用熒光實時定量PCR法測定了單增李斯特菌WaX12生物被膜相關基因的mRNA表達水平,見圖6。從圖6可以看出,與對照組相比較,經5 g/dL乳酸鈉處理過的生物被膜狀態下的WaX12菌株,一些與生物被膜相關的基因表達量下調,主要為鞭毛合成及運動相關基因 motB、mogR、degU、flgE;熱激蛋白轉錄因子dnaK及主要毒力調控因子prfA。實時定量PCR結果表明,乳酸鈉可通過下調單增李斯特菌WaX12生物被膜相關基因的表達以抑制其生物被膜的形成。
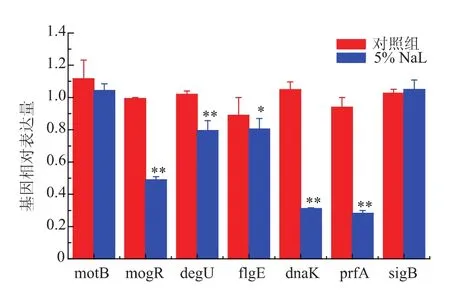
圖6 乳酸鈉對單增李斯特菌WaX12的生物被膜相關基因表達量的影響Fig.6 Effects of Sodium lactate on expression of biofilmassociated genes in L.monocytogenes WaX12 biofilm cells
3 結語
乳酸鈉作為一種常見防腐劑可抑制多種腐敗菌和致病菌的生長,其在減少胴體污染、降低細菌總數方面具有明顯的效果[13]。細菌生物被膜是細菌為適應自然環境的一種生命現象,生物被膜態的細菌具有極強的抗藥性、抗吞噬及抗趨化作用,普通的清洗和消毒無法達到除菌的效果[14]。因此,如何控制食品產業中細菌生物被膜的形成變得尤為重要。目前,國內外研究乳酸鈉對細菌生物被膜的作用尚未見報道,尤其對乳酸鈉作用機理以及應用方面仍有待研究。
單增李斯特菌易在食品加工材料表面聚集形成生物被膜,與浮游菌相比,其生物被膜內細菌對外界的環境刺激敏感性顯著降低,尤其是對抗菌劑的敏感性[15]。早期研究發現,作為生物被膜骨架的EPS是微生物自身代謝產物,是構成生物被膜三維結構的關鍵因子[16-17]。胞外多糖及胞外蛋白質在細胞初始粘附及維持生物被膜穩定中起著關鍵作用,Sutherland[18]等研究混合菌屬生物被膜結構發現,只要存在能合成胞外多糖的微生物菌屬,就能形成成熟穩定的生物被膜,而Branda[19]等研究表明,假單胞菌細胞結合型胞外蛋白CdrA可促進更多的細胞與胞外多糖結合,從而加快其生物被膜的形成。作者研究了5 g/dL乳酸鈉對其生物被膜胞外多糖及胞外蛋白質形成的影響,發現其相對含量分別降低了33.9%(p<0.01)和 56.1%(p<0.01);同時,顯微鏡觀察結果表明,單增李斯特菌在該NaL質量濃度處理下無法形成成熟穩定的生物被膜結構;與對照組相比,其生物被膜結構明顯稀疏,由微菌落交聯而成,且厚度減少了47.1%(p<0.01)。由上述結果可知,乳酸鈉能夠通過降低單增李斯特菌生物被膜胞外多糖和胞外蛋白質的形成以抑制其新生物被膜的形成。根據本研究使用MTT法檢測單增李斯特菌生物被膜內細菌的細胞活性,該方法能夠檢測到生物被膜深部較低密度細菌的活性,具有操作簡便、經濟、靈敏度高等優點[20]。我們發現,5 g/dL乳酸鈉可顯著降低單增李斯特菌生物被膜內細菌的細胞活性,其抑制率達到56.4%(p<0.01),可見其對單增李斯特菌生物被膜形成的抑制效果顯著。利用流式細胞儀技術評價了該質量濃度下的乳酸鈉對單增李斯特菌生物被膜內細菌細胞膜完整性的影響。熒光染料PI(碘化丙啶)是一種可用于DNA染色的細胞核染色試劑,雖然不能通過活細胞膜,但能穿過破損的細胞膜而對核染色[21]。結果顯示,經 5 g/dL乳酸鈉處理的單增李斯特菌生物被膜內細菌細胞膜的完整性顯著降低。根據上述結果可知,乳酸鈉可抑制膜內細菌細胞活性及破壞細胞膜的完整性,從而抑制新生物被膜的形成。
研究表明,細菌粘附貫穿在整個生物被膜系統的不同階段,菌體的粘附能力可能決定著生物被膜持續形成和發展的命運[22]。Lemon[23]等研究發現,在單增李斯特菌細胞初始粘附階段,鞭毛運動對生物被膜的形成起著至關重要的作用。在研究乳酸鈉對單增李斯特菌生物被膜相關基因表達量影響的實驗中發現,經5 g/dL乳酸鈉處理后,與鞭毛合成及運動相關的基因 motB、mogR、degU、flgE表達量均出現了下調。鞭毛的趨化運動可使浮游的單增李斯特菌向有營養物質的表面游動,增強細菌與接觸表面的粘附性,從而有助于細菌形成結構穩定的生物被膜[24]。近年來,研究主要毒力基因prfA在單增李斯特菌生物被膜形成過程中的調節機制也是一大熱點,這對于揭示其致病原理具有重要的意義。目前,已有大量研究證明轉錄調節子prfA是正向調控單增李斯特菌生物被膜形成的因子之一,并且發現單增李斯特菌的絕大多數毒力基因的轉錄表達都受到prfA的調控[25]。張強等[26]通過比較野生型菌株EGD、prfA基因突變型菌株生物被膜形成能力的差異,發現與EGD株相比,prfA基因突變型菌株形成生物被膜的能力明顯降低。相比于對照組,我們發現5%乳酸鈉可顯著降低毒力基因prfA的表達水平。此外,已有研究表明,熱激蛋白轉錄因子dnaK也可促進單增李斯特菌生物被膜的形成;同樣,經5 g/dL乳酸鈉處理之后,其表達量顯著降低。綜上所述,我們推測乳酸鈉可能通過下調這些與生物被膜相關基因的表達,從而在一定程度上抑制生物被膜的形成,但其具體的抑制機理仍需進一步的研究。
本研究首先采用結晶紫染色法考察了不同濃度(0、2.5、5、10、20 g/dL)乳酸鈉對單增李斯特菌生物被膜形成的抑制效果,發現其抑制率分別為8.34%、32.2%、46.6%、55.2%。進一步研究5 g/dL乳酸鈉抑制單增李斯特菌生物被膜形成的抑制作用,結果發現,經5 g/dL乳酸鈉處理后,單增李斯特菌生物被膜結構明顯稀疏,且厚度減少;該質量濃度下的乳酸鈉可顯著降低生物被膜胞外多糖和胞外蛋白質的形成,同時抑制膜內細菌細胞活性及降低細胞膜的完整性。最后,實時定量PCR結果表明,乳酸鈉可通過下調單增李斯特菌生物被膜相關基因的表達以抑制其生物被膜的形成。乳酸鈉作為常用防腐劑以有效抑制單增李斯特菌生物被膜的形成,具有極高的潛在應用價值。

