基于二次發酵酵母活力確定乙醇分批補料發酵最佳補料時間
柯善恢, 伍時華, 趙東玲, 張 健, 黃翠姬
(廣西科技大學 生物與化學工程學院,廣西 柳州545006)
關鍵字:二次發酵酵母活力;乙醇分批補料發酵;補料時間
甘蔗富含蔗糖、葡萄糖和果糖,價格低廉,不占用耕地,是燃料乙醇理想的糖質原料,而燃料乙醇被視為最清潔的能源之一[1,3]。甘蔗汁(糖質量濃度140 g/L左右)直接發酵酒度偏低,不利于工業化生產,希望通過補加糖蜜提高初始糖質量濃度(220 g/L左右),然后在酵母活力高的時間點繼續補加糖蜜提高最終酒度,但是甘蔗糖蜜對發酵抑制作用大,補料需在酵母活力高的時候進行。與分批發酵相比,補料發酵有多方面的優勢,可以解除高濃度基質對生產菌株的抑制作用[4],也可延長細胞穩定期而獲得更多的目的產物,對生產高濃度乙醇具有重要的意義。但由于發酵過程的復雜性,補料時機和補料策略都難以確定[5]。目前研究較多的補料策略主要是通過建立模型的方法來優化補料控制,如模糊模式識別法[6]、神經網絡辨識法[7]、動力學模型與遺傳算法聯用[8]、動力學模型與擴大功能的拉格朗日算法聯用[9]和補料反饋控制模型法[10]等,這些方法都建立在對發酵過程的數學模擬上,并未以酵母本身屬性為出發點。酵母活力是高濃度乙醇發酵成敗的關鍵因素之一[11],酵母活力可能會影響補料時間,是補料流加時間的一個重要指標。
用YPDF模擬甘蔗汁和甘蔗糖蜜培養基,將乙醇分批發酵不同時間點酵母等量轉接入新鮮發酵培養基中,在相同條件下接種相同數目酵母進行二次發酵,比較各時間點二次發酵酵母活力強弱,然后以二次發酵酵母活力為基礎,進行乙醇分批補料發酵試驗,以驗證二次發酵酵母活力與補料時間關系,試圖為乙醇補料分批發酵建立一種新的流加時間確定策略。
1 材料與方法
1.1 實驗材料
1.1.1 菌株 乙醇酵母 (Saccharomyces cerevisiae)GJ2008由廣西科技大學發酵工程研究所保藏。
1.1.2 培養基 斜面培養基與種子培養基:參見左松方法[15]。發酵培養基:配置初始總糖質量濃度為140、180、220、260 g/L 的發酵培養基(添加糖為葡萄糖與果糖,各占50%),酵母浸膏、蛋白胨及pH條件與種子培養基相同,上速培養基的裝液量都為200 mL/瓶。將20 g糖 (添加糖為葡萄糖與果糖,各占50%)裝入三角瓶滅菌。主發酵培養基的初始總糖質量濃度為220 g/L,裝液量為300 mL。以上培養基都采用蒸汽滅菌法(115℃滅菌20 min)。
1.1.3 種子培養方法 斜面種子經恒溫活化,接入一級種子培養基中,培養方法參見左松方法[16],將二級種子液離心后,用無菌水將酵母泥振蕩均勻制成10倍濃縮菌懸液,備用。
1.1.4 乙醇發酵方法 乙醇分批發酵方法:將二級種子10倍濃縮菌懸液按1%的接種體積分數接入發酵培養基中,用透氣膜和牛皮紙包扎封瓶口,搖床120 r/min,32℃條件下發酵,進行不同初總糖質量濃度發酵試驗和220 g/L總糖主發酵試驗。
二次發酵方法:于主發酵培養基中每隔6小時取樣一次,離心制成濃縮菌懸液(2 mL),接入二次發酵培養基。取出的主發酵液體積0 h時為200 mL,并進行細胞計數,細胞濃度為N0,主發酵其它時間點細胞濃度記為 N6、N12、N18、N24、N30、N36,則主發酵各時間點取出主發酵液體積為200/(Ni/N0)mL,以此保證二次發酵接種酵母數相同。用透氣膜和牛皮紙包扎封瓶口,搖床轉速與溫度同乙醇分批發酵。發酵過程中每6小時取一次樣,每組試驗兩個平行,所得結果為平均值。
乙醇補料分批發酵方法:將二級種子10倍濃縮菌懸液按 1%的接種體積分數接入發酵培養基中,用透氣膜和牛皮紙包扎封瓶口,搖床轉速與培養溫度均與乙醇分批發酵相同。在12、18、24、30、36 h時將發酵液倒入裝有葡萄糖和果糖的500 mL三角瓶中振蕩溶解,所有操作均在無菌環境下進行。整個發酵過程每6小時取樣,每組試驗三個平行,所得結果為平均值。
1.2 檢測方法
總糖的測定:使用SGD-IV還原糖測定儀測定;細胞存活率測定:亞甲基藍法[12];乙醇質量濃度測定:用氣相色譜儀測定發酵過程中乙醇質量濃度。采用裝FID檢測器的氣相色譜儀和T2100P色譜工作站,用面積外標法分析乙醇質量濃度。色譜條件見文獻[13];發酵最終乙醇質量濃度用蒸餾法測定。
1.3 糖代謝曲線分析
曲線下面積采用GraphPad Prism 5計算。
1.4 數據處理方法
運用Origin9.0軟件對發酵數據處理并作圖,數據處理按蔣凱所述方法計算[13]。
2 結果與討論
2.1 乙醇補料分批發酵最佳初糖質量濃度的選擇
由表1可知,初總糖質量濃度為140 g/L時,乙醇產率和總糖發酵效率高,殘糖少,但初總糖質量濃度太低,發酵后期需要補加高質量濃度的糖發酵液才能達到產高質量濃度乙醇的要求;初總糖質量濃度為260 g/L時,乙醇產率小,總糖發酵效率低,殘糖質量濃度較高,不適合作為補料發酵初始糖質量濃度;在220 g/L左右時乙醇產率、總糖發酵效率綜合較高,后期補料壓力相對小。乙醇補料分批發酵初總糖偏高會抑制酵母活力[4],殘糖多;偏低會導致設備利用率低,后期補糖質量濃度高等問題,因此選擇一個酵母不受抑制且盡可能高的初始糖質量濃度對分批補料發酵有重要意義。所以本實驗初總糖質量濃度設定在220 g/L左右。
由圖1可知,主發酵過程0~12 h糖消耗速率最大,為(9.53±0.02) g/(L·h),酵母數量增長最快,乙醇產率也最大,為(3.79±0.01) g/(L·h),酵母發酵初期的指數級生長表明酵母受糖抑制作用小;30~36 h糖消耗速率僅為 0.17 g/(L·h),發酵基本結束。以 0~12 h乙醇產率/糖消耗速率 (即乙醇對耗糖產率)值為標準,此后每6小時占標準比分別為104.49%、154.22%、116.01%和0%,可知隨著糖消耗速率和乙醇產率的下降,每克糖所產的乙醇卻在增加,說明發酵后期酵母仍具有較高的發酵活力,只因糖被消耗完而乙醇質量濃度不再增加,并非酵母沒有發酵能力,發酵后期仍可進行補料。要弄清何時適合補料,需要知道發酵過程的酵母活力。
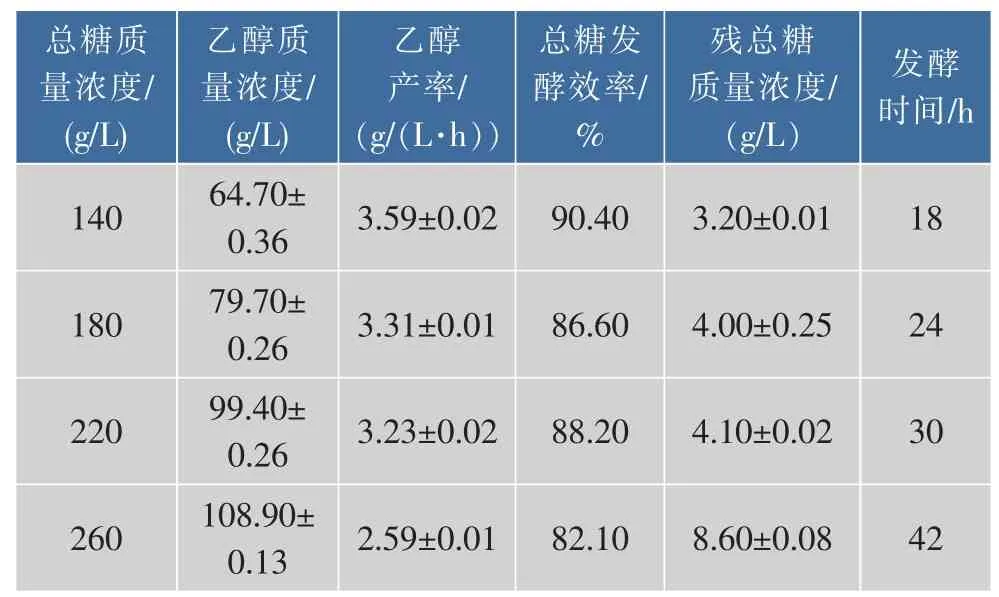
表1 不同總糖質量濃度乙醇分批發酵主要參數Table 1 Main parameters of the ethanol batch fermentation by S.cerevisiae strain GJ2008 at different total sugar concentration
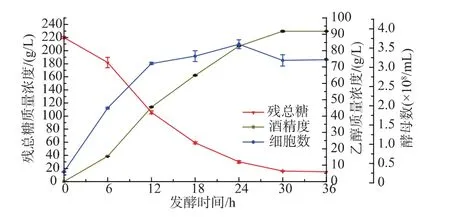
圖1 初總糖質量濃度為220 g/L時的乙醇分批發酵過程曲線Fig.1 Profiles of residual sugars,biomass concentration and ethanol during the ethanol fermentation with 220 g/L initial sugar
2.2 根據二次發酵酵母活力選擇最佳補料時間
酵母活力包括酵母的細胞活性和發酵能力,二次發酵酵母活力反映的是主發酵不同時間點的酵母活力。作者從乙醇分批發酵的二次發酵酵母細胞活性、糖代謝和乙醇生成能力綜合分析酵母活力強弱。
2.2.1 二次發酵酵母細胞活性分析 酵母細胞活性從細胞總數和活細胞數兩方面考察。如圖2所示,主發酵不同時間點(0、6、12、18、24、30、36 h)取樣酵母的二次發酵細胞生長趨勢基本一致。酵母細胞數AUC可以整體的評價細胞生長狀況[14-16],AUC越大細胞生長越快,由表2可知,0~30 h主發酵取樣酵母的二次發酵細胞數AUC相差不大,36 h取樣酵母細胞數AUC偏小,說明36 h取樣酵母生長情況比其他取樣點差,主要原因可能是主發酵36 h酵母已經進入衰亡期,重新接種到新培養基的酵母生長遲緩。各個時間點取樣酵母最終細胞數保持在相近水平,差別不大。如圖3和表2所示,主發酵各時間點取樣酵母的二次發酵酵母存活率很高,死亡細胞比較少,其中24 h取樣酵母整個發酵過程幾乎沒有死亡細胞,細胞數AUC與活細胞AUC之差最小,說明24 h取樣酵母的細胞活性最高。細胞活性表示的是酵母生長狀況,要知道酵母活力還需分析酵母的發酵能力。
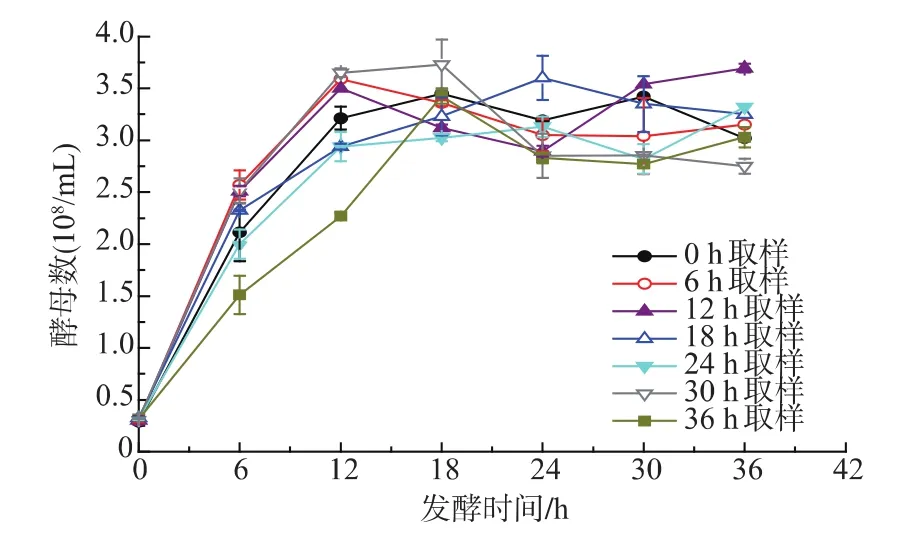
圖2 主發酵不同時間取樣酵母的二次發酵細胞生長曲線Fig.2 Profiles of biomass growth during the secondary fermentation by yeast sampling from the primary fermentation at different time
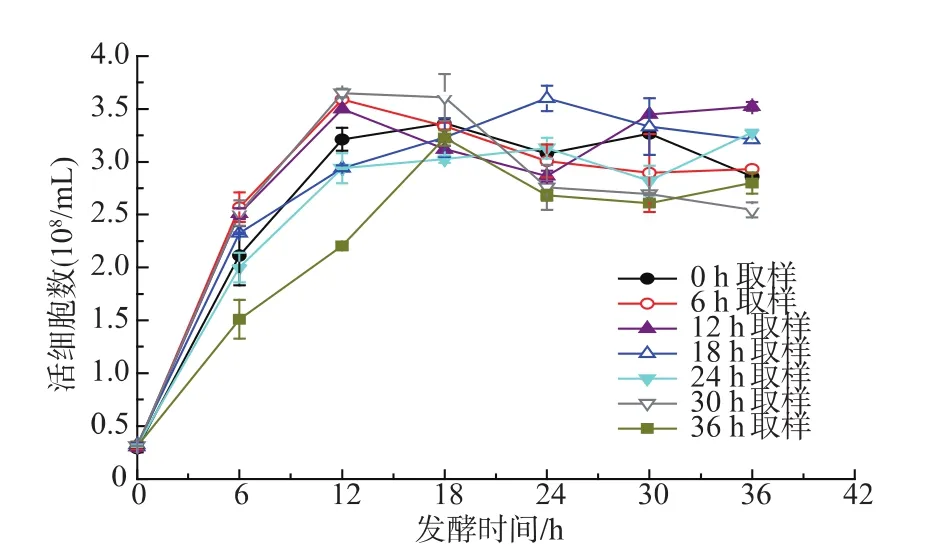
圖3 主發酵不同時間取樣酵母的二次發酵活細胞數Fig.3 Profilesofliving cellduring the secondary fermentation by yeast sampling from the primary fermentation at different time
2.2.2 二次發酵耗糖能力分析 如圖4-5所示,二次發酵在36 h內基本結束,在0~6 h時段,總糖消耗速率由 0、6、12、18、24 h 取樣酵母逐漸增大,24 h取樣酵母總糖消耗速率最大,為(10.98±0.29) g/(L·h),36 h 最小,為(7.2±0.09) g/(L·h);6~12 h 主發酵各時間點取樣,酵母的總糖消耗速率都達到最大值且開始趨于相同;12~18 h時段總糖消耗速率都減小。主要原因是主發酵各時間點取樣的酵母活力不同,使剛接種(0~6 h)的二次發酵酵母總糖消耗速率不同,經過適應期后酵母活力得到恢復,總糖消耗速率開始一樣(6~12 h),說明二次發酵初期酵母活力差異明顯。比總糖消耗速率表示單位活細胞量的總糖消耗速率,比總糖消耗速率越大表明單位活細胞的耗糖能力越強[13]。如圖6所示,二次發酵0~6 h時段各時間點取樣酵母的比總糖消耗速率由0 h取樣酵母到6 h取樣酵母略微減小,然后開始逐漸增大,24 h 取樣酵母達到最大值(9.49±0.15) g/(1011個活細胞·h),說明24 h取樣酵母單位活細胞量的耗糖能力最強。
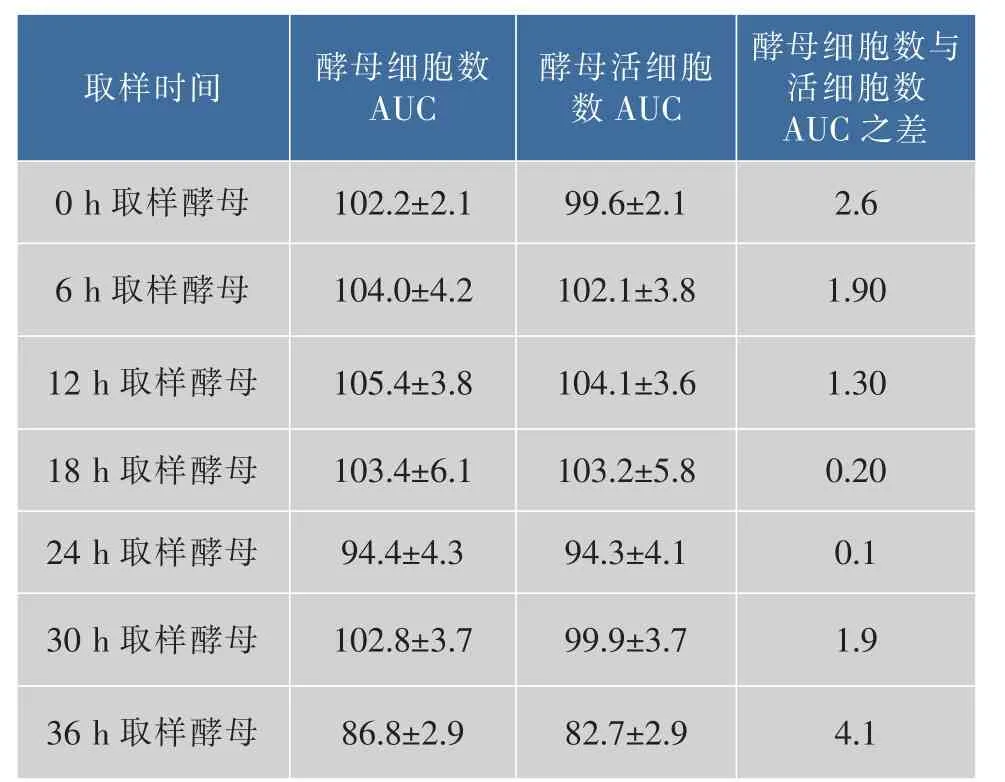
表2 主發酵不同時間取樣酵母的二次發酵細胞生長曲線下面積Table 2 Area under growth curves during the secondary fermentation at different time of the primary
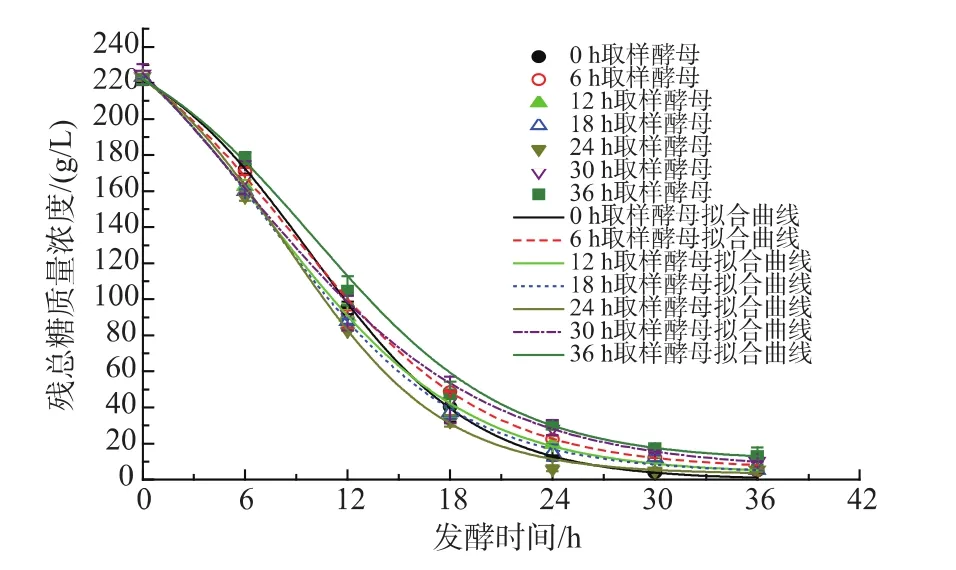
圖4 主發酵不同時間取樣酵母的二次發酵殘總糖代謝擬合曲線Fig.4 Fitted profiles of sugar metabolism during the secondary fermentation by yeast sampling from the primary fermentation at different time

圖5 主發酵不同時間取樣酵母的二次發酵總糖消耗速率Fig.5 Profiles of total sugar uptake rate during the secondary fermentation by yeast sampling from the primary fermentation at different time
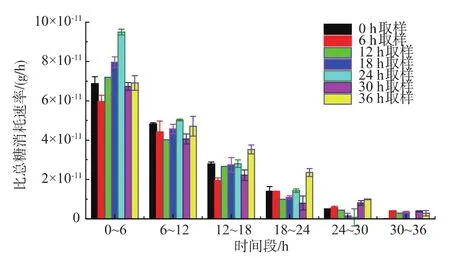
圖6 主發酵不同時間取樣酵母的二次發酵比總糖消耗速率Fig.6 Profiles of specific glucose uptake rate during the secondary fermentation by yeast sampling from the primary fermentation at different time
二次發酵殘總糖曲線下面積可以定量地表示酵母發酵活力的強弱[17],二次發酵殘總糖曲線下面積越小,酵母發酵活力越強;反之,二次發酵殘總糖曲線下面積越大,酵母發酵活力越弱。由圖7可知,24 h取樣酵母二次發酵殘總糖曲線下面積最小,為2 390.0±59.4,發酵活力最強,36 h取樣點曲線下面積最大,為2 972.0±3.5,發酵活力最弱。以24 h取樣酵母AUC為對照組AUC24h,各取樣點比值依次為1.10、1.15、1.09、1.07、1.00、1.17、1.24,30 h 取樣酵母AUC開始增大,30 h和36 h分別高出24 h取樣點17%和24%,酵母發酵活力變弱,所以24 h取樣酵母的發酵活力最強。
2.2.3 二次發酵乙醇生成能力分析 如圖8所示,主發酵各時間取樣酵母的二次發酵乙醇生成趨勢相同,乙醇生成曲線下面積可以整體的評價乙醇生成快慢[14],24 h取樣酵母的乙醇生成曲線下面積最大為2 703,說明24 h取樣酵母乙醇生成最快。由圖9可知,0~6 h時段各時間點乙醇生成速率趨勢與比總糖消耗速率一致,24 h取樣酵母乙醇生成速率最大, 為 (4.56±0.4) g/(L·h),36 h 取樣酵母最小,為(2.80±0.23) g/(L·h),說明 24 h 取樣酵母生成乙醇能力最強。比乙醇生成速率表示單位活細胞量的乙醇生成速率[13]。由圖10可知,0~6 h各時間點取樣酵母之間的趨勢與比總糖消耗速率和乙醇生成速率一致,24 h取樣點酵母細胞比乙醇生成速率最大,為(3.95±0.14)×10-11g/h,說明 24 h 取樣酵母單位活細胞量生成乙醇的能力最強。綜合0~6 h時段主發酵不同時間點各速率的趨勢,24 h取樣點酵母最高。
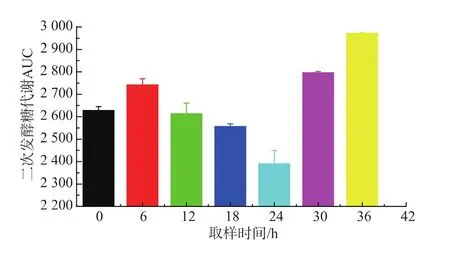
圖7 主發酵不同時間取樣酵母二次發酵殘總糖曲線下面積Fig.7 Area under the curve of residual sugar secondary fermentation by yeast sampling from the primary fermentation at different time

圖8 主發酵不同時間取樣的酵母二次發酵乙醇生成曲線Fig.8 Profiles of ethanol during the secondary ethanol fermentation by yeast sampling from the primary fermentation at different time
主發酵各時間點取樣酵母的二次發酵主要參數見表3。24 h取樣酵母二次發酵糖代謝曲線下面積、乙醇曲線下面積,乙醇質量濃度、乙醇產率、總糖發酵效率都是所有取樣酵母中最好的,18 h取樣酵母次之。綜合細胞活性,二次發酵初期酵母活力和二次發酵酵母發酵活力的趨勢,主發酵各時間點取樣酵母的二次發酵酵母活力強弱順序大致24、18、12、0、6、30、36 h,最適合的補料時間點為24 h。
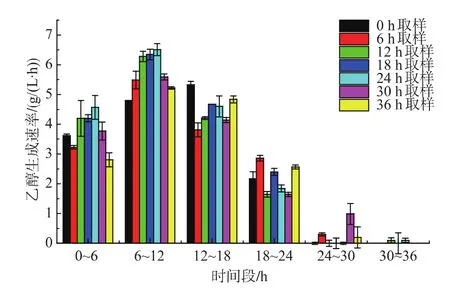
圖9 主發酵不同時間取樣酵母的二次發酵乙醇生成速率Fig.9 Profiles of ethanol production rate during the secondary fermentation by yeast sampling from the primary fermentation at different time
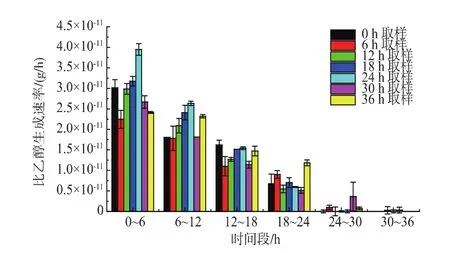
圖10 主發酵不同時間取樣酵母的二次發酵比乙醇生成速率Fig.10 Profiles of specific ethanol production rate during the secondary fermentation by yeast sampling from the primary fermentation at different time
2.3 乙醇補料分批發酵驗證試驗
在初總糖為220 g/L乙醇分批發酵基礎上以相同條件下于不同時間點一次補加100 g/L糖進行乙醇補料分批發酵,乙醇分批補料發酵主要發酵參數見表4。24 h補料發酵乙醇產率最高、總糖發酵效率最高、最終乙醇產率最高、殘糖最少和發酵周期最短,與之對應二次發酵酵母活力最強。發酵結果與二次發酵酵母活力強弱趨勢完全一致,二次發酵酵母活力最強的24 h補料效果最好,說明在初始總糖質量濃度為220 g/L時,選擇在24 h進行補料效果是最佳的。相反,二次發酵酵母活力最弱的36 h補料乙醇產率、總糖發酵效率和最終乙醇產率最低,發酵效率只有66.10%,所剩殘總糖質量質量濃度最高為84.8 g/L,發酵周期長,很多殘糖沒被利用,不適合補料。
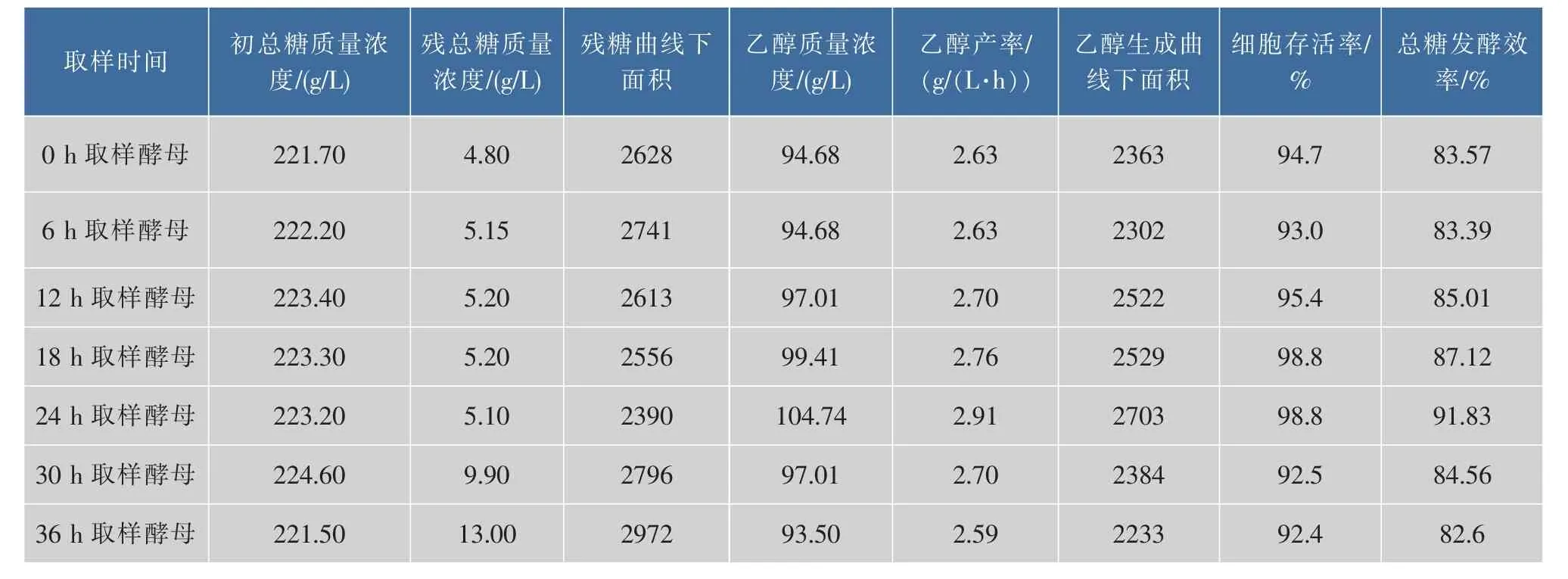
表3 主發酵不同時間取樣酵母的二次發酵主要參數Table 3 Main parameters of the secondary fermentation by S.cerevisiae strain at different time from the primary fermentation
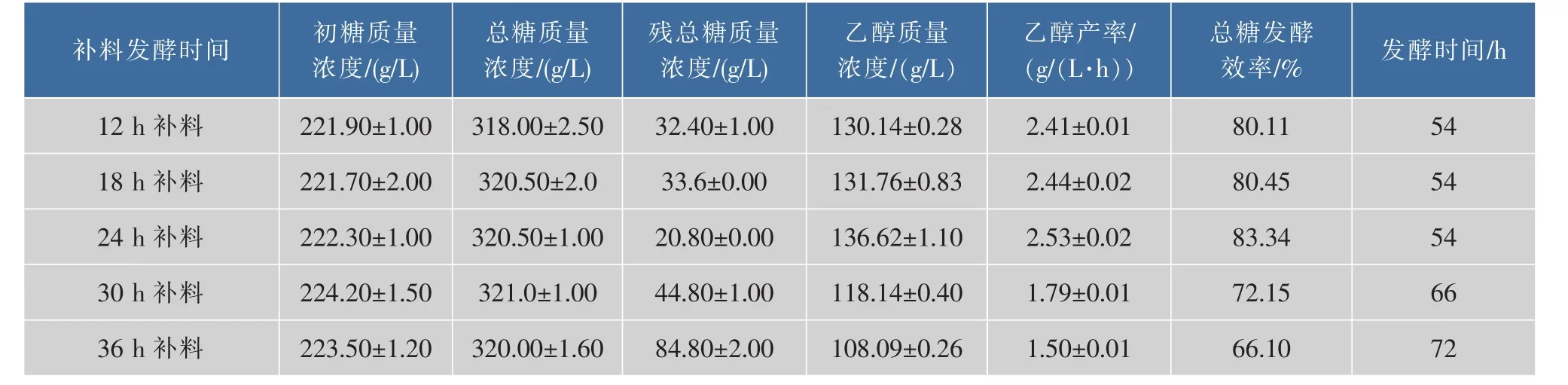
表4 補料發酵實驗主要參數Table 4 Main parameters of the feeding fermentation by S.cerevisiae GJ2008 at different time
3 結 語
以主發酵不同時間取樣酵母的二次發酵酵母活力作為確定乙醇分批補料發酵流加時間的指標。結果表明:二次發酵酵母活力強弱反映了所對應的主發酵取樣時間點酵母活力,在二次發酵酵母發酵活力最強所對應的主發酵時間點(24 h)補料,主發酵效果最好。作者以二次發酵酵母活力作為流加指標為乙醇分批補料發酵建立了一種新的流加時間確定策略。該流加時間確定策略缺點是費時,必須進行二次發酵,分析得到二次發酵酵母活力,以此反映主發酵不同時間點的酵母活力,但是如果乙醇分批發酵(主發酵)參數固定,該方法不失為一種簡單有效的流加時間確定策略。此方法也可推廣到其他類似細胞的補料時間確定上,具有廣泛實用性。

