正己烷在Pt/HBeta催化劑上的異構化反應動力學模型
張孔遠, 肖常林, 劉晨光
(中國石油大學(華東) 重質油國家重點實驗室CNPC催化重點實驗室,山東 青島 266580)
中國機動車已于2017年1月1日全面采用國Ⅴ車用燃料標準(GB 17930—2013),要求車用汽油的硫質量分數低于10 μg/g,芳烴和烯烴的體積分數分別低于40%和24%。于2019年1月1日起全面實施更為嚴苛的國Ⅵ A車用燃料標準(GB 17930—2016),要求車用汽油中芳烴和烯烴的體積分數分別低于35%和18%[1]。輕質烷烴(C5/C6烷烴)異構化產品具有無硫、無烯烴和芳烴,辛烷值高的特點,是一種理想的清潔汽油調和組分[2]。
目前,工業上C5/C6烷烴異構化催化劑均為含貴金屬的雙功能催化劑,按載體的不同主要分為3類:Pt/Cl-Al2O3型、Pt/分子篩型和Pt/SO4-ZrO2型。3種催化劑各有優缺點,在目前成熟的工藝中都有應用。分子篩型催化劑憑借耐用、可再生、對毒物耐受高的優勢在工業上應用最為廣泛。Matsuda等[3]研究了多種類型的Pt/分子篩催化劑的催化性能后,發現Pt/HBeta催化劑在異構化率和雙支鏈異構體的選擇性上有明顯優勢。
正己烷臨氫異構化反應是輕烴異構化典型的模型反應,很多學者對其在不同催化劑上的反應機理及動力學進行了研究[3-8]。雙功能催化機理,即催化劑上的金屬中心和酸中心協同催化,更適用于解釋C5/C6烷烴異構反應進程,并在此基礎上提出了各類復雜程度不同的動力學模型。劉雪暖等[6]在210~250 ℃、1.0~3.0 MPa、質量空速0.5~2.5 h-1及氫/烴摩爾比10~40的條件下,對Ni/HM催化劑上異構化動力學進行研究,將異構化反應速率歸結為溫度和壓力的函數,并使用Langmuir-Hinshelwood的方法建立了雙位反應動力學模型;朱澤霖等[7]考察了己烷的5種異構體在Pd質量分數為0.5%的Pd/HM催化劑上的臨氫異構化反應,建立了擬一級復雜反應網絡,并求得各個子反應的速率常數。Toch等[8]采用系統化的方法探究了正己烷在Pt質量分數為0.98%的Pt/HZSM-5催化劑上的異構化反應,重點考察了正己烷通過PCP(Protonated cyclopropyl)歧化生成2-甲基戊烷、3-甲基戊烷以及2種異構體裂化生成丙烷的過程,建立起簡單反應網絡模型,并通過回歸的方法求得動力學參數。上述這些模型的基礎假設都是擬一級動力學反應規律。
筆者采用自制Pt/HBeta催化劑,在不同反應條件下進行了正己烷異構化反應評價,建立擬一級動力學模型和連串反應動力學模型,求得相應模型的參數,并對270 ℃和280 ℃下的異構化反應級數進行修正,進一步解釋了反應溫度較高時正己烷異構化反應進程的變化,有助于在進一步降低反應溫度的基礎上提高其異構化性能,也為以后建立Pt/HBeta 催化劑擴散-反應模型和BP神經網絡預測模型奠定基礎。
1 實驗部分
1.1 試劑
正己烷、氯鉑酸(H2PtCl6·6H2O)、HCl、HNO3,均為分析純,國藥集團化學試劑有限公司產品;HBeta分子篩,n(SiO2)/n(Al2O3)=40, 南開大學催化劑廠產品;氫氧化鋁干膠,山東煙臺恒輝化工有限公司產品。
1.2 HBeta分子篩物化性質
實驗用HBeta分子篩是一種三維十二元環孔結構的微孔高硅沸石,具有2個四元環和4個五元環的雙六元環單位晶穴結構;孔徑尺寸介于ZSM-5型分子篩和Y型分子篩之間,主孔道直徑0.56~0.75 nm;HBeta分子篩對正己烷的吸附量較大,且自身的酸性以及合適的孔體積可以促進異構化反應的進行。
1.3 催化劑的制備
將n(SiO2)/n(Al2O3)=40的HBeta分子篩和氫氧化鋁干膠按照7∶3的質量比混合均勻,在單螺桿擠條機混捏成型,制得催化劑載體,再采用等體積浸漬法將氯鉑酸負載于載體上,于120 ℃干燥6 h,500 ℃下焙燒4 h,得到Pt質量分數0.4%的Pt/HBeta催化劑。
1.4 催化劑的活性評價
采用10 mL連續固定床反應器進行正己烷的臨氫異構化反應,將實驗所用催化劑裝填在反應器中段,上下兩段裝填粒徑380~830 μm目的潔凈石英砂,同時在兩端加封石英紗布。以正己烷為反應原料,在反應壓力1.5 MPa、V(H2)/V(C6)=500、 質量空速1.0~4.0 h-1、反應溫度240~280 ℃條件下進行異構化反應。原料和異構化產物采用安捷倫公司的6820型氣相色譜儀進行分析,檢測器為氫火焰離子化檢測器(FID),色譜柱為毛細管柱,峰面積歸一化結果作為烴類質量組成的數據。
催化劑性能的評價指標為:正己烷的轉化率(X)、正己烷的異構化率(Y)和正己烷的選擇性(S),計算公式見式(1)~(3)。
(1)
(2)
(3)
式(1)~(3)中,mfeed(n-C6)、mproduct(n-C6)分別為原料和產品中的正己烷的質量,g;mproduct(i-C6)和mproduct(2,2-DMB)分別為產品中己烷異構體和2,2-二甲基丁烷(2,2-DMB)的質量,g。
2 結果與討論
2.1 Pt/HBeta催化劑活性穩定期的考察
為了保證動力學實驗數據準確可靠,對Pt/HBeta催化劑的活性穩定性進行了評價。評價條件:反應溫度280 ℃、壓力1.0 MPa、質量空速1.0 h-1和氫/油體積比500,原料為正己烷,催化劑裝填量為6.4 g,穩定時間為120 h,結果見圖1。從圖1可看出,反應30 h后,正己烷異構化率基本不變,即催化劑活性處于穩定狀態。
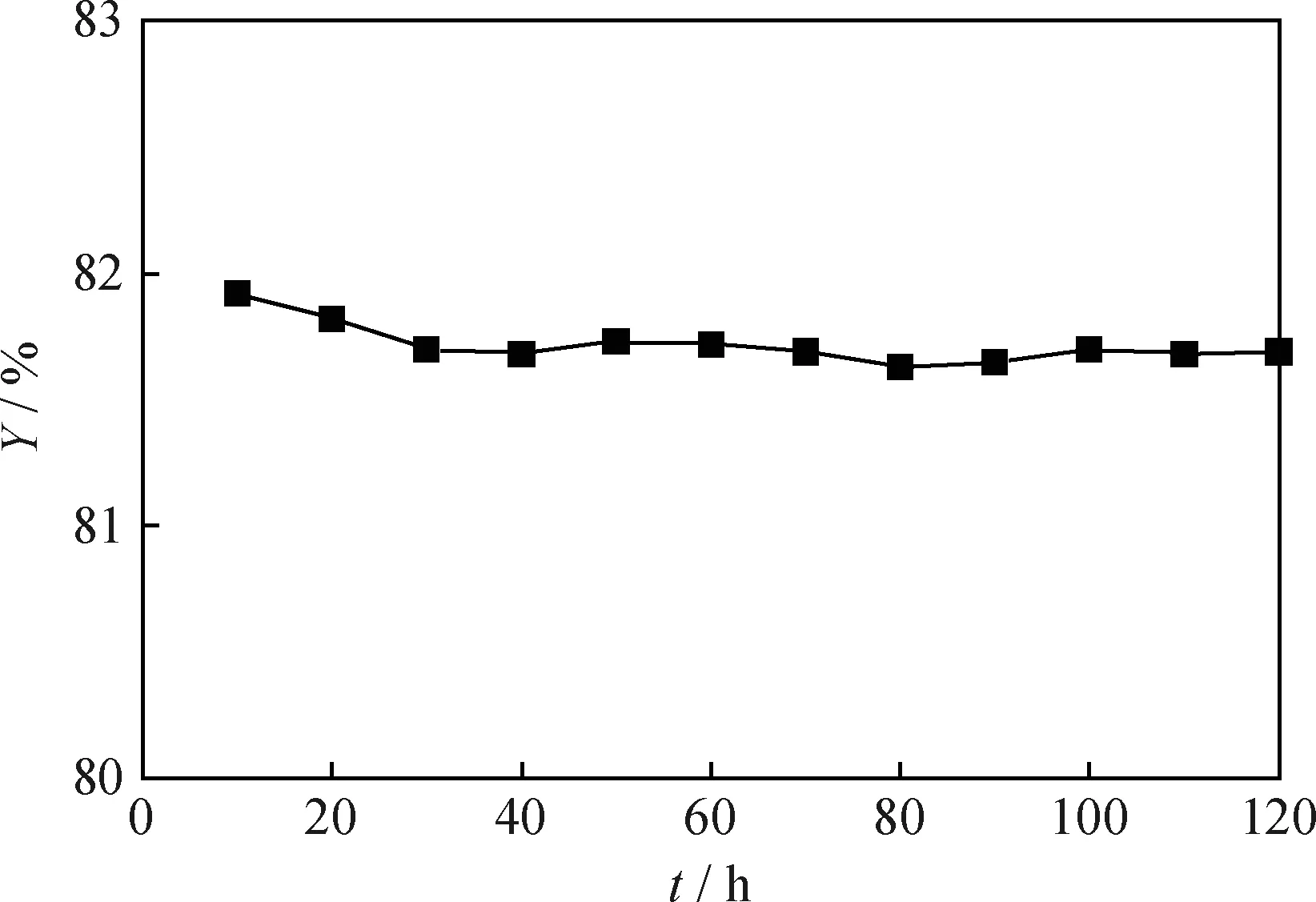
圖1 正己烷在Pt/HBeta催化劑上的異構化反應中正己烷異構化率(Y)隨時間(t)的變化Fig.1 Variation of n-hexane isomerization rate (Y) withtime (t) in the isomerization reaction over Pt/HBeta catalystT=280 ℃; p=1.0 MPa; MHSV=1.0 h-1;V(H2)/V(Oil)=500; m(Catalyst)=6.4
2.2 內外擴散對Pt/HBeta催化劑異構化反應活性的影響
正己烷在Pt/HBeta催化劑上的異構化反應屬于氣-固相催化反應,反應過程主要包括正己烷分子由氣流主體擴散到催化劑顆粒外表面,從催化劑顆粒的外表面擴散到孔道內部,正己烷分子在孔道內表面的活性位上進行反應,己烷異構體分子由內部孔道擴散到催化劑顆粒的外表面,最后從催化劑外表面擴散到氣流主體中[9]。為了能夠對本征動力學進一步研究,需排除內外擴散對真實反應速率測定的影響。
為排除外擴散的影響,Pt/HBeta催化劑裝填量分別為3.2 g和6.4 g,在反應溫度280 ℃、壓力1.0 MPa、氫/油體積比500的條件下,改變正己烷進料的空速,測定其轉化率,并以質量空速為橫坐標對正己烷轉化率作圖,結果見圖2。由圖2可知,當質量空速MHSV≥1.0 h-1時,兩條曲線基本重合,可認為外擴散對真實反應速率測定的影響已經排除。

圖2 外擴散對Pt/HBeta催化劑異構化反應活性的影響Fig.2 Effect of outward diffusion on the isomerizationactivity of Pt/HBeta catalystT=280 ℃; p=1.0 MPa; V(H2)/V(Oil)=500
為排除內擴散的影響,在反應器內裝填相同質量的長度分別為0.5~1.0 mm、2.0~3.0 mm、4.0~5.0 mm的圓柱形Pt/HBeta催化劑(直徑Φ=1.5 mm),在反應溫度280 ℃、壓力1.0 MPa、氫/油體積比500的條件下,改變正己烷進料的空速,測定其轉化率,并以質量空速為橫坐標對正己烷轉化率作圖,結果見圖3。由圖3可知,當催化劑長度不超過2.0~3.0 mm范圍時,正己烷轉化率受催化劑裝填尺寸的影響甚微,可以消除內擴散對反應速率的影響,可認為內擴散對真實反應速率測定的影響已經排除。
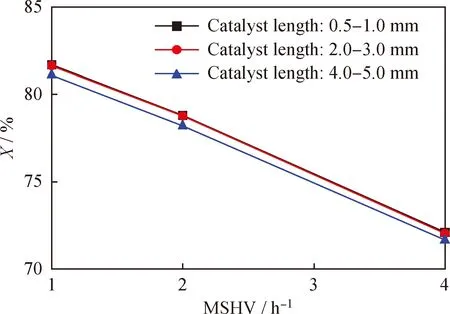
圖3 內擴散對Pt/HBeta催化劑異構化反應活性的影響Fig.3 Effect of internal diffusion on the isomerizationactivity of Pt/HBeta catalystT=280 ℃; p=1.0 MPa; V(H2)/V(Oil)=500
排除內外擴散的實驗也證明了正己烷在Pt/HBeta 催化劑活性位上的異構化反應是速率控制步驟。
2.3 正己烷在Pt/HBeta催化劑上異構化擬一級反應動力學模型的建立
2.3.1 模型推導
正己烷的異構化產物主要包括2-甲基戊烷、3-甲基戊烷、2,2-二甲基丁烷和2,3-二甲基丁烷,因為Pt/HBeta催化劑選擇性大于98%,將上述4種異構體合并成一個組分(i-C6),則正己烷(n-C6)異構化反應可用式(4)表示,正、逆反應速率常數分別為k和k′:
(4)
反應速率ri的表達式為:
(5)
將上式積分得:
(6)
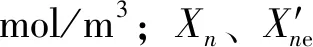
2.3.2 熱力學計算
首先利用Aspen Plus 8.4軟件中的物性常數估算系統(Property constant esimation system)獲取不同溫度下的正己烷和4種異構體的摩爾焓值和摩爾熵值,進而求得ΔH和ΔS,由式(7)和式(8)求得吉布斯自由能變ΔG和熱力學平衡常數K[10]:
ΔG=ΔH-T·ΔS
(7)
ΔG=-RTlnK
(8)
2.3.3 動力學實驗
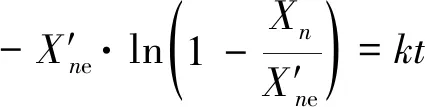
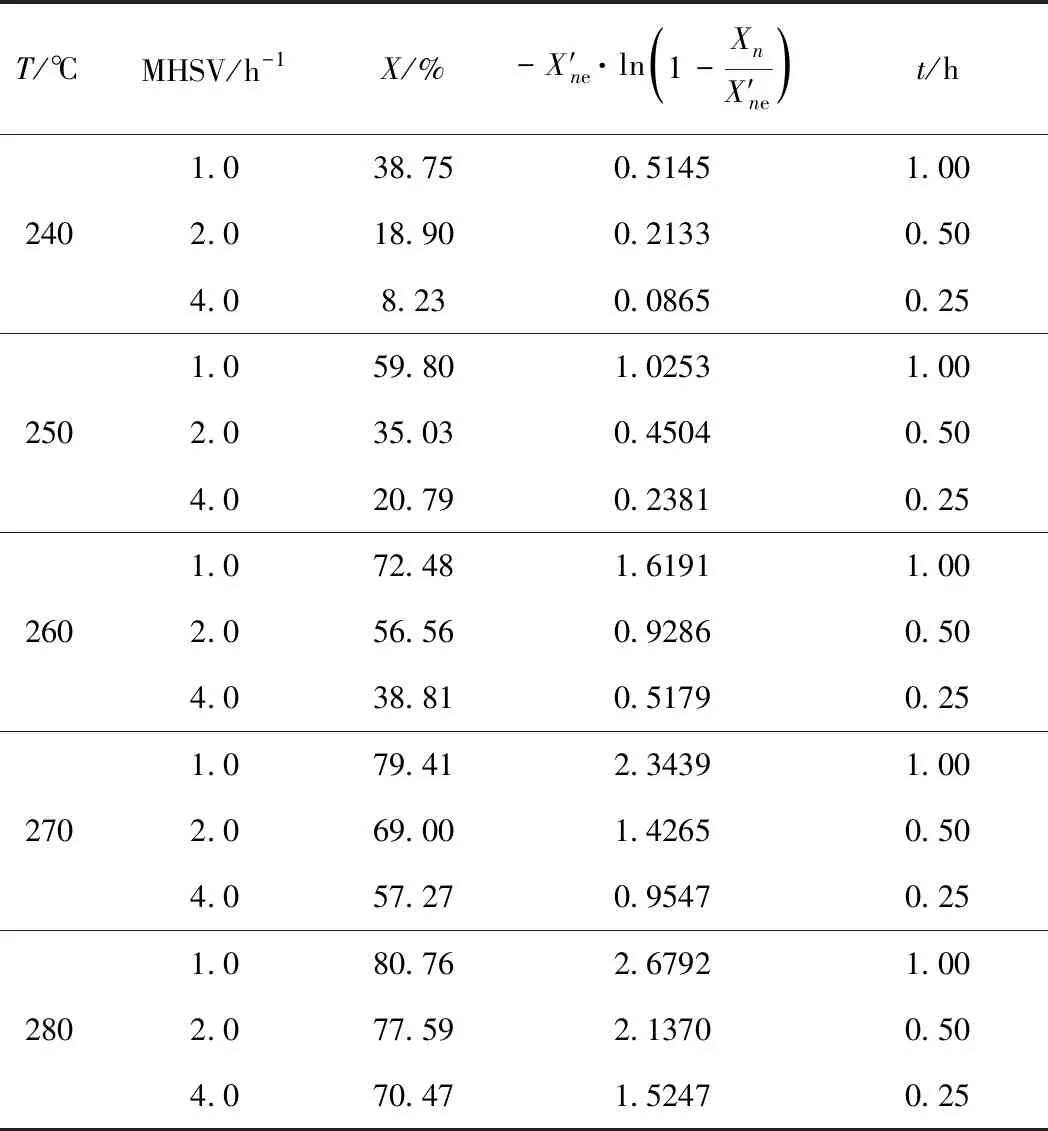
表1 正己烷異構化動力學實驗結果Table 1 The results of kinetics studies ofn-hexane isomerization
p=1.0 MPa;V(H2)/V(Oil)=500

圖4 正己烷異構化反應擬一級反應動力學模型擬合Fig.4 Pseudo-first-order kinetics model fittingfor n -hexane isomerization reaction
根據圖4中擬合直線的斜率,可求取不同溫度下的反應速率常數k和k′,如表2所示,然后根據阿倫尼烏斯公式推導出式(9),對lnk-1/RT進行線性擬合,結果見圖5。
(9)
依據圖5中擬合直線的斜率和截距求得活化能Ea=139.06 kJ/mol,指前因子A=7.3814×1013h-1,并以此求出270 ℃、280 ℃下的正向反應速率常數分別為5.441 h-1、3.118 h-1,逆向為1.016 h-1、0.561 h-1。
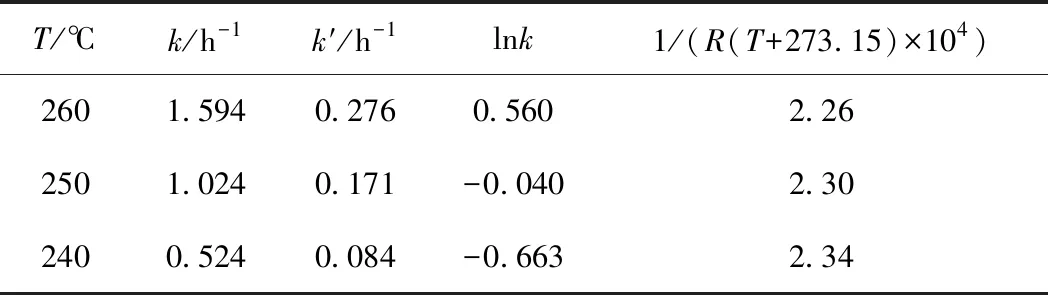
表2 由圖4擬合得到的不同溫度下的反應速率常數Table 2 Reaction rate constant at differenttemperatures from Fig.4
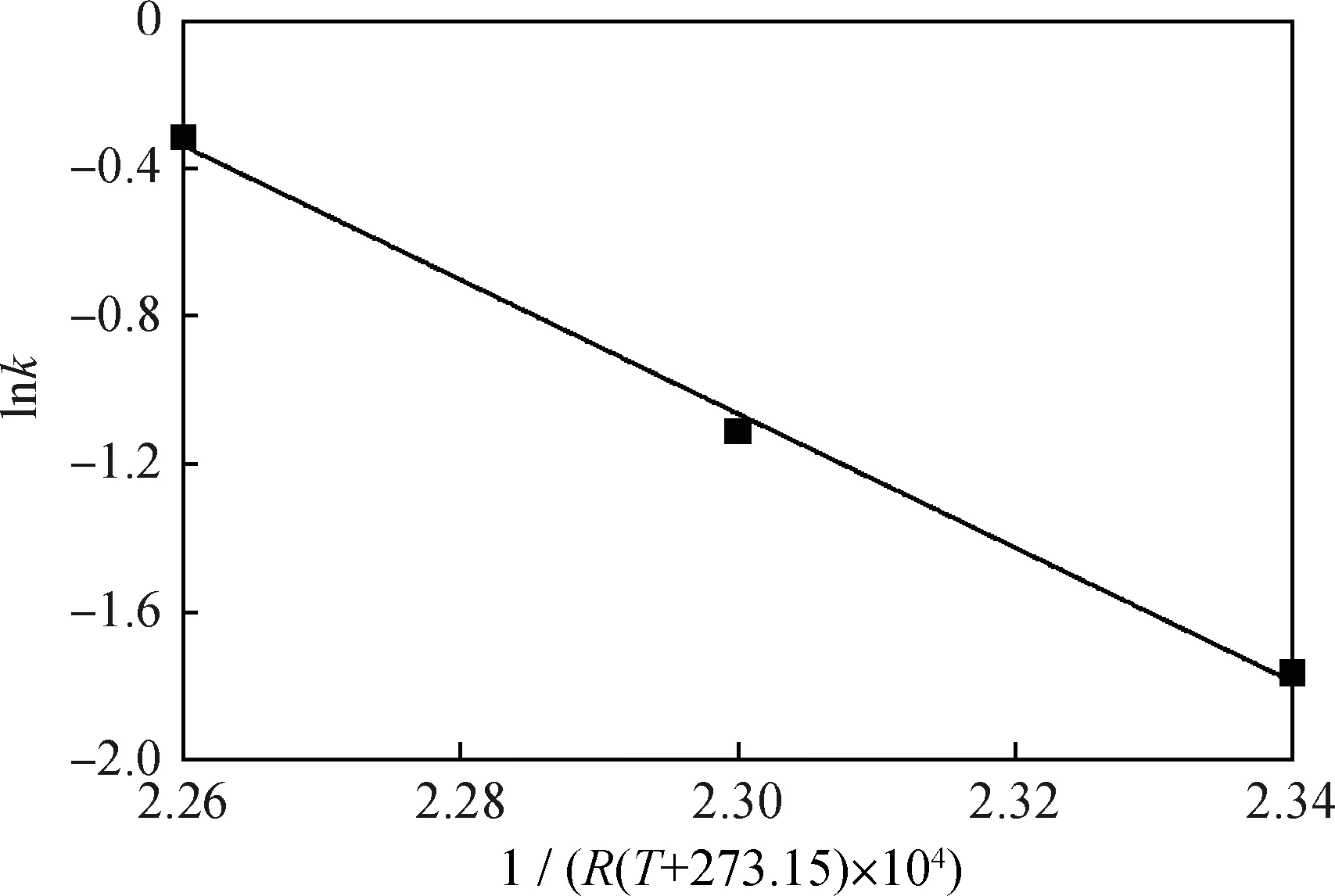
圖5 擬一級反應阿倫尼烏斯活化能的計算Fig.5 Calculations of Arrhenius activation energyfor the pseudo-first-order reaction
2.4 正己烷在Pt/HBeta催化劑上異構化連串反應動力學模型的建立
2.4.1 模型推導
擬一級動力學模型將己烷的4種異構體作為一種組分,無法實現對異構化產物分布的研究,因此,結合已開發的一級反應動力學網絡[5-8],正己烷異構化反應可以認為是直接生成2-甲基戊烷(2-MP)和3-甲基戊烷(3-MP),然后再進一步生成雙支鏈的異構體。其中 2,3-二甲基丁烷 (2,3-DMB) 生成2,2-二甲基丁烷(2,2-DMB)的反應速率常數比較大,因此,在實際產物分布中2,2-DMB的比例更高。同時2,2-DMB也是異構化產物中最理想的清潔汽油調和組分。因此,將異構化反應一分為三,在不計入裂解產物的情況下,正己烷和2,2-DMB的摩爾分數分別用x1和x3表示,而將2-MP、3-MP和2,3-DMB合并為中間組分,其摩爾分數用x2表示,整個異構化反應用式(10)表示,反應速率方程組如式(11)。
(10)

(11)
2.4.2 編程求解模型參數
采用Matlab編程求解連串反應動力學模型參數,程序主要分成函數定義和數值求解兩部分。方程組的求解需要借助ODE45函數,其內核是四階-五階Runge-Kutta算法,是解決常微分方程組數值解的首選函數[12]。誤差控制方面,計算結果與實驗值的均方差小于1.0×10-4。
依次求得240、250和260 ℃下的正、逆反應速率常數,計算結果見表3。

表3 不同溫度下的兩步反應速率常數Table 3 Two-step reaction rate constants at different temperatures
圖6為連串反應分步活化能的計算。根據圖6的擬合結果,求得第一步反應活化能Ea1=167.80 kJ/mol,A1=7.2130×1016h-1;第二步反應活化能Ea2=118.34 kJ/mol,A2=1.3053×1011h-1。并以此求出270 ℃下兩步反應的正向速率常數分別為5.239 h-1、0.543 h-1,逆向速率常數分別為2.897 h-1、0.428 h-1;280 ℃下正向反應速率常數為10.258 h-1、0.871 h-1,逆向為6.094 h-1、0.774 h-1。
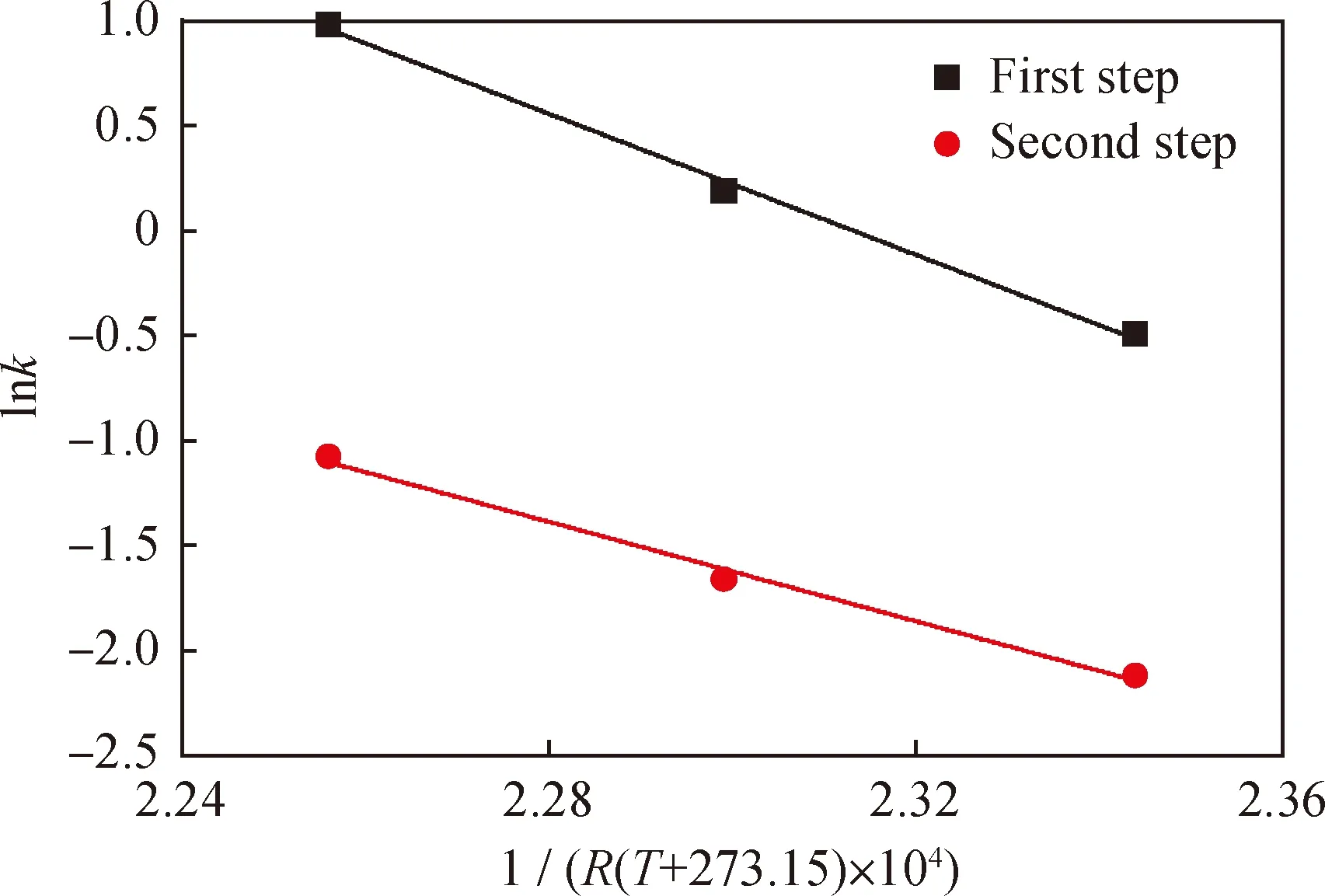
圖6 連串反應分步活化能的計算Fig.6 Calculations of sequential reaction activation energy
2.5 270 ℃和280 ℃下反應級數的修正
從圖4可看出,當異構化反應溫度高于260 ℃,擬合結果為曲線,不符合式(6)中擬一級可逆反應的線性關系。考慮到越接近最適溫度,催化劑的活性也越高,反應路徑有可能發生改變,反應物濃度對速率的影響程度也可能有所變化[13],因此,對270 ℃ 和280 ℃下的反應級數進行修正。
(1)數據采集
270 ℃和280 ℃下的質量空速為1.0 h-1、2.0 h-1、4.0 h-1。
(2)公式推導
反應速率方程表達如式(12),m為反應級數;
(12)
(3)積分形式
(13)
式(12)~(13)中,Cn為反應產物中的正己烷的摩爾濃度,mol/m3;Cn′為反應t′時正己烷的摩爾濃度,mol/m3;t′為相對應的反應時間,h。
(4)數值積分
式(13)左邊的形式不可積,因此考慮采用數值積分的方法。這里選擇quad函數,其內核為自適用的辛普森公式。
(5)修正結果
反應級數修正范圍為1.0~2.0,步長設為0.1,以等式右邊的積分結果(反應時間t)為真值,等式左邊的數值積分結果為估計值,計算均方誤差MSE,并以此為考察指標,修正結果如圖7所示。
由圖7可見,當270 ℃和280 ℃下的反應級數分別為1.3和1.7時,MSE可取得最小值,因此認為,在Pt/HBeta催化劑下的正己烷臨氫異構化反應在270 ℃和280 ℃時分別用1.3和1.7級反應來描述更為合適。
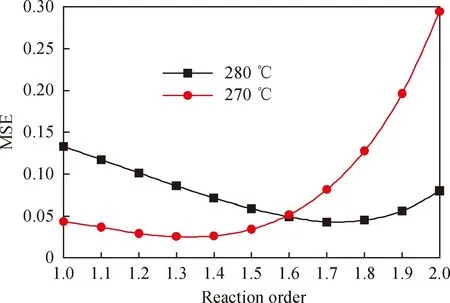
圖7 Pt/HBeta催化劑上正己烷臨氫異構化反應級數的修正Fig.7 Corrections of the reaction order of n-hexanehydroisomerization over the Pt/HBeta catalyst
3 結 論
(1)在240~260 ℃內,正己烷臨氫異構化反應符合擬一級動力學模型,反應的活化能Ea=139.06 kJ/mol和指前因子A=7.3814×1013h-1。
(2)在擬一級動力學模型的基礎上,建立連串反應動力學模型,求得第一步反應活化能Ea1=167.80 kJ/mol,A1=7.2130×1016h-1;第二步反應活化能Ea2=118.34 kJ/mol,A2=1.3053×1011h-1。
(3)正己烷臨氫異構化反應在270 ℃和280 ℃時分別用1.3和1.7級反應來描述更為合適。

