宮頸LEEP刀錐切術后切緣情況與再次手術患者病理情況的關系
鄭曉暉(通信作者),盧萍
廈門長庚醫院病理科 (福建廈門 361022)
宮頸癌是我國常見的婦科惡性腫瘤,但隨著宮頸脫落細胞學與陰道鏡檢查技術的普及與提高,宮頸鱗狀上皮內瘤變的檢出明顯增加,宮頸癌的發病率已降至女性惡性腫瘤的第二位[1]。宮頸高級別上皮內瘤變與宮頸癌的發生、發展密切相關,需積極治療[2]。臨床上治療該疾病患者的方法較多,而宮頸LEEP刀錐切術即宮頸環形電切術,其過程創傷小、安全,簡單易行,因此,在宮頸高級別上皮內瘤變患者的治療中得以廣泛應用[3]。然而,宮頸LEEP刀錐切術后患者的宮頸病變殘留是臨床醫師最為關注的焦點,宮頸切緣的病理觀察可以幫助臨床醫師了解術后患者宮頸情況,便于臨床追蹤與再次手術治療。因此,本研究回顧性分析宮頸LEEP刀錐切術后切緣情況與再次手術患者病理情況的關系,現報道如下。
1 資料與方法
1.1 一般資料
收集2009年6月至2016年6月我院收治的75例宮頸LEEP刀錐切術后再次手術患者資料并開展回顧性分析。患者錐切術前病理檢查證實為宮頸上皮內瘤變(CIN)Ⅱ級、CIN Ⅲ級或鱗狀上皮原位癌,并排除腺癌的可能。75例均已婚,4例無生產史,71例有生產史;發病年齡27~72歲,平均(42.63±4.56)歲,中位年齡43歲。錐切術后再次手術的時間間隔均未超過12個月,期間患者有規律性回診及隨訪資料,其中32例接受全子宮切除術,43例接受再次錐切術,所有手術均在患者知情同意下進行。
1.2 方法
1.2.1宮頸LEEP刀錐切術
于月經干凈后3~7 d手術,患者取膀胱截石位,陰道拉鉤暴露宮頸,以復方碘溶液涂抹整個宮頸,明確病灶范圍,鉗夾宮頸部碘不著色區。在子宮頸病灶外0.5 cm處,用手術刀(功率設置為50 W)以垂直方向做一環形切口,逐漸向宮頸深部做錐形切除。注意錐尖朝向宮頸內口,方向不能偏斜,使宮頸管組織完整地呈錐形切下。錐形底寬2~3 cm,錐高2.5 cm左右。注意止血,并用紗布填塞局部,24 h后取出[4]。
1.2.2病理技術及診斷
切下病灶組織泡入10%甲醛固定液中,12 h后送至病理科;固定后組織經過完整取材、梯度乙醇脫水、二甲苯透明、浸蠟、石蠟包埋、切片及蘇木精-伊紅(hematoxylin eosin,HE)染色后,制成HE片,送病理醫師診斷[5]。病變判斷標準:CIN Ⅰ級,鱗狀細胞核質比增大,染色質增粗,核深染,異形細胞未超過1/3上皮層,伴(或不伴)挖空樣變化;CIN Ⅱ級,異形細胞介于1/3~2/3上皮層,伴(或不伴)挖空樣變化;CIN Ⅲ級,異形細胞超過2/3上皮層,伴(或不伴)挖空樣變化[6];鱗狀上皮原位癌,全層鱗狀細胞癌變,核大小不一,差異大,核質比增大,核深染,癌變細胞未突破基底膜;微浸潤鱗癌,全層鱗狀上皮癌變,并見癌細胞突破基底膜,表淺浸潤基底膜下間質,浸潤寬度<7 mm,深度<5 mm。切緣陰性指宮頸底部切緣及宮頸兩側切緣未見上皮內瘤變;切緣陽性指宮頸底部切緣及(或)宮頸側切緣組織內可見上皮內瘤變;切緣不能評估指由于電刀燒灼,組織變形,HE下不能判斷切緣是否有病變殘留。
1.2.3全子宮切除術
在氣管插管全身麻醉下行腹腔鏡子宮全切除術,于臍窩、左下腹、右下腹做手術切口后CO2氣腹壓力設置為13 mmHg(1 mmHg=0.133 kPa);Trocar穿刺點如上進腹。雙極電凝切雙側圓韌帶、雙側骨盆漏斗韌帶及輸卵管系膜,打開膀胱反折腹膜,下推膀胱達宮頸外口,打開闊韌帶后葉。雙極電凝切雙側子宮動靜脈、雙側骶韌帶及主韌帶,沿宮頸外口環切陰道壁,經陰道取出子宮,腹腔鏡下1-0可吸收線連續縫合陰道壁,查無出血;連續縫合前后腹膜,包埋殘端,沖洗盆腹腔,留置引流管[7]。切除的全子宮送病理檢查,方法同前述。
1.3 臨床評價
統計75例宮頸錐切術后切緣情況與再次手術患者的術后病理檢查結果,共有兩種改變:A術后存在病變(A1兩次病理相同,為病變一致;A2兩次病理不同,后者病變較前者升高,為病變升級;A3后者病變降低,為病變降級);B術后無病變殘留,為不存在病變。
1.4 統計學處理
采用SPSS 22.0統計軟件進行數據分析,計數資料以率表示,采用χ2檢驗,P<0.05為差異有統計學意義。
2 結果
75例宮頸LEEP刀錐切術后,病理診斷CIN Ⅱ級13例,CIN Ⅲ級51例,原位癌8例,微浸潤鱗癌3例;切緣陰性26例,切緣陽性30例,切緣不能評估19例。錐切術后再次手術患者中有32例接受全子宮切除術,43例接受再次錐切術。患者行再次手術后的病理檢查結果發現:切緣陰性中30.77%患者不存在病變,69.23%患者存在病變;切緣陽性中10.00%患者不存在病變,90.00%患者存在病變;切緣不能評估中26.32%患者不存在病變,73.68%患者存在病變。切緣陽性患者病變殘留率最高,其次為切緣不能評估患者,切緣陰性患者最低。且切緣陽性患者病變殘留率高于切緣陰性患者,差異有統計學意義(P<0.05)。見表1。
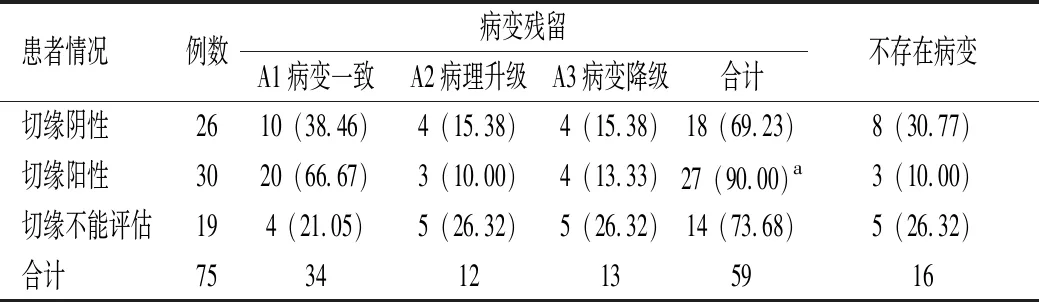
表1 75例宮頸錐切術后切緣情況與再次手術患者的術后病理檢查結果統計[例(%)]
注:與切緣陰性比較,aP<0.05
3 討論
宮頸鱗狀上皮內瘤變屬宮頸癌癌前病變,分為低級別鱗狀上皮內瘤變(LSIL)和高級別鱗狀上皮內瘤變(HSIL),而HSIL又分為CIN Ⅱ級、CIN Ⅲ級及原位癌變。CIN Ⅰ級屬LSIL,一般以隨訪觀察為主;而HSIL與宮頸鱗癌的發生、發展密切相關,需早期發現,早期治療[6-8]。
目前臨床上對宮頸高級別瘤變及宮頸原位癌患者開展宮頸錐切術治療,而錐切后切緣情況關乎患者的追蹤及治療。本研究結果顯示,患者宮頸LEEP刀錐切術后,對切緣情況分組分析發現:(1)與切緣陽性及切緣不能評估患者類似,切緣陰性也存在病變殘留的可能,且所占比例較高,原因可能是瘤變累及腺體,并在腺體區域呈跳躍式生長,即便切緣上沒有瘤變的細胞,但在宮頸管深處或者在宮頸的底部腺體區還有殘留病變的可能;此外,還與患者的年齡及是否妊娠相關,年齡接近絕經期及妊娠相關的患者雌激素水平低,宮頸轉化區向宮頸管內移行,位置較深,不易切除而使病變殘留[9]。(2)切緣陽性,再次手術后未找到殘留病變,可能是由于切緣病變處恰好被電刀完整切除,雖然在切緣上可見病變,但實際病變已被電刀燒灼消除了,因此在再次手術切除的檢體中可以找不到病變;也有可能是由于患者再次手術后的病理取材并不到位,出現殘存病變遺漏情況,雖然這樣的概率較小,但仍提醒病理醫師需考慮取材減少致病變假陰性的可能。(3)切緣陽性較切緣陰性及切緣不能評估患者病變殘留率高,且病變一致較多,即HSIL患者切緣陽性,再次切除術后還是HSIL,因此,宮頸錐切術后HSIL患者切緣陽性者需密切隨訪,必要時補充手術治療[10-11]。(4)不少患者接受再次手術后仍然存在病變,因此術前應充分了解患者情況,如患者年齡是否接近絕經期,是否在產后或懷孕狀態,錐切時注意病變位置及時調整切除范圍。平時多積累關于碘溶液處理后宮頸病變顯示的肉眼觀察經驗,可以提高病變切除的概率,防止病變殘留。(5)本研究還發現有再次手術后病變升級成為宮頸鱗癌的患者,其全部存在于切緣陽性,且切緣為HSIL的患者,因此切緣為HSIL是隨訪人群中的重中之重,定期細胞學及人乳頭瘤病毒(HPV)檢測利于病變及時發現及治療。(6)手術后病變降級則是由于HSIL患者往往還同時合并LSIL,因此,兩次術后病理不一致也可能存在。
綜上所述,宮頸LEEP刀錐切術后無論切緣情況如何,均有病變殘留的可能,不能因為其切緣陰性而放松對患者的隨訪觀察。若切緣陽性,常預示著剩余宮頸組織中有殘存病灶的可能性大,需對患者密切追蹤,必要時可補充手術治療。宮頸錐切術的切緣情況對患者預后評估非常重要,也是患者術后是否需要接受再處理的指征之一[4-5],若患者比較年輕,存在生育要求,或是存在保留子宮的需求,則可予以重復性宮頸錐切術[12];若患者年齡較大,不存在生育要求,則可予以全子宮切除術[7]。

