血清學指標聯合小兒危重病例評分和Brighton兒童早期預警評分預測膿毒癥患兒死亡的巢式病例對照研究
盧艷輝,劉振奎,李世陽,王艷飛,李春梅,袁二偉,邢靜,郭衛平
膿毒癥是由感染引起的全身炎癥反應綜合征,是目前兒童重癥監護室中患兒死亡的主要原因之一,其病情兇險,病死率較高[1]。盡管臨床已積極進行抗感染干預,根據患兒病情采用多種方式治療,盡量預防患兒發生膿毒性休克和多器官功能不全,但由于病情復雜、多重感染、早期診斷延誤等,其醫院病死率仍高達30%~60%[2]。多項研究表明,早期監測患兒預后進展對降低患者病死率極為重要[3]。常用生化指標如血清降鈣素原(PCT)、C反應蛋白(CRP)、清蛋白(Alb)等對膿毒癥患兒治療后并發癥的評估具有一定的價值,其中CRP評估機體組織損傷和感染具有較高的靈敏度,PCT較CRP具有較高的靈敏度和特異度,Alb則與危重疾病嚴重程度關系密切,但關于上述指標的研究均是從整個疾病周期的變化情況加以闡述,并不能在疾病的早期對患兒并發癥做出較為可靠的預測[4]。近年來,國內常采用小兒危重病例評分(PCIS)來評估膿毒癥患兒治療后并發癥的發生情況[5],但由于操作過于復雜,無法快速對患兒做出判斷。所以目前針對膿毒癥患兒重癥死亡的評估仍是臨床上亟須解決的難題。早期預警評分(EWS)是一種簡單易操作的病情風險評估系統,全錦花等[6]報道其可以有效評估老年嚴重膿毒癥患者治療后恢復狀況,然而在兒童膿毒癥重癥死亡方面鮮有報道。由于兒童的檢測指標變動范圍較大,單一指標用于評價膿毒癥患兒治療后情況的個體差異較大,本研究采用前瞻性巢式病例對照研究來評估血清學指標聯合PCIS、Brighton兒童早期預警評分(PEWS)預測膿毒癥患兒死亡的價值,以期應用于臨床,旨在較為準確地評估膿毒癥患兒治療后恢復情況,減少并發癥及死亡。
1 對象與方法
1.1 研究對象 選取2015年12月—2016年12月在河北北方學院附屬第一醫院確診的膿毒癥患兒205例為研究對象。其中男143例,女62例;年齡6個月~16歲,平均年齡(3.5±1.3)歲。納入標準:(1)符合《兒童膿毒性休克(感染性休克)診治專家共識(2015版)》[7]中的診斷標準;(2)年齡>28 d;(3)住院時間>3 d。排除標準:(1)存在血液系統疾病史;(2)既往確診有自身免疫性疾病;(3)存在染色體疾病及遺傳代謝性疾病;(4)存在終末期腎病或慢性肝病;(5)營養不良及低血糖患兒。所有患兒及家屬簽署知情同意書,本研究獲河北北方學院附屬第一醫院醫學倫理委員會批準。
1.2 治療方式 患兒入院后即進行常規治療,確保氣道通暢無礙,置入深靜脈導管監測中心靜脈壓(CVP)及中心靜脈血氧飽和度(ScvO2)。循環治療措施包括:液體復蘇,20 ml/kg 0.9%氯化鈉溶液靜脈注射后根據心率、血壓、脈搏等觀察患兒體循環灌注改善情況以判斷是否需要2、3次補液。若復蘇后CVP≤2 mm Hg(1 mm Hg=0.133 kPa),提示可迅速靜脈滴注,使CVP達到8~10 mm Hg(機械通氣者CVP則需達到12 mm Hg),保持平均氣道壓力(MAP)≥65 mm Hg,尿量≥0.5 ml·kg-1·h-1,ScvO2≥0.70;液體復蘇后,仍存在難以糾正的低血壓及低灌注時,需應用血管活性藥物(多巴胺或合用多巴酚丁胺、腎上腺素/去甲腎上腺素)改善氧運輸;盡快完成影像學檢查確定感染源,運用頭孢類/碳青霉烯類/合并青霉素等藥物進行抗生素治療,靜脈給予抗生素前需抽血進行血培養(靜脈穿刺);后續治療措施可有腎上腺皮質激素、胰島素、連續血液凈化等。對于嚴重膿毒癥合并氧合障礙的患兒,初步治療無效,出現氧合進行性下降、伴或不伴呼吸窘迫、鼻翼翕動、三凹征、呻吟等癥狀應盡早行機械通氣治療;此外,嚴重膿毒癥合并器官衰竭〔格拉斯哥昏迷評分(GCS)<8分〕、感染性休克、左心衰竭、毛細血管滲漏綜合征及導致急性呼吸窘迫綜合征(ARDS)患兒根據病情行機械通氣治療。
1.3 研究方法
1.3.1 一般資料收集 收集患兒性別、年齡、體溫、體質量、原發感染部位、基礎疾病、1 h內應用抗菌藥情況、機械通氣時間、血管活性藥物維持時間、電解質紊亂發生情況、并發癥(ARDS、休克)發生情況、多器官功能障礙綜合征(MODS)受累器官個數,其中ARDS的診斷參照中華醫學會重癥醫學分會制訂的《急性肺損傷/急性呼吸窘迫綜合征診斷與治療指南(2006)》[8]。
1.3.2 血液樣本采集 患兒入院后8~12 h用真空采血管采取清晨空腹靜脈血3管,每管3 ml。將其中1管3 000 r/min離心10 min(離心半徑13.5 cm),取上清液,凍存于-20 ℃冰箱備用。剩余2管全血用于檢測白細胞計數(WBC)。
1.3.3 血清學指標測定 WBC采用全自動血細胞分析儀進行檢測。PCT采用電化學發光法測定,儀器為德國Roche公司E170電化學發光儀及配套PCT試劑盒,參考范圍0~0.5 μg/L。CRP采用速率散射比濁法測定,儀器為美國Beckman公司Immage全自動免疫分析儀,參考范圍0~8 mg/L。Alb采用美國Beckman公司LX20全自動生化分析儀測定,參考范圍0~35 g/L。
1.3.4 PCIS、Brighton PEWS測定 PCIS測定標準較為復雜,按評分指標分為心率、血壓(收縮壓)、呼吸、動脈血氧分壓(PaO2)、pH值、Na+、K+、肌酐(Cr)或血尿素氮(BUN)、血紅蛋白(Hb)、胃腸系統,其評分越低表明病情越重,詳見表1。
入院后24 h內進行Brighton PEWS測定,Brighton PEWS分為意識狀態、心血管系統及呼吸系統3個方面,根據各指標異常程度按0~3分進行評分,分值越大表明病情越重。其中意識狀態分為0分(正常)、1分(嗜睡)、2分(激惹)、3分(昏睡/昏迷),心血管系統分為0分(膚色粉紅,毛細血管充盈時間1~2 s)、1分(膚色蒼白,毛細血管充盈時間3 s)、2分(膚色發灰,毛細血管充盈時間4 s,心率與參考值相比上升20次/min)、3分(膚色發灰并伴有濕冷,毛細血管充盈時間≥5 s,心率與參考值相比上升30次/min或發生心動過緩),呼吸系統分為0分(參考范圍)、1分(呼吸頻率與參考值相比上升10次/min,吸入氧濃度分數為20.3或吸入氧流量為4 L/min)、2分(呼吸頻率與參考值相比上升20次/min,吸氣時可發生凹陷,吸入氧濃度分數為20.4或吸入氧流量為4 L/min)、3分(呼吸頻率與參考值相比減少5次/min,伴胸骨吸氣性凹陷,吸入氧濃度分數為20.5或吸入氧流量為8 L/min)。
本文創新點:
兒童膿毒癥是危重患兒死亡的主要原因之一,其發病率高,進展快,病死率高。盡管一些非特異性血清指標已被證明具有潛在評估膿毒癥患兒治療后并發癥及死亡的臨床價值。但由于各類指標多與炎癥相關,早期診斷及預測效果并不理想。目前,對于兒童膿毒癥治療后死亡的早期預測指標探索已成為臨床工作的重點及難點之一。本文通過前瞻性巢式病例對照研究發現:清蛋白(Alb)聯合小兒危重病例評分(PCIS)、Brighton兒童早期預警評分(PEWS)對膿毒癥患兒死亡的早期預測價值更高,提示單一指標變化范圍較大,易受個體差異影響;而多指標聯合能在一定程度上減少組織、機體代償等各方面差異對評估結果的影響,提高正確率。上述結果對于指導臨床醫生調整膿毒癥患兒的治療方案及進一步降低患兒治療后并發癥發生率及病死率是十分重要的參考。
1.4 分組 以入院確診膿毒癥/嚴重膿毒癥為起點,死亡或出院為終點,采用巢式病例對照研究方法,將研究期間發生死亡的患兒定義為試驗組。另外,每當隊列內出現1例患兒死亡時,在該隊列尚未死亡的患兒中按1∶1匹配同步選取性別、年齡(<3歲)、原發感染部位等條件相近或相同的患兒作為對照組。
1.5 統計學方法 采用SPSS 19.0軟件進行統計學分析。符合正態分布及方差齊性的計量資料以(±s)表示,兩組間比較采用成組t檢驗;計數資料以相對數表示,組間比較采用χ2檢驗;患兒死亡影響因素分析采用多因素Logistic回歸分析;繪制PCT、Alb、PCIS、Brighton PEWS預測膿毒癥患兒死亡的ROC曲線,計算AUC、靈敏度、特異度。以P<0.05為差異有統計學意義。
2 結果
2.1 一般情況 根據巢式病例對照研究設計最終共選出94例膿毒癥患兒進行分析,試驗組47例,對照組47例,病死率為22.9%。兩組患兒性別、年齡、體溫、體質量、原發感染部位、基礎疾病、血管活性藥物維持時間、ARDS發生率、WBC、CRP比較,差異無統計學意義(P>0.05);試驗組1 h內應用抗菌藥率、電解質紊亂發生率、休克發生率、MODS受累器官個數、PCT、Brighton PEWS大于對照組,機械通氣時間長于對照組,Alb、PCIS小于對照組,差異有統計學意義(P<0.05,見表2)。

表1 小兒危重病例評分測定標準Table 1 The measurement standard of pediatric critical illness score
2.2 膿毒癥患兒死亡影響因素的多因素Logistic回歸分析 以患兒是否死亡為因變量(賦值:是=1,否=0),1 h內應用抗菌藥情況(賦值:是=1,否=2)、機械通氣時間(賦值:實測值)、電解質紊亂發生情況(賦值:是=1,否=2)、休克發生情況(賦值:是=1,否=2)、MODS受累器官個數(賦值:實測值)、PCT(賦值:實測值)、Alb(賦值:實測值)、PCIS(賦值:實測值)、Brighton PEWS(賦值:實測值)為自變量,進行多因素Logistic回歸分析,結果顯示,1 h內應用抗菌藥、休克、MODS受累器官個數、PCT、PCIS、Brighton PEWS是膿毒癥患兒死亡的影響因素(P<0.05,見表3)。
2.3 PCT、Alb、PCIS、Brighton PEWS及Alb聯合PCIS、Brighton PEWS預測膿毒癥患兒死亡的價值 PCT、Alb、PCIS、Brighton PEWS預測膿毒癥患兒死亡的AUC分別為 0.730、0.761、0.734、0.771,臨界值分別為10.6 μg/L、38.4 g/L、73.9分、6.2分;Alb聯合PCIS、Brighton PEWS預測膿毒癥患兒死亡的AUC為0.838,臨界值為0.65,靈敏度為76.8%,特異度為85.3%。Alb聯合PCIS、Brighton PEWS預測膿毒癥患兒死亡的AUC分別高于其單獨預測膿毒癥患兒死亡的AUC,差異有統計學意義(Z=3.324、4.018、3.875,P=0.044、0.036、0.040,見圖1)。
3 討論
膿毒癥是由感染引起的機體炎性反應,引起感染的微生物在臨床上以細菌為主,早發現、早診斷、早治療對患兒治療后并發癥影響顯著。患兒在發病初期臨床表現缺乏特異性,然而一旦激發炎癥級聯瀑布反應,其病情將急轉直下,即使延誤數小時,也能使患兒病死率明顯上升[9]。目前研究證明,CRP、Alb、PCIS、Brighton PEWS等可不同程度評估膿毒癥患兒的治療后恢復情況[10],然而在整個疾病周期中,兒童各指標受個體及環境影響其變化范圍較大,目前的評估方法不足以準確評估膿毒癥患兒治療后恢復程度[11]。為了探索一種更精確的評估膿毒癥患兒死亡的手段,本研究采用巢式病例對照研究來評估各指標預測膿毒癥患兒死亡的價值。
美國流行病學資料顯示,膿毒癥患兒病死率為10.3%,有基礎疾病的患兒病死率升高至12.8%[12];方伯梁等[13]研究表明膿毒癥患兒病死率為3.9%~23.0%。本研究205例患兒共死亡47例,病死率為22.9%,相對較高,與上述研究結果基本相符。筆者認為,膿毒癥患兒病死率相對較高與確診時間晚有關,由于膿毒癥臨床癥狀以發熱為主,發病早期難以引起重視,故容易誤診、誤治。兒童由于免疫力低于成人,故發生感染后病情進展迅速,有研究表明對于確診為膿毒癥的患兒,1 h內立刻給予抗菌治療能夠及時清除感染灶,防止膿毒癥進一步惡化[14]。根據膿毒癥的發病機制,最常發生組織灌注壓不足及組織缺氧[15],因此在早期治療中還應注意糾正休克表現,適當給予機械通氣。當膿毒癥患兒感染控制不理想或病情惡化時,常表現為休克、MODS[16]。因此,當膿毒癥患兒出現休克或MODS時,尤其患兒MODS受累器官個數增多時,多與預后不良相關。血清學指標能夠更加客觀地反映病情變化,為評估疾病治療后轉歸情況提供直接依據。
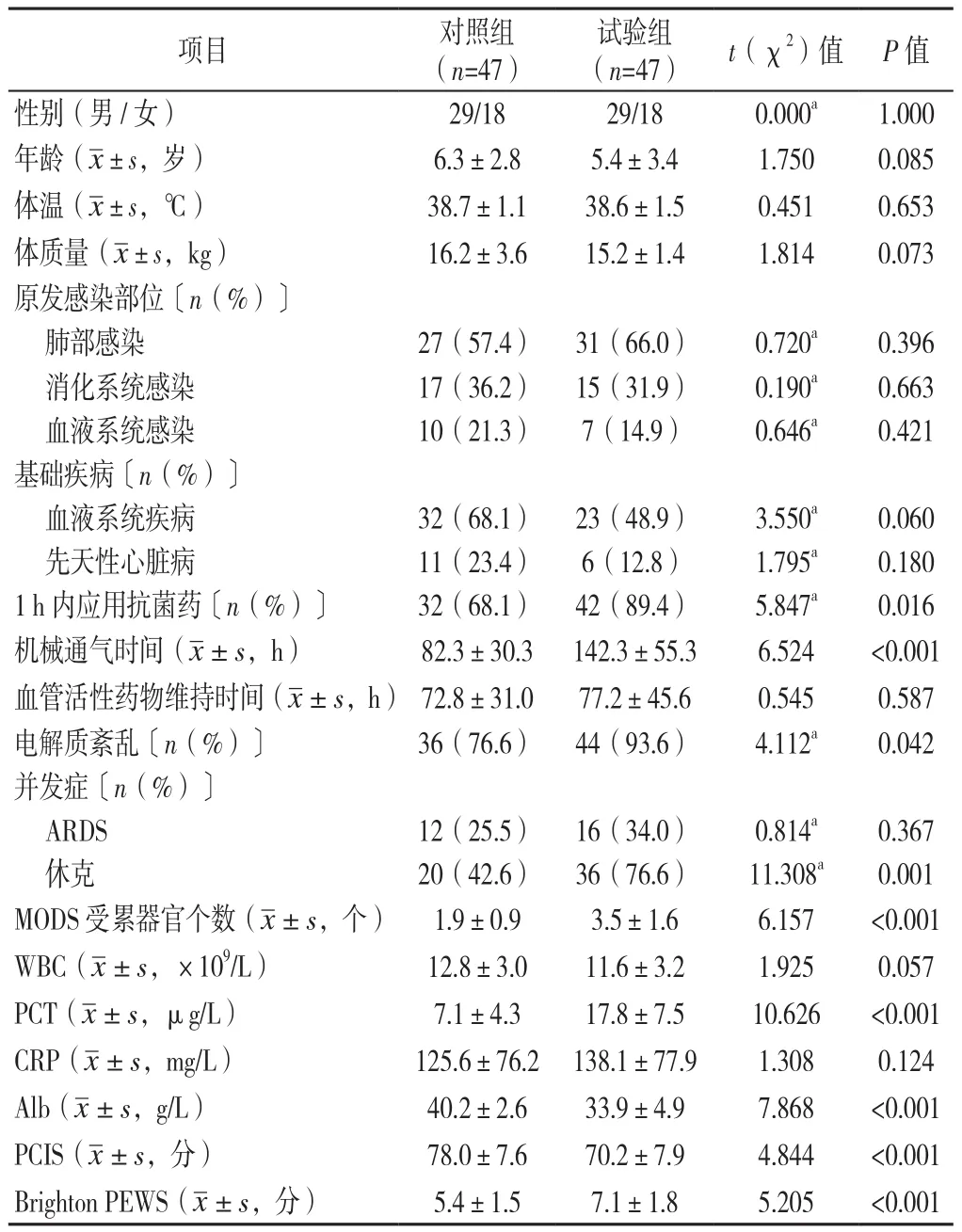
表2 兩組患兒一般資料、血清學指標、PCIS、Brighton PEWS比較Table 2 Comparison of baseline data,serological indicators,PCIS,and Brighton PEWS between the two groups
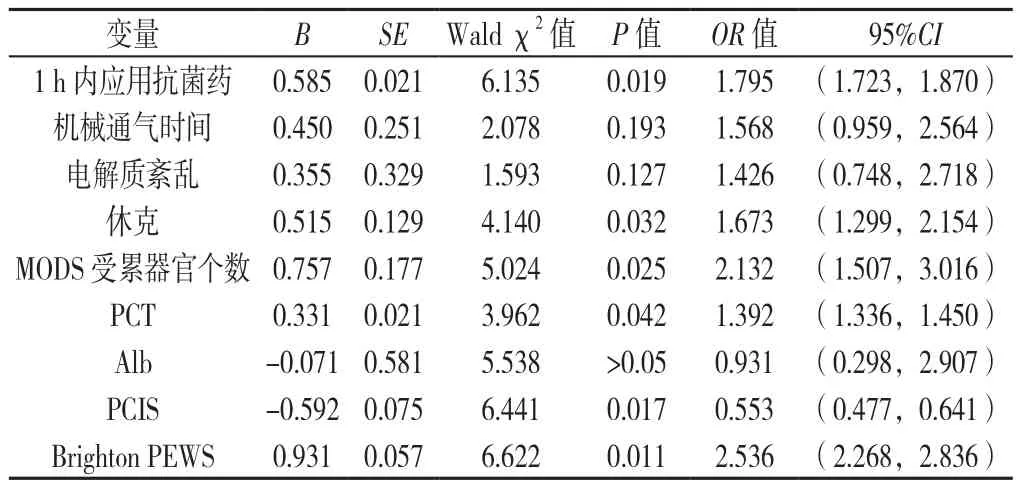
表3 膿毒癥患兒死亡影響因素的多因素Logistic回歸分析Table 3 Multivariate Logistic regression analysis of factors influencing death in children with sepsis
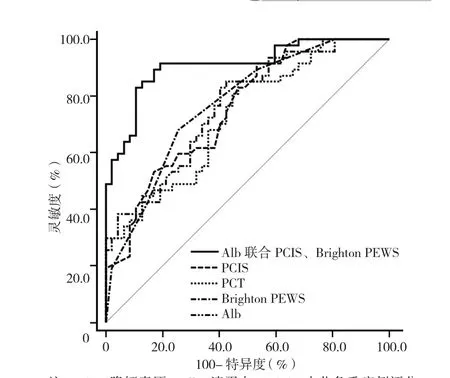
圖1 PCT、Alb、PCIS、Brighton PEWS及 Alb聯 合 PCIS、Brighton PEWS預測膿毒癥患兒死亡的ROC曲線Figure 1 ROC curve analysis of PCT,Alb,PCIS,Brighton PEWS and Alb combined with PCIS and Brighton PEWS in predicting death in children with sepsis
基于已有研究對影響膿毒癥患兒死亡的分析[17],本研究結果顯示,1 h內應用抗菌藥、休克、MODS受累器官個數、PCT、PCIS、Brighton PEWS是膿毒癥患兒死亡的影響因素。PCT是甲狀腺C細胞分泌的降鈣素前體蛋白,細菌內毒素、白介素等炎性遞質均可刺激肝、腎、脾的神經內分泌細胞分泌PCT。研究表明,PCT在診斷膿毒癥方面較CRP有更高的靈敏度和特異度[18]。此外,多項研究表明,Alb可以反映機體的營養狀況及免疫功能,其水平的下降程度可用來反應疾病的嚴重程度[19]。PCIS由中華兒科學會急診組及中華急診醫學會兒科組制定,是國內評估患兒預后的常用評分系統[20]。上述指標均具有評估膿毒癥患兒死亡的潛在臨床價值。本研究進一步分析發現,對患兒死亡的影響從大到小依次是:Brighton PEWS、MODS受累器官個數、PCIS、1 h內應用抗菌藥、休克、PCT。筆者分析Brighton PEWS之所以影響最大是因為該評分系統操作簡便,不需要使用特殊設備即可連續、動態監測患兒病情,這使得醫務人員能對患兒病情的評估更加客觀、準確,避免了經驗性的主觀判斷[21]。相對于PCIS的繁瑣復雜、難于記憶、不利于危重病癥病情的快速判斷,Brighton PEWS更為簡潔,避免了運用血氣分析等基層醫院未具備的設備,且不需反復多次測定,減少了操作流程,可快速有效地判斷患兒病情嚴重程度[22]。因此,對入院患兒進行Brighton PEWS測評,且可以依據該結果早期干預,從而改善患兒的并發癥致死情況。目前國內外文獻雖已有PCIS應用于膿毒癥患兒的報道[22],但少有Brighton PEWS用于評估膿毒癥患兒死亡的報道,根據本研究結果,Brighton PEWS聯合血清學指標用于死亡預測的價值值得推廣。
由于患兒檢測指標變化范圍較大,并且兒童代償機制較成人復雜,這些均會影響PCT、Alb、Brighton PEWS分別作為單一指標評估膿毒癥患兒死亡的價值。本研究結果顯示,Alb聯合PCIS、Brighton PEWS預測膿毒癥患兒死亡的AUC分別高于其單獨預測膿毒癥患兒死亡的AUC,提示Alb聯合PCIS、Brighton PEWS能在一定程度上減少組織、機體代償等各方面差異對評估結果的影響,提高正確率。
與此同時,本研究也存在一定的局限性:首先,樣本量較少,本研究通過巢式病例對照研究共選出94例患兒作為最終研究對象。其次,本研究只檢測患兒入院時血清學指標,沒有檢測后續指標,無法反應各指標隨時間變化的趨勢。在下一步研究中將擴大樣本量,并對相關指標進行動態監測。
綜上所述,Alb聯合PCIS、Brighton PEWS對膿毒癥患兒死亡有較好的預測能力,有望作為臨床早期預測膿毒癥患兒死亡的輔助指標之一,減少并發癥及死亡,提高患兒生存率。

